আয়ন

আয়ন হলো নিট বৈদ্যুতিক আধানযুক্ত কণিকা, পরমাণু বা অনু।
সাধারণত ইলেকট্রনের আধান ঋণাত্মক ধরা হয়। একক আয়নের ঋণাত্মক আধান সাধারণত প্রোটনের ধনাত্মক আধানের সমান ও বিপরীত। ইলেকট্রন ও প্রোটনের সংখ্যা সমান না হওয়ার কারনে আয়নের নিট আধান অশূন্য হয়।
ক্যাটায়ন হলো ইলেকট্রনের চেয়ে প্রোটনের সংখ্যা বেশি থাকায় ধনাত্মক আধানযুক্ত আয়ন এবং অ্যানায়ন হলো প্রোটনের চেয়ে ইলেকট্রনের সংখ্যা বেশি থাকায় ঋণাত্মক আধানযুক্ত আয়ন। ক্যাটায়ন ও অ্যানায়নসমূহ খুব সহজেই একে অপরকে আকর্ষণ করে এবং আয়নিক যৌগ গঠন করে।
আয়নে কেবল একটি মাত্র পরমাণু থাকলে তাকে একপরমাণবিক আয়ন এবং দুই বা ততোধিক পরমাণু থাকলে বহুপারমাণবিক আয়ন বলে। প্রবাহীতে (গ্যাস বা তরল) ভৌত আয়নীকরণের ক্ষেত্রে স্বতঃস্ফূর্ত সংঘর্ষের কারণে "আয়ন যুগল" উৎপন্ন হয়, যেখানে প্রতি যুগলে একটি ইলেকট্রন এবং একটি ধনাত্মক আয়ন থাকে।[১] আয়নসমূহ রাসায়নিক মিথস্ক্রিয়ায় যেমন তরলে লবণের দ্রবীভূতকরণ বা অন্য উপায়ে যেমন পরিবাহী দ্রবণের মধ্য দিয়ে একমুখী বিদ্যুৎ প্রবাহিত করা, আয়নিকরণের মাধ্যমে অ্যানোডকে দ্রবীভূত করেও তৈরি করা হয়।
আবিষ্কারের ইতিহাস
[সম্পাদনা]১৮৩৪ সালে ইংরেজ পদার্থবিদ এবং রসায়নবিদ মাইকেল ফ্যারাডে জলীয় মাধ্যমে এক তড়িৎদ্বার থেকে অন্য তড়িদদ্বারে যাওয়া একটি অজানা বৈশিষ্ট্য আবিষ্কার করেছিলেন। তিনি গ্রিক শব্দ ἰόν, ion, থেকে এর নামকরন করেছিলেন আয়ন, যার অর্থ "যাওয়া"।[২][৩] ফ্যারাডে এই বৈশিষ্ট্যের প্রকৃতি জানতেন না, তবে তিনি জানতেন যেহেতু ধাতু এক তড়িদদ্বারে দ্রবীভূত হয়ে দ্রবণে প্রবেশ করে এবং দ্রবণ থেকে অন্য তড়িদদ্বারে নতুন ধাতু বের হয়; এবং কোনও এক ধরনের পদার্থ তড়িৎ প্রবাহের ফলে দ্রবণের মধ্য দিয়ে চলাচল করেছে। এটি পদার্থকে এক জায়গা থেকে অন্য জায়গায় পৌঁছে দেয়। ফ্যারাডের নামের সাথে মিল রেখে হুইল অ্যানোড ও ক্যাথোডের, এবং এদের দ্বারা আকৃষ্ট আয়নকে যথাক্রমে অ্যানায়ন ও ক্যাটায়ন নামকরণ করেছিলেন।[৪]
সভান্তে আরিয়েনিউস তাঁর ১৮৮৮ সালের গবেষণামূলক প্রবন্ধে তিনি ব্যাখ্যা দিয়েছিলেন যে লবণের কঠিন স্ফটিক দ্রবীভূত হওয়ার সময় বিপরীত ও সমপরিমাণ আধানযুক্ত কণায় বিচ্ছিন্ন হয়ে যায়। এই ব্যাখ্যার জন্য ১৯০৩ সালে তিনি রসায়নে নোবেল পুরস্কার অর্জন করেছিলেন।[৫] আরিয়েনিউসের ব্যাখ্যা ছিল যে দ্রবণ তৈরি করার সময় লবণ ফ্যারাডের বর্ণিত আয়নে বিচ্ছিন্ন হয়ে যায়। তিনি প্রস্তাব দিয়েছিলেন যে তড়িৎ প্রবাহ ছাড়াও আয়নসমূহ গঠিত হয়।[৬][৭][৮]
বৈশিষ্ট্য
[সম্পাদনা]আয়নসমূহ তাদের গ্যাসীয় অবস্থায় অত্যন্ত সক্রিয় এবং খুব দ্রুত তাদের বিপরীত আয়নের সাথে বিক্রিয়া করে নিরপেক্ষ যৌগ বা আয়নিক লবণ উৎপন্ন করে। আয়নসমূহ তলর বা কঠিন অবস্থায়ও উৎপন্ন হতে পারে, যেমন দ্রাবকের (যেমন পানি) সাথে লবণের বিক্রিয়াকালে আয়নসমূহ তরলের সাথে বিক্রিয়া করার জন্য একে অপরের থেকে দূরে সরে যায় এবং একারনে শক্তি ও এনট্রপিসহ বিভিন্ন অবস্থার পরিবর্তনের ফলে অধিক স্থিতিশীল সলভেটেড আয়ন উৎপন্ন হয়। এই স্থিতিশীল আয়নসমূহ কম তাপমাত্রায় পরিবেশে বেশি দেখা যায়। একটি সাধারণ উদাহরণ হলো সমুদ্রের পানিতে উপস্থিত আয়নগুলি, যা দ্রবীভূত লবণ থেকে উদ্ভূত হয়।
চার্জিত বস্তু হিসাবে, আয়নগুলি বিপরীত বৈদ্যুতিক আধানের প্রতি আকৃষ্ট হয় (ঋণাত্মক ধনাত্মকের প্রতি এবং ধনাত্মক ঋণাত্মকের প্রতি) এবং একই প্রকৃতির আধান কর্তৃক বিকর্ষীত হয়। চলাচলের সময় এগুলোর গতিপথ চৌম্বক ক্ষেত্র দ্বারা প্রতিবিম্বিত করা যেতে পারে।
ইলেক্ট্রনগুলি তাদের ক্ষুদ্র ভর এবং পদার্থ তরঙ্গ হিসাবে বৃহত্তর স্থান পূরণের বৈশিষ্ট্যের কারণে এমন পরমাণু এবং অণুগুলি যাতে অন্তত একটি ইলেকট্রন রয়েছে তার আকার নির্ধারণ করে। সুতরাং, অ্যানায়নগুলি (ঋণাত্মক আধানযুক্ত আয়ন) মূল অণু বা পরমাণুর চেয়ে বড়, কারণ অতিরিক্ত ইলেকট্রন(গুলি) একে অপরকে দূরে সরিয়ে দেয় এবং আয়নটির আকার বৃদ্ধি করে দেয়, কারণ অণু বা পরমাণুর আকার তার ইলেকট্রন মেঘ দ্বারা নির্ধারিত হয়। ইলেকট্রন মেঘের আকারের কারণে ক্যাটায়নগুলি সংশ্লিষ্ট মূল অণু বা পরমাণুর থেকে ছোট হয়। একটি নির্দিষ্ট ক্যাটায়নে (হাইড্রোজেনের) কোনও ইলেক্ট্রন থাকে না, এবং একারনে শুধু একটি একক প্রোটন থাকে - যা মূল হাইড্রোজেন পরমাণুর চেয়ে অনেক ছোট।
অ্যানায়ন ও ক্যাটায়ন
[সম্পাদনা]যেহেতু প্রোটনের বৈদ্যুতিক আধানের মান ইলেকট্রনের আধানের মানের সমান, সেকারনে কোনও আয়নের নিট বৈদ্যুতিক আধান আয়নের প্রোটন সংখ্যা থেকে ইলেকট্রন সংখ্যার বিয়োগফলের সমান।
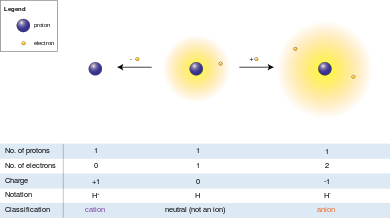
অ্যানায়ন (−) শব্দটি গ্রীক ἄνω শব্দ থেকে এসেছে যার অর্থ "উপর", এটি এমন আয়ন, যার মধ্যে প্রোটনের তুলনায় ইলেকট্রনের সংখ্যা বেশি এবং একারণে এটি ঋণাত্মক আধানযুক্ত (যেহেতু ইলেকট্রন ঋণাত্মক আধানযুক্ত এবং প্রোটন ধনাত্মক আধানযুক্ত) হয়।
ক্যাটায়ন (+) শব্দটি গ্রীক κάτω শব্দ থেকে এসেছে যার অর্থ "নিচে", এটি এমন আয়ন, যার মধ্যে ইলেকট্রনের তুলনায় প্রোটনের সংখ্যা বেশি এবং একারণে এটি ধনাত্মক আধানযুক্ত (যেহেতু ইলেকট্রন ঋণাত্মক আধানযুক্ত এবং প্রোটন ধনাত্মক আধানযুক্ত) হয়।
একাধিক আধানযুক্ত আয়নগুলির জন্য অপর নাম রয়েছে। উদাহরণস্বরূপ, -২ আধানযুক্ত অ্যানায়নকে ডাইঅ্যানায়ন এবং +২ আধানযুক্ত ক্যাটায়নকে ডাইক্যাটায়ন বলে। জুইটার আয়ন হলো এমন এক ধরনের নিরপেক্ষ যৌগ যাতে ধনাত্মক ও ঋণাত্মক উভয় আয়নই অণুর মধ্যে দুটি আলাদা স্থানে অবস্থান করে।[৯]
ক্যাটায়ন এবং অ্যানায়নগুলি তাদের আয়নিক ব্যাসার্ধ দ্বারা পরিমাপ করা হয়। ক্যাটায়নগুলি ছোট, তাদের বেশিরভাগের ব্যাসার্ধ 10−10 মিটার (10−8 সেমি) এর চেয়ে কম হয়। তবে বেশিরভাগ অ্যানায়ন আকারে বড়, যেমন পৃথিবীতে খুবই সাধারণ অ্যানায়ন, অক্সিজেন। সুতরাং এটি স্পষ্ট যে স্ফটিকের বেশিরভাগ স্থান অ্যানায়নসমূহ দখল করে এবং ক্যাটায়নগুলি অ্যানায়নের মধ্যবর্তী ফাঁকা জায়গাগুলিতে অবস্থান করে।[১০]
প্রকৃতিতে উপস্থিতি
[সম্পাদনা]প্রকৃতিতে সকল স্থানে আয়ন রয়েছে এবং সূর্যের আলোক বিকিরণ থেকে শুরু করে পৃথিবীর আয়নমণ্ডলের অস্তিত্ব পর্যন্ত বিচিত্র ঘটনার জন্য দায়ী। পরমাণুসমূহ তাদের আয়নিক অবস্থায় নিরপেক্ষ পরমাণু থেকে আলাদা রঙের হতে পারে এবং ধাতব আয়নগুলি দ্বারা আলো শোষণের কারনেই রত্নপাথর রঙিন হয়। অজৈব এবং জৈব রসায়ন উভয় ক্ষেত্রে (প্রাণরসায়ন সহ) পানি এবং আয়নগুলির মিথস্ক্রিয়া অত্যন্ত গুরুত্বপূর্ণ; উদাহরণ হলো অ্যাডেনোসিন ট্রাইফোসফেট (এটিপি) এর ভাঙ্গনের জন্য প্রয়োজনীয় শক্তি।
সম্পর্কিত প্রযুক্তি
[সম্পাদনা]সাধারণত উচ্চ বিভব বা তাপমাত্রায় বিভিন্ন আয়ন উৎস ব্যবহার করে অরাসায়নিকভাবে আয়ন প্রস্তুত করা যায়। এগুলি ভর স্পেকট্রোমিটার, আলোক নির্গমন স্পেকট্রোমিটার, কণা ত্বরক, আয়ন প্রতিস্থাপন এবং আয়ন ইঞ্জিনের মতো বিভিন্ন যন্ত্রে ব্যবহৃত হয়।
বিক্রিয়াশীল আধানযুক্ত কণা হিসাবে জীবাণু ব্যাহত করতে, বায়ু পরিশোধিত করতে এবং ধোঁয়া সনাক্তকারী যন্ত্রের মতো গৃহস্থালী জিনিসের মধ্যে এগুলি ব্যবহৃত হয়।
যেহেতু জীবদেহে সংকেত এবং বিপাকসমূহ ঝিল্লি জুড়ে একটি সুনির্দিষ্ট আয়নিক নতিমাত্রা দ্বারা নিয়ন্ত্রিত হয়, সেহেতু এই নতিমাত্রা ব্যাহত হওয়া কোষের মৃত্যুতে অবদান রাখে। এটি আয়ন চ্যানেল গ্রামিসিডিন এবং এমফোটেরিসিনসহ (একটি ছত্রাকনাশক) প্রাকৃতিক এবং কৃত্রিম বায়োসাইড দ্বারা শোষণ করা একটি সাধারণ প্রক্রিয়া।
অজৈব দ্রবীভূত আয়নগুলি দ্রবীভূত মোট কঠিন বস্তুর উপাদানগুলির একটি উপাদান, যা পানির মানের একটি বহুল পরিচিত সূচক।
আয়নীকরণ বিকিরণ সনাক্তকরণ
[সম্পাদনা]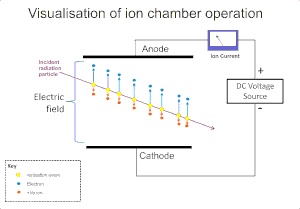
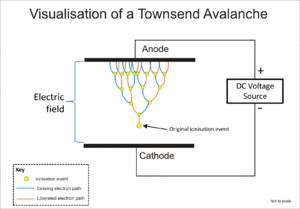
গ্যাসের উপর বিকিরণের আয়নীকরণ প্রভাব আলফা, বিটা, গামা এবং এক্স-রে বিকিরণ সনাক্তকরণের জন্য ব্যাপকভাবে ব্যবহৃত হয়। এই যন্ত্রগুলিতে আয়নীকরণে সময় গ্যাসের অণুগুলিতে বিকিরণের দ্বারা আয়ন প্রভাবের ফলে "আয়ন জোড়" গঠিত হয়; একটি ধনাত্মক আয়ন এবং একটি মুক্ত ইলেকট্রন। আয়নায়ন কক্ষ হলো এই সনাক্তকারকের মধ্যে সহজতম এবং এটি তড়িৎ ক্ষেত্র প্রয়োগের মাধ্যমে গ্যাসের মধ্যে সরাসরি আয়নীকরণের ফলে উৎপন্ন সমস্ত আধান সংগ্রহ করে।[১]
রসায়ন
[সম্পাদনা]আয়নিত অবস্থা চিহ্নিত করা
[সম্পাদনা]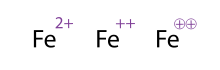
আয়নের রাসায়নিক সংকেত লেখার সময় তার নিট আধান অণু/পরমাণুর রাসায়নিক কাঠামোর পরপরই সুপারসক্রিপ্টে লেখা হয়। আধানের পূর্বে এর মান লেখা হয়; অর্থাৎ, দ্বিধনাত্মক ক্যাটায়নকে +2 এর পরিবর্তে 2+ দ্বারা প্রকাশ করা হয়। তবে একক আধানবিশিষ্ট অণু/পরমাণুর ক্ষেত্রে আধানের মান বাদ লেখা হয় না; উদাহরণস্বরূপ, সোডিয়াম ক্যাটায়নকে Na1+ এর পরিবর্তে Na+ লেখা হয়।
একাধিক আধানযুক্ত অণু/পরমাণু নির্দেশ করার একটি বিকল্প (এবং গ্রহণযোগ্য) উপায় হলো সংকেতগুলো একাধিকবার লেখা। অবস্থান্তর ধাতুর ক্ষেত্রে এটি প্রায়শই দেখা যায়। রসায়নবিদরা মাঝে মাঝে চিহ্নটির চারপাশে বৃত্ত অংকন করেন; এটি কেবল শোভা বৃদ্ধি করে এবং রাসায়নিক অর্থের কোনও পরিবর্তন করে না। ফেরাস আয়নকে প্রকাশের তিনটি উপায় হলো Fe2+
, Fe++, এবং Fe⊕⊕। এখানের তিনটি প্রতীকই একই অর্থ প্রকাশ করে।

একপরমাণুক আয়নগুলিকে কখনও কখনও রোমান সংখ্যার সাহায্যেও লেখা হয়, বিশেষত বর্ণালিবীক্ষণ যন্ত্রে; উদাহরণস্বরূপ, Fe2+
কে Fe(II) বা FeII হিসাবেও উল্লেখ করা হয়। রোমান সংখ্যাগুলি একটি উপাদানের জারণ অবস্থাকে নির্দেশ করে, যেখানে শীর্ষদেশে লিখিত ইন্দো-আরবি সংখ্যাগুলি নিট আধানকে বোঝায়। একপরমাণুক আয়নের ক্ষেত্রে উভয় পদ্ধতিই একইসাথে ব্যবহারযোগ্য, তবে বহুপরমাণুক আয়নগুলিতে রোমান সংখ্যা প্রয়োগ করা যায় না। তবে জটিল যৌগের ধাতব কেন্দ্রে রোমান সংখ্যা ব্যবহারের মাধ্যমে পদ্ধতি দুইটি মিশ্রিত করা সম্ভব, যেমনটা উদাহরণের ইউরেনাইল আয়নের ক্ষেত্রে দেখানো হয়েছে।
উপশ্রেনি
[সম্পাদনা]যদি কোন আয়নে অযুগ্ম ইলেকট্রন থাকে তবে তাকে রেডিকাল আয়ন বলে। আধানহীন রেডিকালের মতো, রেডিকাল আয়নগুলিও খুব বিক্রিয়াশীল। অক্সিজেনযুক্ত বহুপরমাণুক আয়ন যেমন কার্বনেট এবং সালফেটকে অক্সিঅ্যানায়ন বলে। যে আণবিক আয়নগুলিতে কমপক্ষে একটি কার্বন ও হাইড্রোজেন বন্ধন থাকে তাকে জৈব আয়ন বলে। যদি জৈব আয়নের আধান কোনও কার্বনকে কেন্দ্র করে থাকে তবে এটিকে একটি কার্বোক্যাটায়ন (যদি আধান ধনাত্মক হয়) বা কার্বোঅ্যানায়ন (যদি আধান ঋণাত্মক হয়) বলা হয়।
গঠন
[সম্পাদনা]একপারমাণবিক আয়নের গঠন
[সম্পাদনা]একটি পরমাণুর যোজ্যতা স্তরে (সবচেয়ে বাইরের কক্ষপথ) ইলেক্ট্রন গ্রহণ বা বর্জনের মাধ্যমে একপরমাণুক আয়নগুলি গঠিত হয়। পরমাণুর অভ্যন্তরীণ কক্ষপথগুলো ইলেকট্রন দিয়ে পূর্ণ থাকে যা ধনাত্মক আধানযুক্ত নিউক্লিয়াসের সাথে দৃঢ়ভাবে আবদ্ধ থাকে এবং তাই এই ধরনের রাসায়নিক বিক্রিয়ায় অংশ নেয় না। একটি নিরপেক্ষ পরমাণু বা অণু থেকে ইলেকট্রন গ্রহণ বা বর্জনের প্রক্রিয়াকে আয়নীকরণ বলা হয়।
বিকিরণ বর্ষণের মাধ্যমে পরমাণুসমূহ আয়নিত করা যেতে পারে, তবে রসায়নে আয়নীকরণের সাধারণ প্রক্রিয়া হলো পরমাণু বা অণুর মধ্যে ইলেকট্রন স্থানান্তর। এই স্থানান্তর সাধারণত স্থিতিশীল ("পূর্ণ কক্ষপথ") ইলেকট্রন কনফিগারেশন অর্জনের উদ্দেশ্যে চালিত হয়। কোন ক্রিয়ায় সর্বনিম্ন শক্তি প্রয়োজন তার উপর নির্ভর করে পরমাণুসমূহ ইলেকট্রন গ্রহণ বা বর্জন করবে।
উদাহরণস্বরূপ, সোডিয়াম পরমাণু, Na এর যোজ্যতা স্তরে একটি একক ইলেকট্রন রয়েছে, এবং এর অভ্যন্তরে ২টি এবং ৮টি ইলেকট্রনে পূর্ণ ২টি স্থিতিশীল কক্ষপথ রয়েছে। যেহেতু এই পূর্ণ কক্ষপথগুলো খুব স্থিতিশীল, তাই সোডিয়াম পরমাণুতে তার অতিরিক্ত ইলেকট্রনটি বর্জন করে এই স্থিতিশীল ইলেকট্রন বিন্যাস অর্জন করার প্রবণতা দেখা যায়। ইলেকট্রন ত্যাগ করে সোডিয়াম পরমাণু স্থিতিশীল হওয়ার সাথে সাথে সোডিয়াম ক্যাটায়নে পরিণত হয়,
- Na → Na+
+
e−
অন্যদিকে, ক্লোরিন পরমাণু, Cl, এর যোজ্যতা স্তরে ৭টি ইলেকট্রন রয়েছে, অর্থাৎ ৮টি ইলেকট্রনের পূর্ণ স্থিতিশীল কক্ষপথ থেকে ১টি ইলেকট্রনের ঘাটতি রয়েছে। সুতরাং, ক্লোরিন পরমাণুতে একটি ইলেকট্রন গ্রহণ করে এই স্থিতিশীল ইলেকট্রন বিন্যাস অর্জন করার প্রবণতা দেখা যায়। ইলেকট্রন গ্রহণ করে ক্লোরিন পরমাণু স্থিতিশীল হওয়ার সাথে সাথে ক্লোরাইড অ্যানায়নে পরিণত হয়,
- Cl +
e−
→ Cl−
এই প্রবণতার কারনেই সোডিয়াম এবং ক্লোরিনের রাসায়নিক বিক্রিয়া দেখা দেয়, যেখানে "অতিরিক্ত" ইলেকট্রনটি সোডিয়াম থেকে ক্লোরিনে স্থানান্তরিত হয়, ফলে সোডিয়াম ক্যাটায়ন এবং ক্লোরাইড অ্যানায়ন গঠিত হয়। বিপরীতভাবে আহিত হওয়ার কারণে, এই ক্যাটায়ন এবং অ্যানায়নগুলো আয়নিক বন্ধন গঠন করে এবং সোডিয়াম ক্লোরাইড বা NaCl গঠন করে, যা সাধারণত টেবিল লবণ হিসাবে বেশি পরিচিত।
বহুপারমাণবিক এবং আণবিক আয়নের গঠন
[সম্পাদনা]
3) তড়িৎ বিভব মানচিত্র। ত্রি-মাত্রিক স্তরটি একক সমবিভবের প্রতিনিধিত্ব করে।
বহুপারমাণবিক এবং আণবিক আয়নগুলি প্রায়শই নিরপেক্ষ অণুতে প্রোটন বা H+
এর মতো প্রাথমিক আয়ন গ্রহণ বা ত্যাগের মাধ্যমে গঠিত হয়। উদাহরণস্বরূপ, অ্যামোনিয়া বা NH
3 যখন একটি প্রোটন বা H+
গ্রহণ করে তখন প্রোটনেশন নামক একটি প্রক্রিয়ায় অ্যামোনিয়াম আয়ন NH+
4 গঠিত হয়। অ্যামোনিয়া এবং অ্যামোনিয়ামের মূলত একই ইলেকট্রন বিন্যাসে একই সংখ্যক ইলেকট্রন রয়েছে, তবে অ্যামোনিয়ামের একটি অতিরিক্ত প্রোটন রয়েছে যার ফলে এটিতে একটি ধনাত্মক আধান প্রকাশ পায়।
অ্যামোনিয়া একটি ইলেকট্রন ত্যাগের মাধ্যমে একটি ধনাত্মক আধান অর্জন করে NH+
3 আয়ন গঠন করতে পারে। তবে এই আয়নটি অস্থিতিশীল, কারণ এটিতে নাইট্রোজেন পরমাণুর চারপাশে একটি অসম্পূর্ণ যোজ্যতা স্তর রয়েছে, যা আয়নটিকে অত্যন্ত বিক্রিয়াশীল রেডিকাল আয়নে পরিণত করে।
রেডিকাল আয়নগুলির অস্থিতিশীলতার কারণে বহুপারমাণবিক এবং আণবিক আয়নগুলি সাধারণত ইলেকট্রন গ্রহণ বা বর্জনের পরিবর্তে H+
এর মতো প্রাথমিক আয়ন গ্রহণ বা বর্জনের মাধ্যমে তৈরি হয়। এই প্রক্রিয়ার ফলে অণুটি তার স্থিতিশীল ইলেকট্রন বিন্যাস বজায় রেখেই বৈদ্যুতিক আধান অর্জন করতে পারে।
আয়নীকরণ শক্তি
[সম্পাদনা]গ্যাসীয় অবস্থায় পরমাণু বা অণু থেকে সর্বনিম্ন শক্তি অবস্থায় ইলেকট্রনকে অপসারণ করে ধনাত্মক আয়নে পরিণত করতে যে পরিমাণ শক্তির প্রয়োজন হয়, তাকে আয়নীকরণ বিভব বা আয়নিকরণ শক্তি বলে। কোনও পরমাণুর n তম আয়নীকরণ শক্তি হলো প্রথম n-1 সংখ্যক ইলেকট্রন অপসারণের পর পরমাণুটির n তম ইলেকট্রনকে অপসারণের জন্য প্রয়োজনীয় শক্তি।
প্রতিটি ক্রমাগত আয়নীকরণ শক্তি পূর্বের আয়নীকরণ শক্তির চেয়ে স্পষ্টতই বেশি হয়। বিশেষত যখন কোনও পারমাণবিক কক্ষকের ইলেকট্রন নিঃশেষ হয়ে যায় তখন এই শক্তির বৃদ্ধি উল্লেখযোগ্য পরিমানের হয়। একারণে, আয়নগুলি এমনভাবে গঠিত হয় যাতে এগুলির কক্ষক পূর্ণ থাকে। উদাহরণস্বরূপ, সোডিয়ামের সর্ববহিস্থ শক্তিস্তরে একটি যোজনী ইলেকট্রন থাকে, সুতরাং আয়নিত আকারে Na+
হিসেবে এটিতে সাধারণত একটি ইলেকট্রনের ঘাটতি থাকে। পর্যায় সারণীর অপর প্রান্তে ক্লোরিনের ৭টি যোজনী ইলেকট্রন রয়েছে, সুতরাং আয়নিত আকারে Cl−
হিসেবে এটিতে সাধারণত একটি অধিক ইলেকট্রন থাকে। সকল মৌলিক পদার্থের মধ্যে সিজিয়ামের আয়নীকরণ শক্তি সর্বনিম্ন এবং হিলিয়ামের আয়নীকরণ শক্তি সর্বাধিক। সাধারণত ধাতুর আয়নীকরণ শক্তি অধাতুর আয়নীকরণ শক্তির তুলনায় অনেক কম থাকে, এবং একারণেই ধাতুসমূহ ধনাত্মক আধানযুক্ত আয়ন গঠনের সময় ইলেকট্রন ত্যাগ করে এবং অধাতুসমূহ ঋণাত্মক আধানযুক্ত আয়ন গঠনের সময় ইলেকট্রন গ্রহণ করে।
আয়নিক বন্ধন
[সম্পাদনা]আয়নিক বন্ধন এক ধরনের রাসায়নিক বন্ধন যা বিপরীত আধানযুক্ত আয়নসমূহের পারস্পরিক আকর্ষণের মাধ্যমে উদ্ভূত হয়। অনুরূপ আধানযুক্ত আয়নগুলি একে অপরকে বিকর্ষণ করে এবং বিপরীত আধানযুক্ত আয়নগুলি একে অপরকে আকর্ষণ করে। সুতরাং, আয়নগুলি সাধারণত মুক্তভাবে থাকে না, বরং বিপরীত আধানযুক্ত আয়নের সাথে আবদ্ধ হয়ে একটি স্ফটিক জালিকা তৈরি করে। ফলস্বরূপ যৌগটিকে আয়নিক যৌগ বলা হয় এবং এদের বন্ধনকে আয়নিক বন্ধন বলা হয়। আয়নিক যৌগগুলিতে আয়ন প্রতিবেশীদের মধ্যে বৈশিষ্ট্যগত দূরত্ব দেখা দেয় যা থেকে স্থানিক প্রসার এবং পৃথক আয়নগুলির আয়নিক ব্যাসার্ধ পাওয়া যায়।
আয়নিক বন্ধন সাধারনত ধাতু এবং অধাতুর যৌগে দেখা যায় (নিষ্ক্রিয় গ্যাস ব্যতীত, যা খুব কমই রাসায়নিক যৌগ গঠন করে)। ধাতুসমূহের সর্বশেষ শক্তিস্তরে স্থিতিশীল ইলেকট্রন বিন্যাসের তুলনায় অল্প সংখ্যক ইলেকট্রন বেশি থাকে। একারনে স্থিতিশীল ইলেকট্রন বিন্যাস অর্জন করতে তাদের এই অতিরিক্ত ইলেকট্রন ত্যাগের প্রবণতা দেখা যায়, যা তড়িৎ ধনাত্মকতা হিসাবে পরিচিত। অন্যদিকে অধাতুসমূহের স্থিতিশীল ইলেকট্রন বিন্যাসের তুলনায় অল্প সংখ্যক ইলেকট্রনের ঘাটতি থাকে। একারনে স্থিতিশীল ইলেকট্রন বিন্যাস অর্জন করতে তাদের এই ঘাটতি পুরনের জন্য ইলেকট্রন গ্রহণের প্রবণতা দেখা যায়, যা তড়িৎ ঋণাত্মকতা হিসাবে পরিচিত। যখন উচ্চ তড়িৎ ধনাত্মকতাসম্পন্ন একটি ধাতু একটি উচ্চ তড়িৎ ঋণাত্মকতাসম্পন্ন অধাতুর সাথে মিলিত হয়, তখন ধাতব পরমাণু থেকে অতিরিক্ত ইলেকট্রনগুলো অধাতব পরমাণুতে স্থানান্তরিত হয়। এই প্রতিক্রিয়াটির ফলে ধাতব ক্যাটায়ন এবং অধাতব অ্যানায়ন তৈরি হয়, যা একে অপরের সাথে যুক্ত হয়ে লবণ গঠন করে।
সাধারণ আয়ন
[সম্পাদনা]
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
আরও দেখুন
[সম্পাদনা]টীকা
[সম্পাদনা]- ↑ এই আয়নটি দেখতে মৌলের আয়ন মনে হলেও এখানে যেহেতু মার্কারির দুটো পরমাণু একত্রে সম্মিলিত যোজনী প্রদর্শন করে, তাই এটি যৌগমূলক।
তথ্যসূত্র
[সম্পাদনা]- ↑ ক খ গ Knoll, Glenn F (১৯৯৯)। Radiation detection and measurement (3rd সংস্করণ)। New York: Wiley। আইএসবিএন 978-0-471-07338-3।
- ↑ Michael Faraday (1791-1867)। UK: BBC।
- ↑ "Online etymology dictionary"। সংগ্রহের তারিখ ২০১১-০১-০৭।
- ↑ Frank A. J. L. James, সম্পাদক (১৯৯১)। The Correspondence of Michael Faraday, Vol. 2: 1832-1840। পৃষ্ঠা 183। আইএসবিএন 9780863412493।
- ↑ "The Nobel Prize in Chemistry 1903"। www.nobelprize.org।
- ↑ Harris, William; Levey, Judith, সম্পাদকগণ (১৯৭৬)। The New Columbia Encyclopedia (4th সংস্করণ)। New York City: Columbia University। পৃষ্ঠা 155। আইএসবিএন 978-0-231-03572-9।
- ↑ Goetz, Philip W. (১৯৯২)। McHenry, Charles, সম্পাদক। The New Encyclopædia Britannica। Chicago: Encyclopaedia Britannica Inc। 1 (15 সংস্করণ)। Chicago: Encyclopædia Britannica, Inc.। পৃষ্ঠা 587। আইএসবিএন 978-0-85229-553-3। বিবকোড:1991neb..book.....G।
- ↑ Cillispie, Charles, সম্পাদক (১৯৭০)। Dictionary of Scientific Biography (1 সংস্করণ)। New York City: Charles Scribner's Sons। পৃষ্ঠা 296–302। আইএসবিএন 978-0-684-10112-5।
- ↑ Purdue University (নভেম্বর ২১, ২০১৩)। "Amino Acids"। purdue.edu।
- ↑ Frank Press & Raymond Siever (1986) Earth, 14th edition, p. 63, W.H. Freeman and Company আইএসবিএন ০-৭১৬৭-১৭৪৩-৩
- ↑ ক খ "Common Ions and Their Charges" (পিডিএফ)। Science Geek।

