রাসায়নিক বন্ধন
একটি রাসায়নিক বন্ধন পরমাণু, আয়ন বা অণুর মধ্যে একটি স্থায়ী আকর্ষণ যা রাসায়নিক যৌগ গঠন করে। বন্ধনটি আয়নিক বন্ধনের মতো বিপরীতচার্জযুক্ত আয়নের মধ্যে আকর্ষণের তড়িৎস্ট্যাটিক শক্তির ফলে হতে পারে, আবার সমযোজী বন্ধনের মতো ইলেকট্রন ভাগ করে নেওয়ার মাধ্যমেও হতে পারে। রাসায়নিক বন্ধনের শক্তি যথেষ্ট পরিবর্তিত হয়; "শক্তিশালী বন্ধন" বা "প্রাথমিক বন্ধন" যেমন সমযোজী, আয়নিক এবং ধাতব বন্ধন, এবং "দুর্বল বন্ধন" বা "গৌণ বন্ধন" যেমন ডাইপোল-ডাইপোল মিথস্ক্রিয়া, লন্ডন বিচ্ছুরণ শক্তি এবং হাইড্রোজেন বন্ধন ।

যেহেতু বিপরীত চার্জ একটি সাধারণ তড়িৎচুম্বকীয় শক্তির মাধ্যমে আকৃষ্ট হয়, ঋনাত্বক চার্জযুক্ত ইলেকট্রনগুলি, যা নিউক্লিয়াসকে প্রদক্ষিণ করছে এবং নিউক্লিয়াসের ধনাত্বক চার্জযুক্ত প্রোটনগুলি একে অপরকে আকর্ষণ করে। দুটি নিউক্লিয়াসের মধ্যে অবস্থিত একটি ইলেকট্রন তাদের উভয়ের প্রতি আকৃষ্ট হবে, এবং নিউক্লিয়াস এই অবস্থানে ইলেকট্রনের দিকে আকৃষ্ট হবে। এই আকর্ষণ রাসায়নিক বন্ধন গঠন করে।
সাধারণভাবে, শক্তিশালী রাসায়নিক বন্ধন অংশগ্রহণকারী পরমাণুর মধ্যে ইলেকট্রন ভাগ বা স্থানান্তরের সাথে যুক্ত। অণু, স্ফটিক, ধাতু এবং পারমাণবিক গ্যাসের পরমাণুগুলি - প্রকৃতপক্ষে আমাদের চারপাশের বেশিরভাগ ভৌত পরিবেশ - রাসায়নিক বন্ধন দ্বারা একত্রিত হয়, যা পদার্থের কাঠামো এবং প্রচুর বৈশিষ্ট্য নির্দেশ করে।
সমস্ত বন্ধন কোয়ান্টাম তত্ত্ব দ্বারা ব্যাখ্যা করা যেতে পারে, কিন্তু, বাস্তবে, সরলীকরণ নিয়ম রসায়নবিদদের বন্ধনের শক্তি, দিকনির্দেশকতা এবং মেরুতার ভবিষ্যদ্বাণী করার সুযোগ দেয়। অক্টেট নিয়ম এবং VSPR তত্ত্ব দুটি উদাহরণ। আরও অত্যাধুনিক তত্ত্ব হল ভ্যালেন্স বন্ধন তত্ত্ব, যার মধ্যে রয়েছে কক্ষীয় সংকরকরণ এবং অনুরণন, এবং আণবিক কক্ষীয় তত্ত্ব যা পারমাণবিক কক্ষীয় এবং লিগ্যান্ড ক্ষেত্র তত্ত্বের রৈখিক সংমিশ্রণ অন্তর্ভুক্ত করে। তড়িৎস্ট্যাটিকস বন্ধন মেরুতা এবং রাসায়নিক পদার্থের উপর তাদের প্রভাব বর্ণনা করতে ব্যবহৃত হয়।
রাসায়নিক বন্ধনসমূহের সংক্ষিপ্ত পর্যালোচনা
[সম্পাদনা]"রাসায়নিক বন্ধন হলোঃ পরমাণুসমূহ ইলেকট্রন শেয়ারিং বা ইলেকট্রন আদান-প্রদানের মাধ্যমে যে বন্ধন গঠন করে, তাকে রাসায়নিক বন্ধন বলা হয়"। এই আকর্ষণ পরমাণুর সর্ববহিস্থ ইলেকট্রনের বিভিন্ন আচরণের ফলাফল হিসাবে দেখা যেতে পারে। এই আচরণগুলি বিভিন্ন পরিস্থিতিতে একে অপরের মধ্যে নির্বিঘ্নে মিশে যায়, যাতে তাদের মধ্যে কোনও স্পষ্ট রেখা আঁকা না যায়। যাইহোক এটি বিভিন্ন ধরনের বন্ধনের মধ্যে পার্থক্য করা দরকারী, যার ফলে ঘনীভূত পদার্থের বিভিন্ন বৈশিষ্ট্য দেখা দেয়।
একটি সমযোজী বন্ধনের সহজতম দৃশ্যে, এক বা একাধিক ইলেকট্রন (প্রায়শই এক জোড়া ইলেকট্রন) দুটি পারমাণবিক নিউক্লিয়াসের মধ্যবর্তী স্থানে আঁকা হয়। শক্তি বন্ধন গঠন দ্বারা নির্গত হয়। এটি সম্ভাব্য শক্তি হ্রাসের ফলে নয়, কারণ দুটি প্রোটনের প্রতি দুটি ইলেকট্রনের আকর্ষণ ইলেকট্রন-ইলেকট্রন এবং প্রোটন-প্রোটন বিকর্ষণ দ্বারা অফসেট করা হয়। পরিবর্তে, শক্তির নিঃস্বরণ গতিশক্তি হ্রাস থেকে উদ্ভূত হয় কারণ ইলেকট্রনগুলির প্রতিটি ইলেকট্রন তার নিজ নিজ নিউক্লিয়াসের কাছাকাছি সীমাবদ্ধ থাকার তুলনায় আরও স্থানিকভাবে বিতরণ করা (অর্থাৎ দীর্ঘতর ডি ব্রোগ্লি তরঙ্গদৈর্ঘ্য) কক্ষপথে থাকে। [১]এই বন্ধন দুটি বিশেষ শনাক্তযোগ্য পরমাণুর মধ্যে বিদ্যমান, যা তাদের অঙ্কনে পরমাণুর মধ্যে একক সংযোগকারী রেখা হিসাবে দেখানোর অনুমতি দেয়।
একটি মেরু সমযোজী বন্ধনে, এক বা একাধিক ইলেকট্রন দুটি নিউক্লিয়াসের মধ্যে অসমভাবে ভাগ করা থাকে। সমযোজী বন্ধনের ফলে প্রায়শই অণু নামে আরও ভাল-সংযুক্ত পরমাণুর ছোট সংগ্রহ তৈরি হয়, যা কঠিন এবং তরলগুলিতে অন্যান্য অণুতে এমন শক্তিদ্বারা আবদ্ধ থাকে যা প্রায়শই সমযোজী বন্ধনের চেয়ে অনেক দুর্বল যা অণুগুলিকে অভ্যন্তরীণভাবে একসাথে ধরে রাখে। এই ধরনের দুর্বল আন্তঃআণবিক বন্ধন জৈব আণবিক পদার্থ দেয় (যেমন মোম এবং তেল)। সমযোজী বন্ধন বড় অণুতে পরমাণুর দীর্ঘ শৃঙ্খল সংযুক্ত করে (যেমন নাইলনের মতো পলিমারগুলিতে), তবে যখন সমযোজী বন্ধনগুলি বিচ্ছিন্ন অণু (যেমন হীরা বা কোয়ার্টজ বা অনেক ধরনের শিলায় সিলিকেট খনিজ) দ্বারা গঠিত নয় এমন কঠিন গুলির মাধ্যমে নেটওয়ার্কগুলিতে প্রসারিত হয় তখন কাঠামোগুলি শক্তিশালী এবং শক্ত উভয়ই হতে পারে, অন্তত সমযোজী বন্ধনের নেটওয়ার্কগুলির সাথে সঠিকভাবে অভিমুখী দিক দিয়ে। এছাড়াও, এই ধরনের সমযোজী পলিমার এবং নেটওয়ার্কের গলনাঙ্ক গুলি ব্যাপকভাবে বৃদ্ধি পায়।
আয়নিক বন্ধনের সরলীকৃত দৃষ্টিভঙ্গিতে, বন্ধন ইলেকট্রন মোটেই ভাগ হয় না, বরং স্থানান্তরিত হয়। এই ধরনের বন্ধনের মধ্যে, একটি পরমাণুর বাইরের পারমাণবিক কক্ষপথে একটি শূন্যতা রয়েছে যা এক বা একাধিক ইলেকট্রন যুক্ত করার অনুমতি দেয়। এই নতুন যুক্ত ইলেকট্রনগুলি সম্ভাব্যভাবে একটি ভিন্ন পরমাণুতে কম শক্তি (কার্যকরভাবে আরও পারমাণবিক চার্জের কাছাকাছি) দখল করে। সুতরাং, একটি নিউক্লিয়াস অন্য নিউক্লিয়াসের চেয়ে একটি ইলেকট্রনে আরও শক্তভাবে আবদ্ধ অবস্থান করে, যার ফলে একটি পরমাণু অন্যটিতে একটি ইলেকট্রন স্থানান্তর করতে পারে। এই স্থানান্তরের ফলে একটি পরমাণু একটি নেট ধনাত্বক চার্জ গ্রহণ করে, এবং অন্যটি একটি নেট ঋনাত্বক চার্জ গ্রহণ করে। বন্ধনটি তখন ধনাত্বক এবং ঋনাত্বকচার্জড আয়নের মধ্যে তড়িৎস্ট্যাটিক আকর্ষণ থেকে ফলাফল দেয়। আয়নিক বন্ধনকে সমযোজী বন্ধনে মেরুকরণের চরম উদাহরণ হিসাবে দেখা যেতে পারে। আয়নিক বন্ধন শক্তিশালী (এবং এইভাবে আয়নিক পদার্থ গলে উচ্চ তাপমাত্রা প্রয়োজন) কিন্তু ভঙ্গুর, যেহেতু আয়ন মধ্যে শক্তি স্বল্প পরিসর এবং সহজে ফাটল ধরে। এই ধরনের বন্ধন ক্লাসিক খনিজ লবণের স্ফটিকগুলির জন্ম দেয়, যেমন টেবিল লবণ।
সাধারণত কম উল্লিখিত বন্ধন হ'ল ''ধাতব'' বন্ধন। এই ধরনের বন্ধনের মধ্যে, একটি ধাতুর প্রতিটি পরমাণু অনেক ধাতব পরমাণুর মধ্যে বসবাসকারী ইলেকট্রনের "সমুদ্রে" এক বা একাধিক ইলেকট্রন দান করে। এই সমুদ্রে, প্রতিটি ইলেকট্রন মুক্ত (তার তরঙ্গ প্রকৃতির কারণে) একসাথে একটি মহান অনেক পরমাণুর সাথে যুক্ত হতে। বন্ধনের ফলাফল কারণ ধাতব পরমাণুগুলি তাদের ইলেকট্রনগুলির ক্ষতির কারণে কিছুটা ধনাত্বকভাবে চার্জ হয়ে যায় যখন ইলেকট্রনগুলি কোনও প্রদত্ত পরমাণুর অংশ না হয়েও অনেক পরমাণুর প্রতি আকৃষ্ট থাকে। ধাতব বন্ধনকে কোভ্যালেন্ট বন্ধনের একটি বড় সিস্টেমের উপর ইলেকট্রনের ডিলোকালাইজেশনের একটি চরম উদাহরণ হিসাবে দেখা যেতে পারে, যেখানে প্রতিটি পরমাণু অংশ নেয়। এই ধরনের বন্ধন প্রায়শই খুব শক্তিশালী হয় (ধাতুর শক্তির ফলে)। যাইহোক, ধাতব বন্ধন অন্যান্য ধরনের তুলনায় প্রকৃতিতে বেশি সম্মিলিত, এবং তাই তারা ধাতব স্ফটিকগুলিকে আরও সহজে বিকৃত হতে দেয়, কারণ তারা একে অপরের প্রতি আকৃষ্ট পরমাণু দিয়ে গঠিত, তবে কোনও বিশেষ-কেন্দ্রিক উপায়ে নয়। এর ফলে ধাতুর ম্যালেবিলিটি বেশি থাকে। ধাতব বন্ধনের ইলেকট্রনের মেঘ ধাতুর চরিত্রগতভাবে ভাল বৈদ্যুতিক এবং তাপীয় পরিবাহিতা সৃষ্টি করে, এবং তাদের চকচকে ঔজ্জ্বল্য যা সাদা আলোর বেশিরভাগ ফ্রিকোয়েন্সি প্রতিফলিত করে।
ইতিহাস
[সম্পাদনা]মূল নিবন্ধঃরাসায়নিক তত্ত্বের ইতিহাস,রসায়নের ইতিহাস দ্বাদশ শতাব্দীর প্রথম দিক থেকে রাসায়নিক বন্ধনের প্রকৃতি সম্পর্কে প্রাথমিক অনুমানে ধারণা করা হয়েছিল যে নির্দিষ্ট ধরনের রাসায়নিক প্রজাতিগুলি এক ধরনের রাসায়নিক আসক্তির সাথে যুক্ত হয়। ১৭০৪ সালে স্যার আইজ্যাক নিউটন তার বিখ্যাত পারমাণবিক বন্ধন তত্ত্বের রূপরেখা তৈরি করেন, তার অপটিক্সের কোয়েরি ৩ এ, যার মাধ্যমে পরমাণুগুলি কিছু শক্তি দ্বারা একে অপরের সাথে সংযুক্ত হয়। বিশেষকরে, সেই সময় প্রচলিত বিভিন্ন জনপ্রিয় তত্ত্ব স্বীকার করার পরে, নিউটন বলেন যে তিনি বরং তাদের সংহতি থেকে অনুমান করেন, যে কণাগুলি কিছু শক্তি দ্বারা একে অপরকে আকর্ষণ করে, যা তাৎক্ষণিক যোগাযোগে অত্যন্ত শক্তিশালী, ছোট দূরত্বে রাসায়নিক অপারেশনগুলি সম্পাদন করে। এবং কোন বিচক্ষণ প্রভাব সঙ্গে কণা থেকে দূরে পৌঁছায়।
১৮১৯ সালে, ভোল্টাইক স্তূপ আবিষ্কারের গোড়ালিতে, জন জ্যাকব বারজেলিয়াস রাসায়নিক সংমিশ্রণের একটি তত্ত্ব তৈরি করেছিলেন যা সংমিশ্রণকারী পরমাণুগুলির তড়িৎঋণাত্বক এবং তড়িৎপজিটিভ চরিত্রগুলির উপর জোর দেয়। ঊনবিংশ শতাব্দীর মাঝামাঝি সময়ে এডওয়ার্ড ফ্র্যাঙ্কল্যান্ড, এফ এ কেকুলে, এ এস কুপার, আলেকজান্ডার বাটলারভ এবং হারমান কোলবে মৌলবাদীতত্ত্বের উপর নির্মিত, ভ্যালেনসির তত্ত্ব তৈরি করেন, যাকে মূলত "সংমিশ্রণ শক্তি" বলা হয়, যেখানে ধনাত্বক এবং ঋনাত্বক মেরুর আকর্ষণের কারণে যৌগগুলি যুক্ত হয়েছিল। ১৯০৪ সালে, রিচার্ড এবেগ তার নিয়ম প্রস্তাব করেন যে একটি উপাদানের সর্বাধিক এবং ন্যূনতম ভ্যালেনিসের মধ্যে পার্থক্য প্রায়শই আট।সেই মুহুর্তে, ভ্যালেনসি শুধুমাত্র রাসায়নিক বৈশিষ্ট্যের উপর ভিত্তি করে একটি অভিজ্ঞতামূলক সংখ্যা ছিল।
যাইহোক, আর্নেস্ট রাদারফোর্ডের ১৯১১ সালের আবিষ্কারের সাথে পরমাণুর প্রকৃতি আরও স্পষ্ট হয়ে ওঠে যে ইলেকট্রন দ্বারা বেষ্টিত একটি পারমাণবিক নিউক্লিয়াস। এবং নিলস বোরের ১৯১৩ সালের ইলেকট্রন কক্ষপথের মডেল ইলেকট্রনগুলির রাসায়নিক আচরণ নির্ধারণ করে। ১৯১৬ সালে রসায়নবিদ গিলবার্ট এন লুইস ইলেকট্রন-জোড়া বন্ধনের ধারণা টি তৈরি করেন, যেখানে দুটি পরমাণু এক থেকে ছয়টি ইলেকট্রন ভাগ করে নিতে পারে, এইভাবে একক ইলেকট্রন বন্ধন, একটি একক বন্ধন, একটি দ্বৈত বন্ধন বা ট্রিপল বন্ধন গঠন করে; লুইসের নিজের ভাষায়, একটি ইলেকট্রন দুটি ভিন্ন পরমাণুর খোলসের একটি অংশ গঠন করতে পারে এবং একচেটিয়াভাবে একটির অন্তর্ভুক্ত বলা যায় না। [২]
এছাড়াও ১৯১৬ সালে, ওয়ালথার কোসেল লুইসের অনুরূপ একটি তত্ত্ব সামনে রেখেছিলেন, তার মডেল পরমাণুর মধ্যে ইলেকট্রনের সম্পূর্ণ স্থানান্তরকে ধরে নিয়েছিল, এবং এতে আয়নিক বন্ধনের একটি মডেল ছিল। লুইস এবং কোসেল উভয়ই রিচার্ড এবেগ এর তত্ত্বের (১৯০৪) উপর তাদের বন্ধন মডেল গঠন করেছিলেন।
নিলস বোর ১৯১৩ সালে রাসায়নিক বন্ধনের একটি মডেলও প্রস্তাব করেছিলেন। একটি পারমাণবিক অণুর জন্য তার মডেল অনুযায়ী, অণুর পরমাণুর ইলেকট্রনগুলি একটি ঘূর্ণায়মান রিং গঠন করে যার সমতল অণুর অক্ষের লম্ব এবং পারমাণবিক নিউক্লিয়াস থেকে সমদূরত্বে। আণবিক ব্যবস্থার গতিশীল ভারসাম্য নিউক্লিয়াসের আকর্ষণ শক্তি থেকে ইলেকট্রনের রিং এর সমতল এবং নিউক্লিয়াসের পারস্পরিক বিকর্ষণশক্তির মধ্যে শক্তির ভারসাম্যের মাধ্যমে অর্জন করা হয়। রাসায়নিক বন্ধনের বোর মডেল কুলম্ব বিকর্ষণবিবেচনা করেছিল যে - রিং এর ইলেকট্রনগুলি একে অপরের থেকে সর্বাধিক দূরত্বে রয়েছে। [৩][৪][৫]
১৯২৭ সালে, একটি সাধারণ রাসায়নিক বন্ধনের প্রথম গাণিতিকভাবে সম্পূর্ণ কোয়ান্টাম বিবরণ, অর্থাৎ হাইড্রোজেন আণবিক আয়ন, H2+ এ একটি ইলেকট্রন দ্বারা উৎপাদিত, ডেনমার্কের পদার্থবিজ্ঞানী Øyvind Burrau দ্বারা উদ্ভূত হয়েছিল।[৬]এই কাজ টি দেখায় যে রাসায়নিক বন্ধনের কোয়ান্টাম পদ্ধতি মৌলিক এবং পরিমাণগতভাবে সঠিক হতে পারে, কিন্তু ব্যবহৃত গাণিতিক পদ্ধতিগুলি একাধিক ইলেকট্রন যুক্ত অণুতে প্রসারিত হয়না। ওয়াল্টার হিটলার এবং ফ্রিটজ লন্ডন একই বছরে আরও ব্যবহারিক, যদিও কম পরিমাণগত পদ্ধতি সামনে এনেছিলেন। হাইটলার-লন্ডন তত্ত্ব টি যাকে ভ্যালেন্স বন্ধন তত্ত্ব বলা হয় তার ভিত্তি গঠন করে। ১৯২৯ সালে, পারমাণবিক কক্ষীয় আণবিক কক্ষীয় পদ্ধতির (LCAO) আনুমানিক রৈখিক সংমিশ্রণ স্যার জন লেনার্ড-জোন্স দ্বারা প্রবর্তিত হয়েছিল, যিনি মৌলিক কোয়ান্টাম নীতি থেকে F2 ফ্লোরিন এবং O2 অক্সিজেন অণুর ইলেক্ট্রন কাঠামো অর্জনের পদ্ধতির পরামর্শ দিয়েছিলেন। Schrödinger(স্রোডিঞ্জার) এর এই আণবিক কক্ষীয় তত্ত্ব পারমাণবিক কক্ষীয় একক যাকে পরমাণুতে ইলেকট্রনের জন্য হাইপোথিসিস করা হয়েছিল। মাল্টি-ইলেকট্রন পরমাণুতে ইলেকট্রনের বন্ধনের সমীকরণগুলি গাণিতিক পরিপূর্ণতায় সমাধান করা যায়নি (বিশ্লেষণাত্মকভাবে), তবে তাদের জন্য আনুমানিক এখনও অনেক ভাল গুণগত ভবিষ্যদ্বাণী এবং ফলাফল দিয়েছে। আধুনিক কোয়ান্টাম রসায়নে বেশিরভাগ পরিমাণগত গণনা হয় ভ্যালেন্স বন্ধন বা আণবিক কক্ষীয় তত্ত্বকে একটি প্রারম্ভিক বিন্দু হিসাবে ব্যবহার করে, যদিও একটি তৃতীয় পদ্ধতি, ঘনত্ব কার্যকরী তত্ত্ব সাম্প্রতিক বছরগুলিতে ক্রমবর্ধমানভাবে জনপ্রিয় হয়ে উঠেছে।
১৯৩৩ সালে, H H জেমস এবং এ এস কুলিজ ডাইহাইড্রোজেন অণুর উপর একটি গণনা চালিয়েছিলেন যা পূর্ববর্তী সমস্ত গণনার বিপরীতে যা কেবল পারমাণবিক নিউক্লিয়াস থেকে ইলেকট্রনের দূরত্বের ফাংশন ব্যবহার করত, ফাংশন ব্যবহার করেছিল যা স্পষ্টভাবে দুটি ইলেকট্রনের মধ্যে দূরত্ব যোগ করেছিল।[৭]১৩ টি পর্যন্ত সামঞ্জস্যযোগ্য প্যারামিটার দিয়ে তারা ডিসসোসিয়েশন শক্তির জন্য পরীক্ষামূলক ফলাফলের খুব কাছাকাছি একটি ফলাফল অর্জন করে।
রাসায়নিক সংকেতে রাসায়নিক বন্ধন উপস্থাপন
[সম্পাদনা]যেহেতু পরমাণু এবং অণু ত্রিমাত্রিক, কক্ষীয় এবং বন্ধন নির্দেশ করার জন্য একটি পদ্ধতি ব্যবহার করা কঠিন। আণবিক সূত্রগুলিতে পরমাণুর মধ্যে রাসায়নিক বন্ধন (বাইন্ডিং অরবিটাল) আলোচনার ধরনের উপর নির্ভর করে বিভিন্ন উপায়ে নির্দেশিত হয়। কখনও কখনও, কিছু বিবরণ অবহেলিত হয়। উদাহরণস্বরূপ, জৈব রসায়নে কখনও কখনও কেবল অণুর কার্যকরী গোষ্ঠীর সাথে সম্পর্কিত হয়। সুতরাং, ইথানলের আণবিক সূত্রটি কনফর্মেশনাল আকারে, ত্রিমাত্রিক আকারে, পূর্ণ দ্বিমাত্রিক আকারে (কোনও ত্রিমাত্রিক দিক নির্দেশ না করে প্রতিটি বন্ধন নির্দেশ করে), সংকুচিত দ্বিমাত্রিক ফর্ম (CH3–CH2–OH), অণুর অন্য অংশ (C2H5OH)থেকে কার্যকরী গোষ্ঠীকে পৃথক করে, অথবা এর পারমাণবিক উপাদানগুলি (C2H6O)দ্বারা, যা আলোচনা করা হয়েছে তা অনুসারে। কখনও কখনও, এমনকি অ-বন্ধন ভ্যালেন্স শেল ইলেকট্রনগুলি (দ্বিমাত্রিক আনুমানিক দিক সহ) চিহ্নিত করা হয়, যেমন মৌলিক কার্বনের জন্য।' সি'। কিছু রসায়নবিদ সংশ্লিষ্ট কক্ষপথগুলিও চিহ্নিত করতে পারেন, যেমন কাল্পনিক ইথেন−৪ অ্যানিওন (\/C=C/\ −4)যা বন্ধন গঠনের সম্ভাবনা নির্দেশ করে।
শক্তিশালী রাসায়নিক বন্ধনসমূহ
[সম্পাদনা]| pm এ সাধারন বন্ধন দৈর্ঘ্য এবং kJ/mol এ বন্ধন শক্তি . Bond lengths can be converted to Å by division by 100 (1 Å = 100 pm). Data taken from University of Waterloo.[৮] | ||
| Bond | Length (pm) |
Energy (kJ/mol) |
|---|---|---|
| H — Hydrogen | ||
| H–H | 74 | 436 |
| H–O | 96 | 366 |
| H–F | 92 | 568 |
| H–Cl | 127 | 432 |
| C — Carbon | ||
| C–H | 109 | 413 |
| C–C | 154 | 348 |
| C–C= | 151 | |
| =C–C≡ | 147 | |
| =C–C= | 148 | |
| C=C | 134 | 614 |
| C≡C | 120 | 839 |
| C–N | 147 | 308 |
| C–O | 143 | 360 |
| C–F | 134 | 488 |
| C–Cl | 177 | 330 |
| N — Nitrogen | ||
| N–H | 101 | 391 |
| N–N | 145 | 170 |
| N≡N | 110 | 945 |
| O — Oxygen | ||
| O–O | 148 | 145 |
| O=O | 121 | 498 |
| F, Cl, Br, I — Halogens | ||
| F–F | 142 | 158 |
| Cl–Cl | 199 | 243 |
| Br–H | 141 | 366 |
| Br–Br | 228 | 193 |
| I–H | 161 | 298 |
| I–I | 267 | 151 |

শক্তিশালী রাসায়নিক বন্ধন হল আন্তঃআণবিক শক্তি যা অণুতে পরমাণুগুলিকে একসাথে ধরে রাখে। পারমাণবিক কেন্দ্রের মধ্যে ইলেকট্রনের স্থানান্তর বা ভাগাভাগি থেকে একটি শক্তিশালী রাসায়নিক বন্ধন গঠিত হয় এবং নিউক্লিয়াসের প্রোটন এবং কক্ষপথের ইলেকট্রনের মধ্যেকার তড়িৎস্ট্যাটিক আকর্ষণের উপর নির্ভর করে।
উপাদানে উপাদানে তড়িৎঋনাত্বকতার পার্থক্যের কারণে শক্তিশালী বন্ধনের ধরণগুলি পৃথক হয়। তড়িৎঋনাত্বকতার একটি বড় পার্থক্য বন্ধনের মধ্যে মেরু (আয়নিক) চরিত্রের দিকে পরিচালিত করে।
তড়িৎযোজী বন্ধন
[সম্পাদনা]আয়নিক বন্ধন হল পরমাণুগুলির মধ্যে এক ধরনের তড়িৎস্ট্যাটিক মিথস্ক্রিয়া যার একটি বড় তড়িৎঋনাত্বকতার পার্থক্য রয়েছে। এমন কোনও সুনির্দিষ্ট মূল্য নেই যা আয়নিককে সমযোজী বন্ধন থেকে পৃথক করে, তবে ১.৭ এর বেশি একটি তড়িৎঋনাত্বকতার পার্থক্য আয়নিক হওয়ার সম্ভাবনা রয়েছে যখন ১.৭ এর কম পার্থক্য সমযোজী হওয়ার সম্ভাবনা হয়। [৯]আয়নিক বন্ধনের ফলে ধনাত্বক ও ঋনাত্বক আয়ন পৃথক হয়। আয়নিক চার্জগুলি সাধারণত -3e থেকে +3e এর মধ্যে হয়। আয়নিক বন্ধন সাধারণত সোডিয়াম ক্লোরাইডের (টেবিল লবণ) মতো ধাতব লবণে হয়। আয়নিক বন্ধনের একটি সাধারণ বৈশিষ্ট্য হ'ল প্রজাতিগুলি আয়নিক স্ফটিক গুলিতে গঠিত হয়, যেখানে কোনও আয়ন নির্দিষ্টভাবে একটি নির্দিষ্ট দিকনির্দেশক বন্ধনের অন্য কোনও আয়নের সাথে জোড় হয় না। বরং, আয়নের প্রতিটি প্রজাতি বিপরীত চার্জের আয়ন দ্বারা পরিবেষ্টিত, এবং এর মধ্যে ব্যবধান এবং এর কাছাকাছি প্রতিটি বিপরীত চার্জযুক্ত আয়ন একই ধরনের আশেপাশের সমস্ত পরমাণুর জন্য একই হয়। এইভাবে এর কাছাকাছি অন্য কোনও নির্দিষ্ট একক আয়নিত পরমাণুর সাথে আয়নকে যুক্ত করা আর সম্ভব নয়।
আয়নিক স্ফটিকগুলিতে সমযোজী এবং আয়নিক প্রজাতির মিশ্রণ থাকতে পারে, উদাহরণস্বরূপ সোডিয়াম সায়ানাইড, NaCN-এর মতো জটিল অ্যাসিডের লবণ। এক্স-রে ডিফ্রেCation দেখায় যে সোডিয়াম cations (Na+) এবং সায়ানাইড cations (Na+ এর মধ্যে বন্ধন আয়নিক, কোনও নির্দিষ্ট সায়ানাইডের সাথে কোনও সোডিয়াম আয়ন যুক্ত নয়। যাইহোক, সায়ানাইডে সি এবং এন পরমাণুর মধ্যে বন্ধন গুলি সমযোজী ধরনের, যাতে প্রতিটি কার্বন দৃঢ়ভাবে কেবল একটি নাইট্রোজেনের সাথে আবদ্ধ থাকে, যার সাথে এটি শারীরিকভাবে সোডিয়াম সায়ানাইড স্ফটিকের অন্যান্য কার্বন বা নাইট্রোজেনের চেয়ে অনেক কাছাকাছি।
যখন এই ধরনের স্ফটিক তরলে গলে যায়, আয়নিক বন্ধনগুলি প্রথমে ভেঙে যায় কারণ তারা অ-দিকনির্দেশক এবং চার্জড প্রজাতিগুলিকে অবাধে চলাফেরা করতে দেয়। একইভাবে, যখন এই ধরনের লবণ জলে দ্রবীভূত হয়, আয়নিক বন্ধন সাধারণত জলের সাথে মিথস্ক্রিয়া দ্বারা ভেঙে যায় তবে সমযোজী বন্ধনগুলি ধরে রাখে। উদাহরণস্বরূপ, সায়ানাইড আয়নগুলি একক CN− আয়ন হিসাবে একসাথে আবদ্ধ, সমাধানের মাধ্যমে স্বাধীনভাবে চলাচল করে, যেমন সোডিয়াম আয়নগুলি চলে Na+ হিসাবে। জলে, চার্জড আয়নগুলি আলাদা হয়ে যায় কারণ তাদের প্রত্যেকটি একে অপরের চেয়ে বেশ কয়েকটি জলের অণুর প্রতি বেশি আকৃষ্ট হয়। এই ধরনের সমাধানে আয়ন এবং জলের অণুগুলির মধ্যে আকর্ষণ এক ধরনের দুর্বল ডাইপোল-ডাইপোল ধরনের রাসায়নিক বন্ধন । গলিত আয়নিক যৌগগুলিতে, আয়নগুলি একে অপরের প্রতি আকৃষ্ট হতে থাকে, তবে কোনও স্ফটিকজাত উপায়ে নয়।
সমযোজী বন্ধন
[সম্পাদনা]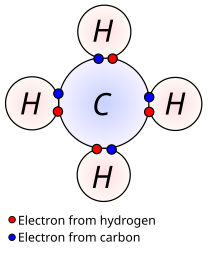
সমযোজী বন্ধন একটি সাধারণ ধরনের বন্ধন যেখানে দুই বা ততোধিক পরমাণু কমবেশি সমানভাবে সর্বঃবহিস্থ ইলেকট্রন ভাগ করে নেয়। সবচেয়ে সহজ এবং সর্বাধিক সাধারণ ধরনটি একটি একক বন্ধন যেখানে দুটি পরমাণু দুটি ইলেকট্রন ভাগ করে নেয়। অন্যান্য ধরনের মধ্যে রয়েছে দ্বি বন্ধন, ট্রিপল বন্ধন, এক এবং তিন-ইলেকট্রন বন্ধন, তিন-কেন্দ্র দুই-ইলেকট্রন বন্ধন এবং তিন-কেন্দ্র চার-ইলেকট্রন বন্ধন।
অ-মেরু সমযোজী বন্ধনগুলিতে, বন্ধনযুক্ত পরমাণুগুলির মধ্যে তড়িৎঋনাত্বকতার পার্থক্য ছোট, সাধারণত ০ থেকে ০.৩। বেশিরভাগ জৈব যৌগের মধ্যে বন্ধনগুলি সমযোজী হিসাবে বর্ণিত হয়। চিত্রটি মিথেন (CH4) দেখায়, যেখানে প্রতিটি হাইড্রোজেন কার্বনের সাথে একটি সমযোজী বন্ধন গঠন করে। এই ধরনের বন্ধনের এলসিএও বিবরণের জন্য সিগমা বন্ধন এবং পাই বন্ধন দেখুন।
অণু যা প্রাথমিকভাবে অ-মেরু সমযোজী বন্ধন থেকে গঠিত হয় প্রায়শই জল বা অন্যান্য মেরু দ্রাবকগুলিতে অস্পষ্ট হয়, তবে হেক্সেনের মতো অ-মেরু দ্রাবকগুলিতে অনেক বেশি দ্রবণীয়।
একটি মেরু সমযোজী বন্ধন একটি উল্লেখযোগ্য আয়নিক চরিত্রের সাথে একটি সমযোজী বন্ধন। এর অর্থ হ'ল দুটি ভাগ করা ইলেকট্রন অন্যটির চেয়ে একটি পরমাণুর কাছাকাছি হয়ে চার্জের ভারসাম্যহীনতা তৈরি করে। এই ধরনের বন্ধন মাঝারি ভিন্ন তড়িৎঋণাত্বকিনিটি সহ দুটি পরমাণুর মধ্যে ঘটে এবং ডাইপোল-ডাইপোল মিথস্ক্রিয়ার জন্ম দেয়। এই বন্ধনের দুটি পরমাণুর মধ্যে তড়িৎঋনাত্বকতার পার্থক্য ০.৩ থেকে ১.৭।
একক ও বহু-বন্ধন
[সম্পাদনা]দুটি পরমাণুর মধ্যে একটি একক বন্ধন, এক জোড়া ইলেকট্রনের ভাগাভাগির সাথে সামঞ্জস্যপূর্ণ। হাইড্রোজেন (H) পরমাণুর একটি ভ্যালেন্স ইলেকট্রন রয়েছে। দুটি হাইড্রোজেন পরমাণু তখন একটি অণু গঠন করতে পারে, যা ভাগাভাগি করা ইলেকট্রনের জোড়া দ্বারা একসাথে ধরে রাখা যায়। প্রতিটি (H) পরমাণু তখন নিষ্ক্রিয় গ্যাস হিলিয়ামের (He) বিন্যাস ধারণ করে । ভাগাভাগি করা ইলেকট্রনের জোড়া একটি একক সমযোজী বন্ধন গঠন করে। দুটি পরমাণুর মধ্যবর্তী অঞ্চলে এই দুটি বন্ধন ইলেকট্রনের ইলেকট্রন ঘনত্ব দুটি অ-মিথস্ক্রিয়াকারী H পরমাণুর ঘনত্ব থেকে বৃদ্ধি পায়।
একটি দ্বি বন্ধনে দুটি ভাগ করা ইলেকট্রন রয়েছে, একটি সিগমা বন্ধনে এবং একটি পাই বন্ধনে ইলেকট্রন ঘনত্বের সাথে আন্তঃপারমাণবিক অক্ষের দুটি বিপরীত দিকে ঘনীভূত। একটি ট্রিপল বন্ধন তিন ভাগ ইলেকট্রন জোড়া নিয়ে গঠিত, একটি সিগমা এবং দুটি পাই বন্ধন গঠন করে। একটি উদাহরণ হল নাইট্রোজেন। চতুর্গুণ এবং উচ্চতর বন্ধন খুব বিরল এবং কেবল নির্দিষ্ট রূপান্তর ধাতব পরমাণুর মধ্যে ঘটে।
সন্নিবেশ সমযোজী বন্ধন
[সম্পাদনা]পরমাণুর মধ্যে সমযোজী বন্ধন সৃষ্টির জন্য একটি পরমাণু অপর পরমাণুর সাথে সমভাবে ইলেকট্রন শেয়ারের মাধ্যমে যে বন্ধনের সৃষ্টি করে তাকে সন্নিবেশ বন্ধন বলে। একটি সমন্বয় সমযোজী বন্ধন এমন একটি সমযোজী বন্ধন যেখানে দুটি ভাগ বন্ধন একই পরমাণু থেকে আসে। উদাহরণস্বরূপ, বোরন ট্রাইফ্লুরাইড (BF3) এবং অ্যামোনিয়া (NH3) একটি B–N বন্ধন সহ একটি অ্যাডডাক্ট বা সমন্বয় কমপ্লেক্স F3B←NH3 গঠন করে যেখানে N-A একক একজোড়া ইলেকট্রন B BF3-এ একটি খালি পারমাণবিক কক্ষপথের সাথে ভাগ করা হয়, একটি খালি কক্ষীয় সহ একটি ইলেকট্রন জোড়া গ্রহণকারী বা লুইস অ্যাসিড হিসাবে বর্ণনা করা হয়,যখন NH3 একটি একক জোড়া যা ভাগ করা যেতে পারে, তাকে ইলেকট্রন-জোড়া দাতা বা লুইস বেস হিসাবে বর্ণনা করা হয়। ইলেকট্রনগুলি আয়নিক বন্ধনের বিপরীতে পরমাণুগুলির মধ্যে মোটামুটি সমানভাবে ভাগ করা হয়।
ট্রানজিশন মেটাল কমপ্লেক্সগুলি সাধারণত সন্নিবেশ সমযোজী বন্ধন দ্বারা আবদ্ধ। উদাহরণস্বরূপ, আয়ন NH3 এর দুটি অণু সহ লুইস অ্যাসিড হিসাবে প্রতিক্রিয়া করে জটিল আয়ন Ag(NH3)2+ গঠন করে, যার দুটি Ag←N সমন্বয় সমযোজী বন্ধন রয়েছে।
ধাতব বন্ধন
[সম্পাদনা]ধাতব বন্ধনের ক্ষেত্রে, বন্ধন ইলেকট্রনগুলি পরমাণুর ল্যাটিশের উপর স্থানীয়করণ করা হয়। এর বিপরীতে, আয়নিক যৌগগুলিতে, বাইন্ডিং ইলেকট্রনের অবস্থান এবং তাদের চার্জ স্থিতিশীল। বন্ধন ইলেকট্রনের অবাধ চলাচল বা ডিলোকালাইজেশন ধ্রুপদী ধাতব বৈশিষ্ট্য যেমন উজ্জ্বলতা (পৃষ্ঠের আলো প্রতিফলিততা), বৈদ্যুতিক এবং তাপীয় পরিবাহিতা এবং উচ্চ প্রসার্য শক্তির দিকে পরিচালিত করে।
আন্তঃআণবিক বন্ধন
[সম্পাদনা]দুই বা ততোধিক অণু, আয়ন বা পরমাণুর মধ্যে চার মৌলিক ধরনের বন্ধন তৈরি করতে পারে। আন্তঃআণবিক শক্তি অণুগুলি একে অপরের দ্বারা আকৃষ্ট বা বিকর্ষিত হয়। প্রায়শই, এগুলি কোনও পদার্থের কিছু শারীরিক বৈশিষ্ট্য (যেমন গলনাঙ্ক) সংজ্ঞায়িত করে।
দুটি বন্ধনযুক্ত পরমাণুর মধ্যে তড়িৎঋনাত্বকতাতে একটি বড় পার্থক্য একটি অণু বা আয়নে স্থায়ী চার্জ পৃথকীকরণ বা ডাইপোলের কারণ । একটি অণু বা আয়নের বন্ধন ইলেকট্রনগুলি, কম তড়িৎঋণাত্বক পরমাণুর চেয়ে বেশি ঘন ঘন আরও তড়িৎঋণাত্বক পরমাণুর কাছাকাছি হয়, প্রতিটি পরমাণুর উপর আংশিক চার্জের জন্ম দেয় এবং অণু বা আয়নের মধ্যে স্থিরতড়িৎ শক্তি সৃষ্টি করবে।
- একটি হাইড্রোজেন বন্ধন কার্যকরভাবে দুটি স্থায়ী ডাইপোলের মধ্যে মিথস্ক্রিয়ার একটি শক্তিশালী উদাহরণ। হাইড্রোজেন এবং ফ্লোরিন, নাইট্রোজেন এবং অক্সিজেন মধ্যে তড়িৎঋণাত্বকতার বড় পার্থক্য হল তাদের একক জোড়া ইলেকট্রনের সাথে মিলিত, অণুগুলির মধ্যে শক্তিশালী স্থিরতড়িৎ শক্তি সৃষ্টি করে। হাইড্রোজেন বন্ধন গুলি তাদের ভারী অ্যানালগগুলির পানি এবং অ্যামোনিয়ার উচ্চ ফুটন্ত পয়েন্টগুলির জন্য দায়ী।
- পার্শ্ববর্তী পরমাণুতে তাৎক্ষণিক ডাইপোলের কারণে লন্ডন বিচ্ছুরণ শক্তি উত্থাপিত হয়। যেহেতু ইলেকট্রনের ঋনাত্বক চার্জ পুরো পরমাণুর চারপাশে অভিন্ন নয়, তাই সর্বদা চার্জ ভারসাম্যহীনতা থাকে। ছোট চার্জটি নিকটবর্তী অণুতে একটি সংশ্লিষ্ট ডাইপোলকে প্ররোচিত করে, যা উভয়ের মধ্যে আকর্ষণ সৃষ্টি করে। ইলেকট্রন তখন ইলেকট্রন মেঘের অন্য অংশে চলে যায় এবং আকর্ষণ টি ভেঙে যায়।
- একটি পাই মিথস্ক্রিয়া একটি পাই বন্ধন এবং একটি Cation এর মধ্যে ঘটে
রাসায়নিক বন্ধনের তত্ত্ব
[সম্পাদনা]"বিশুদ্ধ" আয়নিক বন্ধনের সীমায়, ইলেকট্রনগুলিকে বন্ধনের দুটি পরমাণুর মধ্যে একটিতে পুরোপুরি স্থানীয়করণ করা হয়। এই ধরনের বন্ধন ক্লাসিক্যাল পদার্থবিজ্ঞান দ্বারা বোঝা যেতে পারে। পরমাণুর মধ্যবর্তী শক্তিগুলি আইসোট্রপিক কন্টিনিউয়াম তড়িৎস্ট্যাটিক সম্ভাবনা দ্বারা চিহ্নিত করা হয়।
ভ্যালেন্স বন্ধন (ভিবি) তত্ত্ব বা আণবিক কক্ষীয় (এমও) তত্ত্ব দ্বারা সমযোজী বন্ধনগুলি আরও ভালভাবে বোঝা যায়। জড়িত পরমাণুগুলির বৈশিষ্ট্য জারণ সংখ্যা, আনুষ্ঠানিক চার্জ এবং তড়িৎঋণাত্বকতার মতো ধারণাগুলি ব্যবহার করে বোঝা যেতে পারে। একটি বন্ধনের মধ্যে ইলেকট্রন ঘনত্ব পৃথক পরমাণুতে বরাদ্দ করা হয় না, বরং পরমাণুর মধ্যে ডিলোকালাইজড করা হয়। ভ্যালেন্স বন্ধন তত্ত্বে, বন্ধন ইলেকট্রন জোড়া থেকে নির্মিত হিসাবে ধারণা করা হয় যা পারমাণবিক কক্ষপথের ওভারল্যাপের মাধ্যমে দুটি পরমাণু দ্বারা স্থানীয় এবং ভাগ করা হয়। কক্ষীয় সংকরকরণ এবং অনুরণনের ধারণাগুলি ইলেকট্রন জোড়া বন্ধনের এই মৌলিক ধারণাকে বাড়িয়ে তোলে। আণবিক কক্ষীয় তত্ত্বে, বন্ধনকে স্থানীয়করণ করা হয় এবং কক্ষীয় অঞ্চলে বিভক্ত করা হয় যা অণু জুড়ে প্রসারিত হয় এবং সাধারণত পারমাণবিক কক্ষপথের (এলসিএও) রৈখিক সংমিশ্রণ বিবেচনা করে এর প্রতিসাম্য বৈশিষ্ট্যগুলির সাথে অভিযোজিত হয়। ইলেকট্রন কাঠামো তত্ত্বের পদ্ধতি হিসাবে, এমও এবং ভিবি উভয় পদ্ধতিই অন্তত নীতিগতভাবে নির্ভুলতার যে কোনও কাঙ্ক্ষিত স্তরে আনুমান দিতে পারে।
বিশুদ্ধ আয়নিক বন্ধনে স্ফেরিকলি প্রতিসম কুলম্বিক শক্তির বিপরীতে, সমযোজী বন্ধনগুলি সাধারণত নির্দেশিত এবং অ্যানিসোট্রপিক। এগুলি প্রায়শই সিগমা বন্ধন এবং পাই বন্ধন হিসাবে আণবিক সমতলের ক্ষেত্রে তাদের প্রতিসাম্যের উপর ভিত্তি করে শ্রেণীবদ্ধ করা হয়। সাধারণ ক্ষেত্রে, পরমাণুগুলি আয়নিক এবং সমযোজীের মধ্যে মধ্যবর্তী বন্ধন গঠন করে, জড়িত পরমাণুগুলির আপেক্ষিক তড়িৎঋনাত্বকতার উপর নির্ভর করে। এই ধরনের বন্ধনগুলি মেরু সমযোজী বন্ধন হিসাবে পরিচিত।
আরও দেখুন
[সম্পাদনা]তথ্যসূত্র
[সম্পাদনা]- ↑ Rioux, Frank (2001-10)। "The Covalent Bond in H2"। The Chemical Educator। 6 (5): 288–290। আইএসএসএন 1430-4171। ডিওআই:10.1007/s00897010509a। এখানে তারিখের মান পরীক্ষা করুন:
|তারিখ=(সাহায্য) - ↑ "Linus Pauling and The Nature of the Chemical Bond: A Documentary History - Special Collections & Archives Research Center - Oregon State University"। scarc.library.oregonstate.edu। সংগ্রহের তারিখ ২০২১-০৪-২০।
- ↑ Евстегнеева, Анна Александровна (২০২০-০৭-০৩)। "Выплата работодателем задержанной заработной платы в порядке статьи 142 Трудового кодекса Российской Федерации"। Научные труды Московского гуманитарного университета (3): 33। আইএসএসএন 2587-8441। ডিওআই:10.17805/trudy.2020.3.6।
- ↑ (U.S.), National Academy of Sciences। Proceedings of the National Academy of Sciences of the United States of America.। National Academy of Sciences। ওসিএলসি 321029026।
- ↑ Svidzinsky, Anatoly A.; Scully, Marlan O.; Herschbach, Dudley R. (২০০৫-০৮-২৩)। "Bohr's 1913 molecular model revisited"। Proceedings of the National Academy of Sciences of the United States of America। 102 (34): 11985–11988। আইএসএসএন 0027-8424। ডিওআই:10.1073/pnas.0505778102। পিএমআইডি 16103360। পিএমসি 1186029
 ।
।
- ↑ Laidler, Keith James (১৯৯৫)। The world of physical chemistry। Internet Archive। Oxford ; New York : Oxford University Press। আইএসবিএন 978-0-19-855597-1।
- ↑ "The Journal of Chemical Physics"। Wikipedia (ইংরেজি ভাষায়)। ২০২০-০৭-২৮।
- ↑ "Bond Lengths and Energies"। Science.uwaterloo.ca। ২০০৭-১২-১৪ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২০১৩-১০-১৫।
- ↑ 1945-, Becker, David, (২০০০)। Study guide for Jones and Atkins's Chemistry : molecules, matter, and change। W.H. Freeman। ওসিএলসি 1029284768।
বহিঃসংযোগ
[সম্পাদনা]- W. Locke (1997). Introduction to Molecular Orbital Theory. Retrieved May 18, 2005.
- Carl R. Nave (2005). HyperPhysics. Retrieved May 18, 2005.
- Linus Pauling and the Nature of the Chemical Bond: A Documentary History ওয়েব্যাক মেশিনে আর্কাইভকৃত ১৪ ফেব্রুয়ারি ২০০৮ তারিখে. Retrieved February 29, 2008.
