তড়িৎকোষ
 বিভিন্ন তড়িৎকোষ ও ব্যাটারি (উপরের বাম কোণা থেকে নিচের ডান কোণা):দুটি ডাবল-এ ব্যাটারি, একটি ডি ব্যাটারি, একটি হাতে ধরা রেডিও ব্যাটারি, দুটি ৯ ভোল্টের ব্যাটারি (পিপি৩),দুটি ট্রিপল-এ ব্যাটারি, একটি সি ব্যাটারি, একটি ক্যামেরায় ব্যবহৃত ব্যাটারি, একটি টেলিফোনে ব্যবহৃত ব্যাটারি | |
| ধরন | শক্তি উৎস |
|---|---|
| কার্যনীতি | তড়িৎ-রাসায়নিক বিক্রিয়া,তড়িচ্চালক বল |
| প্রথম প্রস্তুতকরণের তারিখ | ১৮০০ শতক |
| ইলেকট্রনিক প্রতীক | |
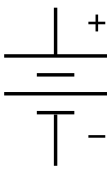 একটি বর্তনীতে একটি ব্যাটারির প্রতীক। ভোল্টার স্তুপ থেকে এই প্রতীকটি এসেছে। | |
তড়িৎকোষ হল বহিঃস্থ সংযোগ সমন্বিত এক বা একাধিক তড়িৎ-রাসায়নিক কোষ দিয়ে গঠিত একটি বিশেষ যন্ত্র;[১] যা ফ্ল্যাশলাইট, মোবাইল ফোন এবং বৈদ্যুতিক গাড়ির মতো বৈদ্যুতিক যন্ত্রকে সচল রাখতে প্রয়োজনীয় বৈদ্যুতিক শক্তি সরবরাহ করার জন্য ব্যবহৃত হয়। একে ইংরেজি পরিভাষায় সাধারণভাবে ব্যাটারি (Battery) বলে। যখন কোনও তড়িৎকোষ বৈদ্যুতিক শক্তি সরবরাহ করে, তখন এর ধনাত্মক প্রান্তটিকে ধনাত্মক তড়িৎদ্বার বা ক্যাথোড এবং এর ঋণাত্মক প্রান্তটিকে ঋণাত্মক তড়িৎদ্বার বা অ্যানোড বলে।[২] ঋণাত্মক চিহ্নিত প্রান্তটি হল ইলেকট্রনের উৎস যেখান থেকে ইলেকট্রনগুলি বহিঃস্থ একটি বৈদ্যুতিক বর্তনী দিয়ে ধনাত্মক প্রান্তে প্রবাহিত হয়। যখন কোনও তড়িৎকোষ কোনও বাহ্যিক বৈদ্যুতিক ভার বা লোডের সাথে সংযুক্ত থাকে, তখন এর ভেতরে একটি জারণ-বিজারণ বিক্রিয়া উচ্চ-শক্তির বিক্রিয়ককে কম-শক্তিসম্পন্ন উৎপাদে রূপান্তর করে আর মুক্ত-শক্তির পার্থক্যটি বৈদ্যুতিক শক্তি হিসাবে বহিঃস্থ বর্তনীতে সরবরাহ করা হয়। [৩] ঐতিহাসিকভাবে ইংরেজিতে "ব্যাটারি" শব্দটি দিয়ে নির্দিষ্টভাবে একাধিক তড়িৎ-রাসায়নিক কোষ দ্বারা গঠিত একটি যন্ত্রকে বোঝানো হয়, তবে প্রয়োগের বিবর্তনের কারণে "ব্যাটারি" শব্দটি দিয়ে একটি মাত্র তড়িৎ-রাসায়নিক কোষ দ্বারা গঠিত যন্ত্রকেও নির্দেশ করা হয়।[৪]
প্রাথমিক (একবার ব্যবহারযোগ্য বা "পরিত্যাজ্য") তড়িৎকোষগুলি একবার ব্যবহার করে ফেলে দেওয়া হয়, কারণ এগুলির তড়িৎদ্বারের পদার্থগুলি ক্ষরণের সময় অপ্রতিবর্তনযোগ্যভাবে পরিবর্তিত হয়; এর একটি সাধারণ উদাহরণ হল ফ্ল্যাশলাইটে ব্যবহৃত ক্ষারধর্মী তড়িৎকোষ এবং বহনযোগ্য বৈদ্যুতিক যন্ত্রসমূহ। গৌণ (পুনর্ভরণযোগ্য) তড়িৎকোষগুলি বৈদ্যুতিক প্রবাহ ব্যবহার করে একাধিকবার ক্ষরণ এবং পুনর্ভরণ করা যায়; তড়িৎদ্বারগুলির প্রকৃত গঠন বিপরীত তড়িৎপ্রবাহের মাধ্যমে ফিরিয়ে আনা যায়। এর উদাহরণ হল যানবাহনে ব্যবহৃত লেড-অ্যাসিড তড়িৎকোষ এবং ল্যাপটপ ও মোবাইল ফোনের মতো বহনযোগ্য ইলেকট্রনীয় যন্ত্রপাতিতে ব্যবহৃত লিথিয়াম-আয়ন তড়িৎকোষ।
তড়িৎকোষ অনেক আকার ও আকৃতির হতে পারে। শ্রবণ সহায়ক যন্ত্র বা হাতঘড়ির জন্য ব্যবহৃত অতি ক্ষুদ্র তড়িৎকোষ থেকে শুরু করে স্মার্টফোনের জন্য ছোট ও পাতলা লিথিয়াম-আয়ন তড়িৎকোষ ও যানবাহনে ব্যবহৃত বৃহত সীসা অ্যাসিড তড়িৎকোষ বা লিথিয়াম-আয়ন তড়িৎকোষ থেকে একেবারে চূড়ান্ত পর্যায়ের, ঘরের সমান বিশাল তড়িৎকোষ ভাণ্ডার (ব্যাটারি ব্যাঙ্ক) রয়েছে, যা টেলিফোন এক্সচেঞ্জ এবং কম্পিউটার উপাত্ত কেন্দ্রগুলিকে সচল রাখতে বা জরুরী বিদ্যুৎ সরবরাহ করতে ব্যবহার করা হয়।
সাধারণ জ্বালানি যেমন পেট্রোলের তুলনায় ব্যাটারিতে বিশিষ্ট শক্তি (একক ভর প্রতি শক্তি) অনেক কম থাকে। তবে মোটরযানগুলিতে অন্তর্দহন ইঞ্জিনের তুলনায় বৈদ্যুতিক মোটরগুলি বৈদ্যুতিক শক্তিকে যান্ত্রিক কাজে রূপান্তরিত করতে উচ্চতর কর্মদক্ষতা প্রদর্শন করে বলে এই ঘাটতি কিছুটা পূরণ হয়।
ইতিহাস
[সম্পাদনা]বেঞ্জামিন ফ্র্যাঙ্কলিন "ব্যাটারি" শব্দটিকে একদল বৈদ্যুতিক যন্ত্রকে বোঝানোর ব্যবহার করেন। তিনি ১৭৪৮ সালে একাধিক লাইডেন জারকে সারিবন্দী কামান সাথে সাদৃশ্যের মাধ্যমে বর্ণনা করেন। (বেঞ্জামিন ফ্র্যাঙ্কলিন "ব্যাটারি" পরিভাষাটি সামরিক বাহিনী থেকে নিয়েছিলেন, যেখানে এটি দিয়ে অনেকগুলি অস্ত্রের একসাথে কাজ করাকে নির্দেশ করা হয়।[৫]।
ইতালীয় পদার্থবিজ্ঞানী আলেসান্দ্রো ভোল্টা ১৮০০ সালে প্রথম তড়িৎরাসায়নিক কোষ বা ভোল্টার স্তুপ তৈরি ও বর্ণনা করেন। এটি ছিল তামা এবং দস্তার পাতের একটি স্তূপ, যা লবণ-জলের (ব্রাইন) দ্রবণে ভেজানো কাগজের চাকতি দ্বারা পৃথক করা থাকত এবং এটি যথেষ্ট সময়ের জন্য স্থির তড়িৎপ্রবাহ তৈরি করতে পারত। ভোল্টা বুঝতে পারেননি যে ভোল্টেজটি রাসায়নিক বিক্রিয়ায় কারণে হয়েছিল। তিনি ভেবেছিলেন যে তার কোষগুলি অফুরন্ত শক্তির উৎস,[৬] এবং তড়িৎদ্বারগুলিতে ক্ষয়ের প্রভাব নিছক একটি উপদ্রব; অবশ্যই সেগুলির কার্যক্রমের একটি অনিবার্য পরিণতি, যেমনটি মাইকেল ফ্যারাডে ১৮৩৪ সালে দেখিয়েছিলেন।[৭]
যদিও প্রারম্ভিক সময়ের ব্যাটারিগুলি পরীক্ষামূলক কাজের জন্য অত্যন্ত মূল্যবান ছিল, কিন্তু বাস্তবে তাদের ভোল্টেজ ওঠানামা করত এবং তারা অব্যাহত সময়ের জন্য বেশি তড়িৎপ্রবাহ সরবরাহ করতে পারত না। ১৮৩৬ সালে ব্রিটিশ রসায়নবিদ জন ফ্রেডেরিক ড্যানিয়েলের উদ্ভাবিত ড্যানিয়েল কোষটি শিল্পমানের হয়ে ওঠে এবং বৈদ্যুতিক টেলিগ্রাফ নেটওয়ার্কগুলির শক্তির উৎস হিসাবে ব্যাপকভাবে গ্রহণযোগ্যতা দেখা যাওয়ায় সেটি ছিল বিদ্যুতের প্রথম ব্যবহারিক উৎস।[৮] একটি কপার সালফেট দ্রবণে পরিপূর্ণ তামার পাত্র (যাতে সালফিউরিক অ্যাসিডে পূর্ণ একটি চিনামাটির পাত্রকে নিমজ্জিত করা হত) এবং একটি দস্তার তড়িৎদ্বার নিয়ে এটি গঠিত হত। [৯]
এই আর্দ্র কোষগুলিতে তরল তড়িৎবিশ্লেষ্য পদার্থ ব্যবহার করা হত, যা সঠিকভাবে পরিচালনা না করলে সেগুলি ফুটো হয়ে ও ঝরার পড়ে যাওয়ার প্রবণতা ছিল। অনেকে তাদের উপাদানগুলি ধরে রাখতে কাঁচের পাত্র ব্যবহার করতেন, যা এগুলিকে ভঙ্গুর এবং ভীষণ বিপজ্জনক করে তুলেছিল। এই বৈশিষ্ট্যগুলি আর্দ্র কোষগুলিকে বহনযোগ্য যন্ত্রপাতিতে ব্যবহারের অনুপযোগী করে তোলে। উনিশ শতকের শেষের দিকে শুষ্ক কোষের ব্যাটারিগুলির আবিষ্কার হয়; যাতে তরল তড়িৎবিশ্লেষ্য পদার্থকে কাই এর মাধ্যমে প্রতিস্থাপন করা হয় এবং এর ফলে বহনযোগ্য বৈদ্যুতিক যন্ত্রগুলি ব্যবহারযোগ্য হয়ে ওঠে।[১০]
কাজের মূলনীতি
[সম্পাদনা]
ব্যাটারি রাসায়নিক শক্তিকে সরাসরি বৈদ্যুতিক শক্তিতে রূপান্তর করে। অনেক ক্ষেত্রে মুক্ত হওয়া বৈদ্যুতিক শক্তি হল তড়িৎরাসায়নিক বিক্রিয়াধীন ধাতু, অক্সাইড বা অণুগুলির সংযোজন[১১] বা বন্ধন শক্তির পার্থক্য।[৩] উদাহরণস্বরূপ, দস্তা বা লিথিয়ামে শক্তি সঞ্চয় করা যেতে পারে, এগুলি উচ্চ-শক্তির ধাতু কারণ এগুলি অবস্থান্তর ধাতুগুলির মতো d-ইলেকট্রন বন্ধন দ্বারা স্থিতিশীল হয় না। ব্যাটারিগুলি এমনভাবে ডিজাইন করা হয় যেন, ইলেকট্রনগুলি কেবলমাত্র বৈদ্যুতিক সার্কিটের বাইরের অংশের মধ্য দিয়ে গেলেই শক্তিশালীভাবে অনুকূল রেডক্স বিক্রিয়া ঘটতে পারে।
একটি ব্যাটারি কিছু সংখ্যক ভোল্টায়িক কোষ নিয়ে গঠিত হয়। ধাতবক্যাটায়ন সংবলিত প্রতিটি কোষ একটি তড়িৎবিশ্লেষ্য পরিবাহীর মাধ্যমে সিরিজে যুক্ত দুটি অর্ধ কোষ নিয়ে গঠিত হয়। একটি অর্ধ কোষের মধ্যে থাকে তড়িৎবিশ্লেষ্য পদার্থ এবং ঋণাত্মক তড়িৎদ্বার, যে তড়িৎদ্বারে অ্যানায়নগুলি (ঋণাত্মকভাবে আহিত আয়ন) স্থানান্তরিত হয়; অন্য অর্ধকোষের মধ্যে থাকে তড়িৎবিশ্লেষ্য পদার্থ এবং ধনাত্মক তড়িৎদ্বার, যে তড়িৎদ্বারে ক্যাটায়নগুলি (ধনাত্মকভাবে আহিত আয়ন ) স্থানান্তরিত হয়। ক্যাথোডে ক্যাটায়নগুলি হ্রাস পায় (ইলেকট্রন যুক্ত হয়), তবে ধাতব পরমাণুগুলি অ্যানোডে জারিত হয় (ইলেকট্রন স্থানান্তরিত হয়)। [১২] কিছু কোষে প্রতিটি অর্ধকোষের জন্য আলাদা তড়িৎবিশ্লেষ্য পদার্থ ব্যবহার করা হয়; তারপরে তড়িৎবিশ্লেষ্য পদার্থগুলির মিশ্রণ রোধ করতে একটি বিভাজক ব্যবহৃত হয় তবে বৈদ্যুতিক সার্কিট সম্পূর্ণ করার জন্য আয়নগুলিকে অর্ধকোষগুলির মধ্যে প্রবাহিত হতে দেয় ।
প্রতিটি অর্ধকোষের একটি মানদণ্ড সাথে আপেক্ষিক একটি তড়িচ্চালক বল ( emf, ভোল্ট এককে পরিমাপ করা হয়) থাকে। কোষের নিট তড়িচ্চালক বল হল তার অর্ধ-কোষগুলির তড়িচ্চালক বলের মধ্যকার পার্থক্য। [১৩] এইভাবে, যদি তড়িৎদ্বারগুলিতে তড়িচ্চালক বল এবং থাকে, তাহলে নেট তড়িচ্চালক বল হয় ; অন্য কথায়, নেট তড়িচ্চালক বল হল অর্ধ বিক্রিয়াগুলির বিজারণ বিভবের মধ্যকার পার্থক্য। [১৪]
একটি কোষের প্রান্তগুলি জুড়ে বৈদ্যুতিক চালিকা শক্তি বা টার্মিনাল ভোল্টেজ (পার্থক্য) হিসাবে পরিচিত এবং এটিকে ভোল্ট এককে পরিমাপ করা হয়। [১৫] চার্জও হচ্ছে না বা ক্ষরণও হচ্ছে না এমন কোষের টার্মিনাল ভোল্টেজকে ওপেন-সার্কিট ভোল্টেজ বলে এবং এটি কোষের তড়িচ্চালক বলের সমান হয়। অভ্যন্তরীণ রোধের কারণে,[১৬] যে কোষটি ক্ষরণ হচ্ছে তার টার্মিনাল ভোল্টেজ ওপেন-সার্কিট ভোল্টেজের তুলনায় মাত্রায় কম হয় এবং চার্জ হচ্ছে এমন কোনও কোষের টার্মিনাল ভোল্টেজ, ওপেন-সার্কিট ভোল্টেজকে ছাড়িয়ে যায়। [১৭] একটি আদর্শ কোষে স্বল্পতম অভ্যন্তরীণ রোধ থাকে, সুতরাং এটি নিঃশেষ হওয়া অবধি একটি ধ্রুবক টার্মিনাল ভোল্টেজ বজায় রাখতে পারে, তারপরে শূন্যে নেমে যায়। যেমন একটি কোষ যদি ১.৫ ভোল্ট বজায় রাখে এবং এক কুলম্ব চার্জ উৎপন্ন করে, তাহলে এটি সম্পূর্ণ ক্ষরণ হলে ১.৫ জুল কাজ সম্পন্ন করবে। প্রকৃত কোষগুলিতে, অভ্যন্তরীণ রোধ ক্ষরণ অবস্থায় বৃদ্ধি পায় এবং ওপেন-সার্কিট ভোল্টেজও ক্ষরণ অবস্থায় হ্রাস পায়। যদি গ্রাফে সময়ের বিপরীতে ভোল্টেজ এবং রোধ আঁকা হয় তবে সাধারণত তাতে একটি বক্ররেখা পাওয়া যায়; প্রয়োগকৃত রসায়ন এবং অভ্যন্তরীণ বিন্যাস অনুসারে বক্রের আকার পরিবর্তিত হয়।
কোনও কোষের টার্মিনালগুলিতে বিকশিত ভোল্টেজ তার তড়িৎদ্বারের শক্তি মুক্তির রাসায়নিক বিক্রিয়াগুলি ও তড়িৎবিশ্লেষ্য পদার্থের উপর নির্ভর করে। ক্ষার এবং দস্তা–কার্বন কোষগুলির আলাদা আলাদা রসায়ন রয়েছে তবে তাদের প্রায় ১.৫ ভোল্টের একই তড়িচ্চালক বল থাকে; তেমনি NiCd এবং NiMH কোষের আলাদা আলাদা রসায়ন রয়েছে তবে তাদের প্রায় ১.২ ভোল্টের একই তড়িচ্চালক বল থাকে। [১৮] লিথিয়াম যৌগসমূহের বিক্রিয়াগুলিতে উচ্চ তড়িৎরাসায়নিক বিভব পরিবর্তিত হয় বলে লিথিয়াম কোষগুলি ৩ ভোল্ট বা তারও বেশি তড়িচ্চালক বল প্রদান করে। [১৯]
ব্যাটারির শ্রেণি এবং ধরন
[সম্পাদনা]
ব্যাটারি বিভিন্ন প্রাথমিক এবং গৌণ ধরণে শ্রেণিবদ্ধ করা হয়:
- প্রাথমিক ব্যাটারি শক্তি নিঃশেষ না হওয়া পর্যন্ত ব্যবহারের জন্য ডিজাইন করা হয় আর তারপর তা ফেলে দেওয়া হয়। এগুলির রাসায়নিক বিক্রিয়াগুলি সাধারণত উভমুখী হয় না, তাই এগুলিকে পুনরায় চার্জ করা যায় না। যখন ব্যাটারিতে বিক্রিয়কের সরবরাহ শেষ হয়ে যায়, তখন ব্যাটারি কারেন্ট উৎপাদন বন্ধ করে দেয় এবং অকেজো হয়ে যায়। [২০]
- গৌণ ব্যাটারি রিচার্জ করা যেতে পারে; অর্থাৎ, এই কোষে তড়িৎ প্রবাহ প্রয়োগ করে এগুলির রাসায়নিক বিক্রিয়াগুলি উভমুখী করা যায়। এটি আসল রাসায়নিক বিক্রিয়কগুলিকে পুনঃউৎপাদন করে, তাই এগুলি একাধিকবার ব্যবহার করা, পুনরায় চার্জ করা এবং পুনরায় ব্যবহার করা যেতে পারে। [২১]
কিছু ধরনের প্রাথমিক ব্যাটারি ব্যবহৃত হত, উদাহরণস্বরূপ, টেলিগ্রাফ সার্কিটগুলির জন্য, যা তড়িৎদ্বারগুলিকে প্রতিস্থাপন করার মাধ্যমে সেগুলিকে কাজে ফিরিয়ে আনে। [২২] সক্রিয় পদার্থের অপচয়, তড়িৎবিশ্লেষ্য পদার্থের হ্রাস এবং অভ্যন্তরীণ ক্ষয়ের কারণে গৌণ ব্যাটারিগুলি অনির্দিষ্টকালের জন্য পুনর্ভরণযোগ্য হয় না।
প্রাথমিক
[সম্পাদনা]প্রাথমিক ব্যাটারি বা প্রাথমিক কোষগুলি যন্ত্রে লাগানোর সাথে সাথেই তড়িৎপ্রবাহ উৎপন্ন করতে পারে। এগুলি কেবল মাঝেমধ্যে ব্যবহৃত হয় বা পরিবর্তী বিদ্যুত উৎস থেকে অনেক দূরে ব্যবহৃত হয় এমন বহনযোগ্য যন্ত্রগুলিতে সবচেয়ে বেশি ব্যবহৃত হয়, যেগুলির বিদ্যুৎ ক্ষরণ কম হয়ে থাকে, যেমন অ্যালার্ম এবং যোগাযোগ সার্কিটের মতো যন্ত্রতে; যেখানে অন্যান্য বৈদ্যুতিক শক্তি কেবল মাঝেমধ্যেই ব্যবহারযোগ্য হয়ে থাকে। পরিত্যাজ্য বা ফেলে দেয়া যায় এমন প্রাথমিক কোষগুলি নির্ভরযোগ্যতার সাথে পুনরায় চার্জ করা যায় না, কারণ তাতে রাসায়নিক বিক্রিয়াগুলি সহজে প্রতিবর্তনযোগ্য হয় না এবং সক্রিয় উপাদানগুলি তাদের মূল অবস্থায় ফিরিয়ে আনা যায় না। ব্যাটারি প্রস্তুতকারকরা প্রাথমিক ব্যাটারিগুলিকে রিচার্জ করার চেষ্টা না করার পরামর্শ দেয়। [২৩] সাধারণভাবে, এগুলির শক্তির ঘনত্ব পুনর্ভরণযোগ্য ব্যাটারিগুলির তুলনায় বেশি হয় [২৪] তবে পরিত্যাজ্য তড়িৎকোষগুলি ৭৫ ওহমের (৭৫ Ω) এর কম লোডসম্পন্ন উচ্চ-ক্ষরণশীল যন্ত্রগুলিতে ভাল চলে না। সাধারণ পরিত্যাজ্য তড়িৎকোষর মধ্যে রয়েছে দস্তা-কার্বন ব্যাটারি এবং ক্ষারীয় ব্যাটারি ।
এই ধরনের ব্যাটারি ব্যবহার করতে থাকলে ব্যাটারির অভ্যন্তরে রাসায়নিক বিক্রিয়ায় বিক্রিয়কগুলির পরিমাণ ক্রমশ কমতে থাকে এবং এক সময় নিঃশেষিত হয়। এই অবস্থায় ব্যাটারি আর তড়িৎ শক্তি উৎপন্ন করতে পারে না এবং একে ফেলে দেওয়া হয় । যেমন নির্জল নির্জল কোষ , লেকল্যান্স কোষ (Leclanche cell) ইত্যাদি।
গৌণ
[সম্পাদনা]গৌণ ব্যাটারি, যা সেকেন্ডারি সেল বা রিচার্জেবল ব্যাটারি হিসাবেও পরিচিত, প্রথমবার ব্যবহারের আগে চার্জ করতে হয়; এগুলি সাধারণত ক্ষরণ অবস্থায় থাকা সক্রিয় উপকরণগুলির সাথে যুক্ত করা হয়। রিচার্জেবল ব্যাটারিগুলি বৈদ্যুতিক প্রবাহ প্রয়োগ করে পুনরায় চার্জ করা হয়, যা ক্ষরণ /ব্যবহারের সময় ঘটে এমন রাসায়নিক বিক্রিয়াকে বিপরীত দিকে ঘটায়। উপযুক্ত তড়িৎপ্রবাহ সরবরাহ করার যন্ত্রগুলিকে চার্জার বলা হয়।
রিচার্জেবল ব্যাটারির প্রাচীনতম রূপটি হল লেড-অ্যাসিড ব্যাটারি, যা মোটরগাড়ি এবং নৌকা চালানোর যন্ত্রে ব্যাপকভাবে ব্যবহৃত হয়। এই প্রযুক্তিতে একটি খোলা কনটেইনারে তরল তড়িৎবিশ্লেষ্য পদার্থ থাকে, আর এক্ষেত্রে জন্য ব্যাটারিটি খাড়া করে রাখতে হয় এবং অতিরিক্ত পরিমাণে চার্জ হয়ে গেলে যাতে এর থেকে উৎপন্ন হাইড্রোজেন গ্যাস সহজে বেড়িয়ে যেতে পারে সেজন্য ভালভাবে বায়ুচলাচলের ব্যবস্থা রাখতে হয়। লেড-অ্যাসিড ব্যাটারি যে পরিমাণ বৈদ্যুতিক শক্তি সরবরাহ করতে পারে তার অনুপাতে সেটি তুলনামূলকভাবে ভারী হয়ে থাকে। যেখানে এটির ওজন এবং পরিচালনা সংক্রান্ত সমস্যার তুলনায় এর ক্ষমতা (প্রায় ১০ অ্যাম্পিয়ার) বেশি গুরুত্বপূর্ণ সেখানে এটির স্বল্প উৎপাদন ব্যয় এবং উচ্চতর তড়িৎপ্রবাহ ক্ষমতা এটিকে গ্রহণযোগ্য করে তোলে । এটির সাধারণ ব্যবহার হল আধুনিক গাড়ির ব্যাটারি হিসেবে, যা সাধারণত সর্বোচ্চ ৪৫০ অ্যাম্পিয়ারের প্রবাহ সরবরাহ করতে পারে।
বদ্ধ ভালভ নিয়ন্ত্রিত লেড–অ্যাসিড ব্যাটারি (ভিআরএলএ ব্যাটারি) তরল তড়িৎবিশ্লেষ্য পদার্থ দিয়ে তৈরি লেড – অ্যাসিড ব্যাটারির বিকল্প হিসাবে মোটরগাড়ি শিল্পে জনপ্রিয়। ভিআরএলএ ব্যাটারিতে নিশ্চল সালফিউরিক অ্যাসিড তড়িৎবিশ্লেষ্য পদার্থ হিসেবে ব্যবহার করা হয়, যা এর ছিদ্র হওয়ার সম্ভাবনা হ্রাস করে এবং স্থায়িত্বকাল বাড়িয়ে দেয়। [২৫] ভিআরএলএ ব্যাটারি তড়িৎবিশ্লেষ্য পদার্থকে নিশ্চল করে। এর দুটি প্রকার রয়েছে:
- জেল ব্যাটারি (বা "জেল সেল"), এটি এক ধরনের অর্ধ-কঠিন তড়িৎবিশ্লেষ্য পদার্থ ব্যবহার করে।
- অ্যাবজরবেন্ট গ্লাস ম্যাট (এজিএম) ব্যাটারি, এটি একটি বিশেষ ফাইবারগ্লাস ম্যাটিং পদ্ধতিতে তড়িৎবিশ্লেষ্য পদার্থ শোষণ করে নেয়।
অন্যান্য বহনযোগ্য পুনর্ভরণযোগ্য ব্যাটারির মধ্যে রয়েছে, বেশ কয়েক প্রকারের বদ্ধ "শুষ্ক কোষ", যা মোবাইল ফোন এবং ল্যাপটপ কম্পিউটারের মতো যন্ত্রগুলির জন্য উপযোগী। এই ধরনের (শক্তি ঘনত্ব এবং ব্যয় বৃদ্ধির ক্রম অনুসারে ) কোষগুলির মধ্যে নিকেল – ক্যাডমিয়াম (NiCd), নিকেল – জিঙ্ক (NiZn), নিকেল ধাতব হাইড্রাইড (NiMH), এবং লিথিয়াম-আয়ন (লি-আয়ন) কোষ অন্তর্ভুক্ত রয়েছে। পুনর্ভরণযোগ্য ড্রাই সেলের বাজারে লিথিয়াম-আয়ন এখন পর্যন্ত সবচেয়ে বেশি শেয়ার দখল করে আছে। উচ্চ ক্ষমতার কারণে বেশিরভাগ যন্ত্রে নিকেল – ক্যাডমিয়াম (NiCd) ব্যাটারিকে কে নিকেল ধাতব হাইড্রাইড (NiMH) ব্যাটারি দ্বারা প্রতিস্থাপন করা হয়েছে, তবে বৈদ্যুতিক সরঞ্জাম, দ্বি-মুখী রেডিও এবং চিকিৎসা সরঞ্জামগুলিতে নিকেল – ক্যাডমিয়াম (NiCd) ব্যাটারির ব্যবহারে রয়ে গেছে।
২০০০ এর দশকের উন্নয়নগুলির মধ্যে রয়েছে এম্বেডেড ইলেকট্রনিক্সে যেমন ইউএসবিসেল-এ ব্যাটারি যুক্ত করা, যার মাধ্যমে একটি ইউএসবি কানেক্টরের মাধ্যমে একটি এএ ব্যাটারি চার্জ করা যায়,[২৬] ন্যানোবল ব্যাটারি, যা বর্তমান ব্যাটারিগুলির চেয়ে প্রায় ১০০গুণ বেশি হারে ক্ষরণ করতে পারত এবং স্টেট-অফ-চার্জ মনিটর এবং অতিরিক্ত ক্ষরণজনিত ক্ষতি প্রতিরোধী ব্যাটারি সুরক্ষা সার্কিট সমৃদ্ধ স্মার্ট ব্যাটারি প্যাক। লো স্বতক্ষরণ (এলএসডি) এর মাধ্যমে শিপিংয়ের আগে গৌণ কোষগুলি চার্জ করা যেত।
কোষের ধরন
[সম্পাদনা]গ্যালভ্যানিক কোষ, তড়িৎবিশ্লেষ্য কোষ, জ্বালানী কোষ, প্রবাহ কোষ এবং ভোল্টাইক পাইল সহ বিভিন্ন ধরনের রাসায়নিক প্রক্রিয়া ও নকশার অনেক তড়িৎরাসায়নিক কোষ তৈরি হয়েছে। [২৭]
আর্দ্র কোষ
[সম্পাদনা]একটি আর্দ্র কোষ ব্যাটারিতে তরল তড়িৎবিশ্লেষ্য পদার্থ থাকে । অপর নামগুলি হল জল নিমজ্জিত কোষ, কারণ তরলটি সমস্ত অভ্যন্তরীণ অংশজুড়ে থাকে বা ভেন্টেন্ট কোষ , কারণ এর কার্যক্রমের সময় উৎপন্ন গ্যাস বেরিয়ে যেতে পারে। আর্দ্র কোষগুলি শুকনো কোষগুলির পূর্বসুরী ছিল এবং সাধারণত তড়িৎ-রসায়ন শেখার একটি সরঞ্জাম হিসাবে ব্যবহৃত হত। তড়িৎরাসায়নিক কোষগুলি কীভাবে কাজ করে তা প্রদর্শনের জন্য পরীক্ষাগারের সাধারণ উপকরণ, যেমন বিকার ব্যবহার করে তা তৈরি করা যেত।আর্দ্র কোষ হিসেবে পরিচিত একটি বিশেষ ধরনের ঘনীভবন কোষ জারণ বোঝার ক্ষেত্রে গুরুত্বপূর্ণ। আর্দ্র কোষগুলি প্রাথমিক কোষ (অ-পুনর্ভরণযোগ্য) বা গৌণ কোষ (পুনর্ভরণযোগ্য) হতে পারে। মূলত, ড্যানিয়েল কোষের মতো সমস্ত ব্যবহারিক প্রাথমিক তড়িৎকোষ উপর থেকে খোলা পাত্রে আর্দ্র কোষ হিসাবে নির্মিত হয়েছিল। অন্যান্য প্রাথমিক আর্দ্র কোষ হল লেকল্যান্স কোষ, গ্রোভ কোষ, বুনসেন কোষ, ক্রোমিক অ্যাসিড কোষ, ক্লার্ক কোষ এবং ওয়েস্টন কোষ ।লেকল্যান্স কোষের রসায়নটি প্রথম দিকের শুষ্ক কোষের সাথে যুক্ত করে নেওয়া হয়েছিল। আর্দ্র কোষগুলি এখনো অটোমোবাইল ব্যাটারি এবং ইন্ডাস্ট্রিতে সুইচগিয়ারের সহায়ক শক্তির উৎস হিসেবে, টেলিযোগযোগ বা বৃহত্তর নিরবচ্ছিন্ন বিদ্যুত সরবরাহের জন্য ব্যবহৃত হয়, তবে অনেক জায়গায় এটির পরিবর্তে জেল কোষ দিয়ে তৈরি ব্যাটারি ব্যবহার করা হয়েছে। এই যন্ত্রগুলিতে সাধারণত লেড-অ্যাসিড বা নিকেল – ক্যাডমিয়াম কোষ ব্যবহার করা হয়।
শুষ্ক কোষ
[সম্পাদনা]
১. ব্রাস ক্যাপ, ২. প্লাস্টিকের সিল, ৩. সম্প্রসারণ স্থান, ৪. ছিদ্রযুক্ত পিচবোর্ড, ৫. দস্তা ক্যান, ৬. কার্বন রড, ৭. রাসায়নিক মিশ্রণ
একটি শুষ্ক কোষে বিদ্যুৎ প্রবাহ সচল রাখতে শুধুমাত্র পর্যাপ্ত পরিমাণে আর্দ্রতাসম্পন্ন তড়িৎবিশ্লেষ্য পদার্থের একটি পেস্ট ব্যবহার করা হয়। একটি আর্দ্র কোষের বিপরীতে, একটি শুষ্ক কোষ কোন তরলের ঝরে পড়া ছাড়াই কাজ করতে পারে, কারণ এতে কোনও মুক্ত তরল থাকে না, যা এটিকে বহনযোগ্য সরঞ্জামে ব্যবহারের জন্য উপযুক্ত করে তোলে। তুলনামূলক ভাবে, প্রথম আর্দ্র কোষগুলি সাধারণত খোলা কাঁচের পাত্রে উপরের খোলা অংশ থেকে সীসার দণ্ড ঝুলন্ত ছিল এবং তরলের ঝরে পড়া এড়ানোর জন্য যত্ন সহকারে পরিচালনার প্রয়োজন হত। জেল ব্যাটারির বিকাশ না হওয়া পর্যন্ত লেড-অ্যাসিড ব্যাটারি শুষ্ক কোষের মতো সুরক্ষা এবং বহনযোগ্যতা অর্জন করতে পারেনি।
সাধারণ একটি শুষ্ক কোষ হল দস্তা-কার্বন ব্যাটারি, কখনও কখনও শুকনো লেকল্যান্স কোষও বলা হয়, যাতে ক্ষারীয় ব্যাটারির সমান (যেহেতু উভয় একই দস্তা - ম্যাঙ্গানিজ ডাইঅক্সাইড সংমিশ্রণ ব্যবহার করে) ১.৫ ভোল্টের নামমাত্র ভোল্টেজ থাকে। একটি মানসম্পন্ন শুষ্ক কোষ সাধারণত নলাকার পাত্রের আকারের একটি দস্তা অ্যানোড এবং একটি কেন্দ্রীয় দণ্ড আকারের কার্বন ক্যাথোড নিয়ে গঠিত হয়। এক্ষেত্রে তড়িৎবিশ্লেষ্য পদার্থ হল অ্যামোনিয়াম ক্লোরাইড যা দস্তা অ্যানোডের পাশে পেস্ট রূপে থাকে। তড়িৎবিশ্লেষ্য পদার্থ এবং কার্বন ক্যাথোডের মধ্যে অবশিষ্ট স্থানটি অ্যামোনিয়াম ক্লোরাইড এবং ম্যাঙ্গানিজ ডাই অক্সাইড সমন্বিত অন্য একটি পেস্ট দ্বারা পূর্ণ করা হয়, এটি পরবর্তীতে ডিপোলারাইজার হিসাবে কাজ করে। কিছু কিছু ডিজাইনে, অ্যামোনিয়াম ক্লোরাইড কে দস্তা ক্লোরাইড দ্বারা প্রতিস্থাপন করা হয়।
গলিত লবণ
[সম্পাদনা]গলিত লবণের ব্যাটারিগুলি হল প্রাথমিক বা গৌণ ব্যাটারি যা গলিত লবণকে তড়িৎবিশ্লেষ্য পদার্থ হিসাবে ব্যবহার করে। এগুলি উচ্চ তাপমাত্রায় কাজ করে এবং তাপ বজায় রাখতে অবশ্যই ভালভাবে আলাদা করে রাখতে হয়।
সংরক্ষণ
[সম্পাদনা]একটি রিজার্ভ ব্যাটারি দীর্ঘ সময় ধরে (হয়ত কয়েক বছর) জড়ো করে (অচল করে রেখে ও কোন শক্তি সরবরাহ না করে) সংরক্ষণ করা যেতে পারে। যখন ব্যাটারিটি প্রয়োজন হয়, তখন এটি একত্রিত করা হয় (যেমন, তড়িৎবিশ্লেষ্য পদার্থ যোগ করে); একবার একত্রিত হয়ে গেলে, ব্যাটারিটি চার্জ করা হয় এবং কাজের জন্য প্রস্তুত হয়ে যায়। উদাহরণস্বরূপ, একটি ইলেকট্রনিক আর্টিলারি ফিউজের জন্য একটি ব্যাটারিকে বন্দুক চালানোর প্রভাব দ্বারা সক্রিয় করা হতে পারে। ত্বরণটি তড়িৎবিশ্লেষ্য পদার্থের একটি ক্যাপসুলকে ভেঙে দেয় যা ব্যাটারিটিকে সক্রিয় করে এবং ফিউজের সার্কিটগুলিকে শক্তি সরবরাহ করে। রিজার্ভ ব্যাটারিগুলি সাধারণত দীর্ঘ সময় (বছর) স্টোরেজে রাখার পরে স্বল্প সময়ের (সেকেন্ড বা মিনিট) জন্য ব্যবহার করার জন্য ডিজাইন করা হয়ে থাকে। সমুদ্রবৃত্তীয় যন্ত্রপাতি বা সামরিক যন্ত্রগুলির জন্য ব্যবহৃত পানি-সক্রিয় ব্যাটারি পানিতে নিমজ্জন করার মাধ্যমে সক্রিয় হয়।
কোষের কর্মক্ষমতা
[সম্পাদনা]অভ্যন্তরীণ রসায়ন, প্রবাহ ক্ষরণ এবং তাপমাত্রা সহ অনেকগুলি বিষয়ের কারণে একটি ব্যাটারির অতিরিক্ত লোড সাইকেল, ওভার চার্জ সাইকেল ও অতিরিক্ত স্থায়িত্বকালের মতো বৈশিষ্ট্যগুলি আলাদা হতে পারে। কম তাপমাত্রায়, একটি ব্যাটারি তত বেশি শক্তি সরবরাহ করতে পারে না। যেমন, শীতল আবহাওয়ায় কিছু গাড়ির মালিক ব্যাটারি ওয়ার্মার ইনস্টল করেন, যা ছোট বৈদ্যুতিক হিটিং প্যাড যেটি গাড়ির ব্যাটারিকে উষ্ণ রাখে।
ক্ষমতা এবং ক্ষরণ
[সম্পাদনা]
একটি ব্যাটারির ক্ষমতা হল নির্ধারিত ভোল্টেজে এটির সরবরাহ করা বৈদ্যুতিক আধানের পরিমাণ । কোষটিতে যত বেশি তড়িৎদ্বার উপাদান থাকে সেটির ক্ষমতা তত বেশি হয়। একটি ছোট কোষের একই রসায়নবিশিষ্ট বৃহত্তর কোষের চেয়ে কম ক্ষমতা থাকে, যদিও তারা একই ওপেন-সার্কিট ভোল্টেজ গড়ে তোলে। [২৮] এই ক্ষমতা অ্যাম্পিয়ার-আওয়ার (A·h) এককে পরিমাপ করা হয়। একটি ব্যাটারির নির্ধারিত ক্ষমতাকে সাধারণত ২০ ঘণ্টার সাথে ৬৮ °ফা (২০ °সে) তাপমাত্রায় একটি নতুন ব্যাটারি ধারাবাহিকভাবে ২০ ঘণ্টা যাবত যে প্রবাহ দিতে পারে তার গুণ করে প্রাপ্ত গুণফল হিসাবে প্রকাশ করা হয়, যখন সেল প্রতি নির্দিষ্ট টার্মিনাল ভোল্টেজের উপরে থাকে। উদাহরণস্বরূপ, ১০০ A · h এ হিসাবকৃত একটি ব্যাটারির কক্ষ তাপমাত্রায় ২০-ঘণ্টা সময় ধরে 5 A প্রবাহ সরবরাহ করতে পারে। ব্যাটারিটি সরবরাহ করতে পারে এমন সঞ্চিত চার্জের ভগ্নাংশ ব্যাটারিটির রসায়ন, চার্জটি যে হারে সরবরাহ করা হয় (প্রবাহ), প্রয়োজনীয় টার্মিনাল ভোল্টেজ, সঞ্চয়ের সময়কাল, পরিবেশের তাপমাত্রা এবং অন্যান্য কারণ সহ একাধিক কারণের উপর নির্ভর করে।[২৮]
ক্ষরণের হার যত বেশি, ক্ষমতা তত কম। [২৯] একটি লেড অ্যাসিড ব্যাটারির প্রবাহ, ক্ষরণের সময় এবং ক্ষমতার মধ্যে সম্পর্ক পিউকার্টের সূত্র অনুসারে (বর্তমান মানগুলির একটি সাধারণ পরিসরের ভিত্তিতে) অনুমান করা হয়:
যেখানে,
- হল ১ অ্যাম্পিয়ার হারে ক্ষরণ হওয়ার সময় ক্ষমতা।
- হল ব্যাটারি থেকে পাওয়া প্রবাহ(A)।
- একটি ব্যাটারি শক্তি সরবরাহ করতে পারে এমন সময়ের পরিমাণ (ঘণ্টায়)।
- প্রায় ১.৩ এর কাছাকাছি একটি ধ্রুবক।
যেসব ব্যাটারি দীর্ঘ সময়ের জন্য মজুদ করে রাখা হয় বা ক্ষমতার একটি সামান্য ভগ্নাংশে ক্ষরণ হয় সেগুলি সাধারণভাবে অপরিবর্তনীয় পার্শ্ব বিক্রিয়াগুলির উপস্থিতির কারণে ক্ষমতা হারাতে থাকে যা তড়িৎপ্রবাহ উৎপাদন ছাড়াই আধান বাহক খরচ করে। এই ঘটনাটি অভ্যন্তরীণ স্বতক্ষরণ হিসাবে পরিচিত। উপরন্তু, যখন ব্যাটারিগুলি রিচার্জ করা হয়, তখন অতিরিক্ত পার্শ্ব বিক্রিয়া দেখা দিতে পারে, যা পরবর্তী ক্ষরণের ক্ষমতা হ্রাস করে দেয়। পর্যাপ্ত সংখ্যক রিচার্জের পরে, সংক্ষেপে বলতে গেলে সমস্ত ক্ষমতা নষ্ট হয়ে যায় এবং ব্যাটারি শক্তি উৎপাদন বন্ধ করে দেয়।
অভ্যন্তরীণ শক্তি হ্রাস এবং আয়নগুলি তড়িৎবিশ্লেষ্য পদার্থের মধ্য দিয়ে যে হারে যায় তার সীমাবদ্ধতার কারণে ব্যাটারির দক্ষতা পরিবর্তিত হয়। সর্বনিম্ন সীমার উপরে, স্বল্প হারে ক্ষরণ করা হলে উচ্চতর হারে ক্ষরণ করার তুলনায় ব্যাটারির ধারণক্ষমতার চেয়ে বেশি সরবরাহ প্রদান করে। পরিবর্তনশীল A ·h রেটিং এর ব্যাটারি ইনস্টল করা হলে তা কোনও নির্দিষ্ট ভোল্টেজের জন্য নির্ধারণকৃত যন্ত্রের ক্রিয়াকলাপকে প্রভাবিত করে না, (যদিও এটি ক্রিয়াকলাপ ব্যবধানকে প্রভাবিত করতে পারে) যদি না লোডের সীমা অতিক্রম না করা হয়। ডিজিটাল ক্যামেরার মতো উচ্চ-ক্ষরণশীল লোডগুলি মোট ক্ষমতা হ্রাস করতে পারে, যেমনটি ক্ষারীয় ব্যাটারিগুলির ক্ষেত্রে ঘটে থাকে। উদাহরণস্বরূপ, ১০- বা ২০-ঘণ্টা যাবত ক্ষরণের জন্য একটি ২ A·h রেটিং এর ব্যাটারি পূর্ণ ২ ঘণ্টার জন্য ১ অ্যাম্পিয়ার প্রবাহ প্রদান করতে পারবে না যেমনটি এর বর্ণিত ক্ষমতার দ্বারা বোঝা যায়।
সি রেট
[সম্পাদনা]সি-রেট হল কোনও ব্যাটারি যে হারে চার্জ হয় বা ক্ষরণ হয় তার একটি পরিমাপ। এটি ব্যাটারির মধ্য দিয়ে প্রবাহিত তড়িৎ প্রবাহ কে তাত্ত্বিক তড়িৎ প্রবাহ (যার অধীনে ব্যাটারিটি এক ঘণ্টার মধ্যে নামানুযায়ী নির্ধারিত ক্ষমতা সরবরাহ করে) দ্বারা ভাগ করে প্রাপ্ত ভাগফল হিসেবে সংজ্ঞায়িত করা হয় । [৩০] এটির একক h −1।
অভ্যন্তরীণ রোধজনিত ক্ষয় এবং কোষের অভ্যন্তরে রাসায়নিক প্রক্রিয়াগুলির কারণে, একটি ব্যাটারি খুব কম ক্ষেত্রে মাত্র এক ঘণ্টার মধ্যে নামফলকে নির্ধারিত হারে ক্ষমতা সরবরাহ করে।
সাধারণত, কম সি-রেটে সর্বাধিক ক্ষমতা পাওয়া যায় এবং উচ্চতর সি-হারে চার্জ বা ক্ষরণ করা হলে তা ব্যাটারির ব্যবহারযোগ্য জীবন এবং ক্ষমতা হ্রাস করে দেয়। উৎপাদকরা প্রায়শই ক্ষমতা বনাম সি-রেট রেখাচিত্রের গ্রাফগুলিসহ ডেটাশিট প্রকাশ করেন। কোনও ব্যাটারি কোন সার্কিটে নিরাপদভাবে বিতরণ করতে পারে এমন সর্বোচ্চ তড়িৎপ্রবাহকে নির্দেশ করতেও রেটিং হিসাবে ব্যাটারিতে সি-রেট ব্যবহৃত হয়। পুনর্ভরণযোগ্য ব্যাটারির মানদণ্ডগুলি সাধারণত ৪ ঘণ্টা (০.২৫ কুলম্ব), ৮ ঘণ্টা (০.১২৫ কুলম্ব) বা দীর্ঘতর ক্ষরণের সময় ধরে সেটির ক্ষমতা এবং চার্জ সাইকেলকে নির্ধারণ করা হয়।কম্পিউটারের নিরবচ্ছিন্ন বিদ্যুৎ সরবরাহের মতো বিশেষ উদ্দেশ্যে অভিপ্রেত প্রকারগুলির ক্ষেত্রে, নির্মাতারা ক্ষরণের জন্য এক ঘণ্টার (১ কুলম্ব) চেয়ে কম নির্ধারণ করে দিতে পারেন তবে তা সীমাবদ্ধ জীবন চক্রের সমস্যায় পড়তে পারে।
দ্রুত চার্জিং, বড় এবং হালকা ব্যাটারি
[সম্পাদনা]২০১২-এর হিসাব অনুযায়ী[হালনাগাদ], লিথিয়াম আয়রন ফসফেট (LiFePO
4) ব্যাটারি সবচেয়ে দ্রুত চার্জিং/ক্ষরণিং প্রযুক্তি ছিল, যা ১০-২০ সেকেন্ডে পরিপূর্ণভাবে ক্ষরণ হয়ে যেত। [৩১]
২০১৭-এর হিসাব অনুযায়ী[হালনাগাদ], টেসলা কোম্পানি দক্ষিণ অস্ট্রেলিয়ায় পৃথিবীর সবচেয়ে বড় ব্যাটারি নির্মাণ করে ।এটি ১২৯ মেগাওয়াট-ঘণ্টা বিদ্যুৎ মজুদ করতে পারে ।[৩২] ৫০০ মিলিয়ন ডলার খরচে ২০১৩ সালে নির্মিত চীনের হেবেই প্রদেশের একটি ব্যাটারি ৩৬ মেগাওয়াট-ঘণ্টা বিদ্যুৎ মজুদ করতে পারে।[৩৩] আলাস্কার ফেয়ারব্যাংকসে ছিল নিকেল-ক্যাডমিয়াম কোষের মাধ্যমে তৈরি আরেকটি বিশাল ব্যাটারি। এটি ২,০০০ বর্গমিটার (২২,০০০ ফু২) জুড়ে বিস্তৃত ছিল—যা একটি ফুটবল মাঠের চেয়েও বড়—এবং ভর ছিল ১৩০০ টন।বিদ্যুৎ না থাকলে বিদ্যুৎশক্তি প্রদান করার জন্য এটি নির্মাণ করেছিল এবিবি কোম্পানি। এই ব্যাটারিটি ৭ মিনিট সময়ের জন্য ৪০ মেগাওয়াট বিদ্যুৎশক্তি সরবরাহ করতে পারে।[৩৪] বায়ুশক্তি মজুদ করে রাখার জন্য সোডিয়াম-সালফার ব্যাটারি ব্যবহার করা হয়েছে। [৩৫] একটি ৪.৪ মেগাওয়াট-ঘণ্টার ব্যাটারি সিস্টেম যা ২৫ মিনিটের জন্য ১১ মেগাওয়াট বিদ্যুৎ প্রবাহ দিতে পারে; এটি হাওয়াইয়ের আওয়াহি বায়ু ফার্মের আউটপুটকে স্থিতিশীল রাখে।[৩৬]
দীর্ঘতম ও উচ্চতম সৌর চালিত ফ্লাইটে লিথিয়াম–সালফার ব্যাটারি ব্যবহার করা হত।[৩৭]
জীবনকাল
[সম্পাদনা]ব্যাটারি লাইফ (এবং এর সমার্থক শব্দ ব্যাটারির জীবনকাল) এর পুনর্ভরণযোগ্য ব্যাটারিগুলির ক্ষেত্রে দুটি অর্থ রয়েছে তবে অ-পুনর্ভরণযোগ্য ব্যাটারির ক্ষেত্রে কেবলমাত্র একটি অর্থ রয়েছে। পুনর্ভরণযোগ্য ব্যাটারিগুলির ক্ষেত্রে, এর অর্থ কোষগুলি সন্তুষ্টিজনকভাবে পরিচালিত করতে ব্যর্থ হওয়ার আগ পর্যন্ত কোনও যন্ত্র পুরোপুরি চার্জ করা ব্যাটারি দিয়ে যত সম্ভব সময় চলতে পারে বা চার্জ /ক্ষরণ চক্রের সংখ্যাকে বোঝায় । অ-পুনর্ভরণযোগ্য ব্যাটারির ক্ষেত্রে এই দুটি জীবন সমান হয় কারণ, সংজ্ঞা অনুসারে এ ধরনের কোষগুলি কেবল একটি চক্রের জন্য স্থায়ী হয়। (শেল্ফ লাইফ শব্দটি ব্যাটারি উতপাদন ও ব্যবহারের মধ্যে কত সময় তার কার্যকারিতা বজায় রাখতে পারে তা বর্ণনা করতে ব্যবহৃত হয়।) সমস্ত ব্যাটারির উপলব্ধ ক্ষমতা তাপমাত্রা হ্রাস পাওয়ার সাথে সাথে কমে যায়। আজকের দিনের বেশিরভাগ ব্যাটারির বিপরীতে, ১৮১২ সালে উদ্ভাবিত জাম্বোনি পাইল সংস্কার বা রিচার্জ ছাড়াই একটি অনেক বেশি সময় ধরে কাজ করতে পারত, যদিও এটি কেবল ন্যানো অ্যাম্পিয়ার পরিসরে তড়িৎপ্রবাহ সরবরাহ করে। অক্সফোর্ড ইলেক্ট্রিক বেলটি ১৮৪০ সাল থেকে এটির আসল ব্যাটারি জোড়া দিয়ে প্রায় একটানা বেজে চলেছে, এটিকে জাম্বোনি পাইল বলে মনে করা হয়।[তথ্যসূত্র প্রয়োজন]
স্বতক্ষরণ
[সম্পাদনা]পরিত্যাজ্য তড়িৎকোষগুলি সাধারণত কক্ষ তাপমাত্রায় (২০-৩০° সে.) মজুদ করে রাখলে প্রতি বছর তাদের মূল চার্জের ৮ থেকে ২০ শতাংশ হারিয়ে ফেলে। [৩৮] এটি "স্বতক্ষরণ" হার হিসাবে পরিচিত এবং এটি কোনও লোডের সাথে যুক্ত না করা সত্ত্বেও কোষের মধ্যকার অ-তড়িৎপ্রবাহ-উৎপাদনকারী "পার্শ্ব" রাসায়নিক বিক্রিয়াগুলির কারণে ঘটে থাকে। পার্শ্ব বিক্রিয়াগুলির হার কম তাপমাত্রায় মজুদকৃত ব্যাটারিগুলির জন্য হ্রাস করা হয়, যদিও কিছু ব্যাটারি হিমায়িত হয়ে ক্ষতিগ্রস্ত হতে পারে।
পুরানো পুনর্ভরণযোগ্য ব্যাটারি পরিত্যাজ্য ক্ষারীয় ব্যাটারি, বিশেষত নিকেল-ভিত্তিক ব্যাটারির চেয়ে বেশি দ্রুত স্বতক্ষরণ হয়ে থাকে; নতুনভাবে চার্জ করা একটি নিকেল ক্যাডমিয়াম (NiCd) ব্যাটারি প্রথম 24 ঘণ্টার মধ্যে তার চার্জের ১০% হারায় এবং তারপরে প্রতি মাসে প্রায় ১০% হারে ক্ষরণ হয়। তবে, নতুন নিম্ন স্বতক্ষরণ নিকেল ধাতব হাইড্রাইড (NiMH) ব্যাটারি এবং আধুনিক ডিজাইনের লিথিয়াম ব্যাটারি স্বতক্ষরণের হার কম প্রদর্শন করে (তবে প্রাথমিক ব্যাটারির চেয়ে তা এখনও বেশি)।
ক্ষয়
[সম্পাদনা]অভ্যন্তরীণ অংশগুলি ক্ষয়প্রাপ্ত এবং অকেজো হতে পারে, বা সক্রিয় উপাদানগুলি ধীরে ধীরে নিষ্ক্রিয় রূপে রূপান্তরিত হয়ে যেতে পারে।
ভৌত উপাদানের পরিবর্তন
[সম্পাদনা]ব্যাটারি প্লেটের উপরে থাকা সক্রিয় উপাদানগুলি প্রতিটি চার্জ এবং ক্ষরণ চক্রে রাসায়নিক গঠন পরিবর্তন করে; আয়তনের বস্তুগত পরিবর্তনের কারণে সক্রিয় উপাদানগুলি নষ্ট হয়ে যেতে পারে,তাছাড়া আর কত বার ব্যাটারি রিচার্জ যেতে পারে তার সংখ্যাকে সীমাবদ্ধ করে দিতে পারে। বেশিরভাগ নিকেল-ভিত্তিক ব্যাটারি ক্রয় করার সময়ই আংশিকভাবে ক্ষরণ হয়ে থাকে এবং প্রথম ব্যবহারের আগে অবশ্যই চার্জ করতে হয়। [৩৯] অপেক্ষাকৃত নতুন নিকেল ধাতব হাইড্রাইড (NiMH) ব্যাটারিগুলি ক্রয় করার সময়ই ব্যবহারের জন্য প্রস্তুত থাকে এবং এক বছরে এটির ক্ষরণের হার থাকে কেবল ১৫%। [৪০]
প্রতিটি চার্জ-ক্ষরণ চক্রের সময় কিছু ক্ষয় ঘটে। সাধারণত ক্ষয় ঘটার কারণ হল তড়িৎবিশ্লেষ্য পদার্থগুলি তড়িৎদ্বারগুলি থেকে দূরে সরে যায় বা তড়িৎদ্বারগুলি থেকে সক্রিয় উপাদান বিচ্ছিন্ন হয়ে যায়। স্বল্প-ক্ষমতার নিকেল ধাতব হাইড্রাইড(NiMH) ব্যাটারি (১,৭০০-২,০০০ মিলিঅ্যাম্পিয়ার-ঘণ্টা) কে প্রায় ১০০০ বার চার্জ করা যায়, যেখানে উচ্চ-ক্ষমতার নিকেল ধাতব হাইড্রাইড(NiMH) ব্যাটারি (২,৫০০ মিলিঅ্যাম্পিয়ার-ঘণ্টা এর উপরে) প্রায় ৫০০ টি চক্র পর্যন্ত স্থায়ী হয়। [৪১] নিকেল-ক্যাডমিয়াম (NiCd) ব্যাটারিগুলি তাদের অভ্যন্তরীণ রোধ স্থায়ীভাবে ব্যবহারযোগ্য মান ছাড়িয়ে যাওয়ার আগে ১,০০০ চক্রের জন্য নির্ধারণ করে দেওয়া হয়।
চার্জ / ক্ষরণ হওয়ার গতি
[সম্পাদনা]দ্রুত চার্জিং উপাদানগুলির পরিবর্তনকে বাড়িয়ে তোলে, ব্যাটারির জীবনকাল হ্রাস করে দেয়।[৪১]
অতিরিক্ত চার্জিং
[সম্পাদনা]কোনও চার্জার যদি কখন ব্যাটারিটি পুরোপুরি চার্জ হয় তা শনাক্ত করতে না পারে তখন অতিরিক্ত চার্জিং ঘটে; যা এটিকে ক্ষতিগ্রস্ত করে। [৪২]
স্মৃতি প্রভাব
[সম্পাদনা]নিকেল-ক্যাডমিয়াম (NiCd) কোষ যদি কোনও নির্দিষ্ট পুনরাবৃত্তিমূলক পদ্ধতিতে ব্যবহৃত হয় তবে এর ক্ষমতায় হ্রাস দেখা যেতে পারে যাকে "স্মৃতি প্রভাব" বলা হয়। [৪৩] প্রভাব সহজ প্রচলিত ব্যবহার দ্বারা এড়ানো যেতে পারে। যদিও NiMH কোষের রসায়ন অনুরূপ, তবুও তা স্মৃতি প্রভাবে কম পড়ে। [৪৪]

পরিবেশগত অবস্থা
[সম্পাদনা]মোটরগাড়ির পুনর্ভরণযোগ্য লেড–এসিড ব্যাটারিগুলিকে কম্পন, শক এবং তাপমাত্রার সীমার ফলে সৃষ্ট ধকল সহ্য করতে হয়। এই ধকল এবং তাদের সীসার প্লেটগুলির সালফেশনের কারণে, কিছু মোটরগাড়ির ব্যাটারি নিয়মিত ব্যবহারে ছয় বছর পর্যন্ত চলে। [৪৫] মোটরগাড়ি চালু (এসএলআই : শুরু, আলোকসজ্জা, ইগনিশন ) করতে ব্যবহৃত ব্যাটারিগুলিতে তড়িৎপ্রবাহকে সর্বাধিক কার্যকারী করতে অনেকগুলি পাতলা প্লেট থাকে। সাধারণভাবে, প্লেটগুলি যত ঘন হয়, ব্যাটারির জীবনকালও তত দীর্ঘ হয়। এগুলি সাধারণত রিচার্জের আগে সামান্য কিছুটা ক্ষরণ হয়ে থাকে।
বৈদ্যুতিক গল্ফ কার্টে ব্যবহৃত "ডিপ-সাইকেল" লেড–অ্যাসিড ব্যাটারিগুলিতে দীর্ঘায়ুতা বাড়ানোর জন্য অনেক ঘন প্লেট থাকে। [৪৬] লেড-অ্যাসিড ব্যাটারির প্রধান সুবিধা হল এর স্বল্প ব্যয়; এর প্রধান অসুবিধাগুলি হল প্রদত্ত ক্ষমতার এবং ভোল্টেজের জন্য বড় আকার এবং ভর। লেড-অ্যাসিড ব্যাটারিগুলিকে কখনও তাদের ক্ষমতার ২০% এর নিচে ক্ষরণ উচিত নয়,[৪৭] কারণ যখন এটি করা হবে তখন সেগুলির অভ্যন্তরীণ রোধ তাপ উৎপাদন এবং ক্ষতির কারণ হবে। ডিপ-সাইকেল লেড-অ্যাসিড সিস্টেমগুলি প্রায়শই সল্প-চার্জ সতর্কতা আলো বা একটি সল্প-চার্জ পাওয়ার কাট-অফ সুইচ ব্যবহার করে যাতে ব্যাটারির জীবনকাল সংক্ষিপ্ত করে তুলতে পারে এমন ধরনের ক্ষতি প্রতিরোধ করা যায় । [৪৮]
মজুদ
[সম্পাদনা]রেফ্রিজারেটর বা ফ্রিজারের মতো কম তাপমাত্রার স্থানে ব্যাটারি মজুদ করে রাখালে তা পার্শ্ব বিক্রিয়াগুলিকে ধীর করে দেয়, যার মাধ্যমে ব্যাটারির জীবনকাল বাড়ানো যেতে পারে। এই ধরনের মজুদ ক্ষারীয় ব্যাটারির আয়ু প্রায় ৫% বাড়িয়ে দিতে পারে; পুনর্ভরণযোগ্য ব্যাটারি তাদের ধরনের উপর নির্ভর করে তাদের চার্জ অনেক বেশি সময় ধরে রাখতে পারে। [৪৯] সর্বোচ্চ ভোল্টেজে পৌঁছানোর জন্য, ব্যাটারিগুলিকে অবশ্যই কক্ষ তাপমাত্রায় ফিরিয়ে আনতে হবে; ০° সে. তাপমাত্রায় ২৫০ মিলিঅ্যাম্পিয়ারের একটি ক্ষারীয় ব্যাটারিকে ক্ষরণ করা, ২০° সে. তাপমাত্রায় ক্ষরণ করার চেয়ে অর্ধেক ফলপ্রসূ। [২৪] ডিউরাসেলের মতো ক্ষারীয় ব্যাটারি প্রস্তুতকারীরা ব্যাটারি ফ্রিজে রাখার পরামর্শ দেয় না। [২৩]
ব্যাটারির আকার
[সম্পাদনা]বৈদ্যুতিক ঘড়িতে ব্যবহৃত ছোট বাটন সেলগুলি থেকে সিগন্যাল সার্কিটে বা অন্যান্য দীর্ঘ মেয়াদী অ্যাপ্লিকেশনগুলিতে ব্যবহৃত নাম্বার সিক্স সেল অবধি প্রাথমিক ব্যাটারিগুলি গ্রাহকদের জন্য সহজেই উপলব্ধ। গৌণ কোষগুলি খুব বড় আকারে তৈরি করা হয়; খুব বড় ব্যাটারিগুলি একটি সাবমেরিনকে বিদ্যুৎশক্তি প্রদান করতে পারে বা বৈদ্যুতিক গ্রিডকে স্থিতিশীল করতে পারে এবং সর্বোচ্চ লোডগুলিকে সমান করতে সহায়তা করে।
ঝুঁকি
[সম্পাদনা]বিস্ফোরণ
[সম্পাদনা]
সাধারণত ভুলভাবে ব্যবহার বা ত্রুটিযুক্ত কারণে ব্যাটারি বিস্ফোরণ ঘটে, যেমন একটি প্রাথমিক (অ-পুনর্ভরণযোগ্য) ব্যাটারি রিচার্জ করার চেষ্টা করা, বা শর্ট সার্কিট ।
যখন একটি ব্যাটারিকে অতিরিক্ত হারে রিচার্জ করা হয়, তখন হাইড্রোজেন এবং অক্সিজেনের একটি বিস্ফোরক গ্যাস মিশ্রণ ব্যাটারির মধ্যে থেকে যত দ্রুত বের হয় (যেমন একটি অন্তর্নির্মিত নির্গমনপথের মাধ্যমে) তার চেয়ে দ্রুত উৎপাদিত হতে পারে, যা ব্যাটারির ভিতরের চাপ বাড়িয়ে দেয় এবং এর পরিণতিতে ব্যাটারিটির কেসটিকে ফেটে যেতে পারে। চরম ক্ষেত্রে, ব্যাটারির রাসায়নিক পদার্থগুলি কেসিং থেকে জোরে ছড়িয়ে পড়তে পারে এবং আঘাতের কারণ হতে পারে। অতিরিক্ত চার্জ― কোনও ব্যাটারিকে তার বৈদ্যুতিক ক্ষমতার চেয়ে অতিরিক্ত চার্জ করার চেষ্টা করা― দেয়ার ফলে ছিদ্র হওয়া বা অপরিবর্তনীয় ক্ষতি হওয়া ছাড়াও ব্যাটারি বিস্ফোরণ ঘটতে পারে। এই অতিরিক্ত চার্জযুক্ত ব্যাটারিটির সাথে পরে ব্যবহার করা হয় এমন চার্জার বা যন্ত্রটিরও ক্ষতি হতে পারে।
একটি শর্ট সার্কিট যখন খুব বড় তড়িৎপ্রবাহ তৈরি করে তখন গাড়ির ব্যাটারি বিস্ফোরিত হতে পারে। এ জাতীয় ব্যাটারি যখন বেশি পরিমাণে চার্জ করা হয় তখন এটি হাইড্রোজেন উৎপাদন করে (তড়িৎবিশ্লেষ্য পদার্থে পানির তড়িৎ বিশ্লেষণ হওয়ার কারণে), যা খুবই বিস্ফোরক। সাধারণ ব্যবহারের সময়, অতিরিক্ত চার্জের পরিমাণ সাধারণত খুব কম হয় এবং খুব অল্প হাইড্রোজেন উৎপন্ন হয় যা দ্রুত দ্রবীভূত হয়ে যায়। যাইহোক, যখন কোনও গাড়ি "জাম্প স্টার্ট" করা হয়, এই উচ্চ প্রবাহটির কারণে বৃহত পরিমাণে হাইড্রোজেন দ্রুত বেরিয়ে আসতে পারে, যা কাছাকাছি স্পার্ক দ্বারা বিস্ফোরকভাবে জ্বলে উঠতে পারে, যেমন একটি জাম্পারের কেবল সংযোগ বিচ্ছিন্ন করার সময় সৃষ্ট স্পার্ক।
পোড়ানোর মাধ্যমে কোন ব্যাটারি ডিসপোজ করার ফলে বদ্ধ কেসটির মধ্যে বাষ্প তৈরি হয়, যার ফলে বিস্ফোরণ ঘটতে পারে।
সাম্প্রতিক বছরগুলিতে লিথিয়াম-আয়ন ব্যাটারি ব্যবহার করা যন্ত্রগুলির প্রত্যাহার আরও সাধারণ হয়ে উঠেছে। এটি রিপোর্টকৃত দুর্ঘটনা এবং ব্যর্থতা, মাঝে মাঝে জ্বলন বা বিস্ফোরণের প্রতিক্রিয়া হিসাবে ঘটেছে।[৫০][৫১] সমস্যাটির একটি বিশেষজ্ঞ সারসংক্ষেপ নির্দেশ করে যে, এই ধরনের ব্যাটারি "অ্যানোড এবং ক্যাথোডের মধ্যে লিথিয়াম আয়ন পরিবহনে তরল তড়িৎবিশ্লেষ্য পদার্থ ব্যবহার করে। যদি কোনও ব্যাটারি সেল খুব দ্রুত চার্জ করা হয় তবে এটি শর্ট সার্কিটের ঘটাতে পারে, যার ফলে বিস্ফোরণ হতে পারে এবং আগুন লেগে যেতে পারে"। [৫২][৫৩]
ছিদ্র
[সম্পাদনা]
অনেক ব্যাটারির রাসায়নিক পদার্থগুলি ক্ষত সৃষ্টিকারী, বিষাক্ত বা উভয়ই হয়ে থাকে। যদি স্বতঃস্ফূর্তভাবে বা দুর্ঘটনার মাধ্যমে ছিদ্র হয়ে যায়, তাহলে বের হওয়া রাসায়নিকগুলি বিপজ্জনক হতে পারে। উদাহরণস্বরূপ, পরিত্যাজ্য তড়িৎকোষগুলি প্রায়শই বিক্রিয়ক হিসাবে এবং অন্যান্য বিকারকগুলি ধরে রাখার জন্য ধারক হিসাবে একটি দস্তার "ক্যান" ব্যবহার করে। এই ধরনের ব্যাটারি যদি অতিরিক্ত ক্ষরণ হয়, তবে পাত্রটির বাকী অংশ গঠনকারী কার্ডবোর্ড এবং প্লাস্টিকের মধ্য দিয়ে বিকারকগুলি বের হতে পারে। পরে ছিদ্র দিয়ে বের হওয়া সক্রিয় রাসায়নিক পদার্থ ব্যাটারিটি দ্বারা চালিত যন্ত্রগুলির ক্ষতি করতে বা অকেজো করতে পারে। এই কারণে, অনেক ইলেকট্রনিক যন্ত্র নির্মাতারা দীর্ঘ সময় ধরে ব্যবহার করা হবে না এমন যন্ত্রগুলি থেকে ব্যাটারি সরিয়ে রাখার পরামর্শ দেয়।
বিষাক্ত পদার্থসমূহ
[সম্পাদনা]অনেক ধরনের ব্যাটারিতে বিষাক্ত পদার্থ যেমন সীসা, পারদ এবং ক্যাডমিয়ামকে তড়িৎদ্বার বা তড়িৎবিশ্লেষ্য পদার্থ হিসাবে ব্যবহার করা হয়। যখন প্রতিটি ব্যাটারির জীবনকাল শেষ হয়ে যায় তখন পরিবেশের ক্ষতি রোধ করতে তা অবশ্যই পরিত্যাগ বা বর্জন করতে হবে। [৫৪] ব্যাটারি হল একধনের ইলেক্ট্রনিক বর্জ্য (ই-বর্জ্য)। ই-বর্জ্য পুনর্ব্যবহারযোগ্যকরণ পরিষেবাগুলি বিষাক্ত পদার্থগুলি পুনরুদ্ধার করে, যা পরে নতুন ব্যাটারিগুলিতে জন্য ব্যবহার করা যায়। [৫৫] মার্কিন যুক্তরাষ্ট্রে বছরে প্রায় তিন বিলিয়ন ব্যাটারি কেনা হয়, যেগুলির প্রায় ১৭৯,০০০ টন সারা দেশে জুড়ে থাকা ভাগাড়গুলিতে ফেলা হয়। [৫৬] মার্কিন যুক্তরাষ্ট্রে, পারদযুক্ত এবং পুনর্ভরণযোগ্য ব্যাটারি ব্যবস্থাপনা আইন ১৯৯৬ সালে পারদযুক্ত ব্যাটারির বিক্রয় নিষিদ্ধ করেছে, পুনর্ভরণযোগ্য ব্যাটারিগুলির জন্য অভিন্ন লেবেলিংকে আবশ্যিক শর্ত প্রযোজ্য করেছে এবং পুনর্ভরণযোগ্য ব্যাটারিগুলি যাতে সহজে অপসারণযোগ্য হয় সে বিধান চালু করেছে। [৫৭] ক্যালিফোর্নিয়া এবং নিউ ইয়র্ক সিটিতে কঠিন বর্জ্যে পুনর্ভরণযোগ্য ব্যাটারি নিষ্কাশন নিষিদ্ধ করা হয়েছে এবং মেইনের রাজ্যের সাথে সেল ফোনের পুনর্ব্যবহারযোগ্য করার আদেশ দিয়েছে।[৫৮] পুনর্ভরণযোগ্য ব্যাটারি শিল্প প্রতিষ্ঠানগুলি স্থানীয় খুচরা বিক্রেতাদের ড্রপ অফ পয়েন্ট সহ মার্কিন যুক্তরাষ্ট্র এবং কানাডায় দেশব্যাপী পুনর্ব্যবহার প্রোগ্রাম পরিচালনা করে।[৫৮]
ইউরোপীয় ইউনিয়নের ব্যাটারি নির্দেশিকায়ও একই আবশ্যিক শর্ত রয়েছে,পাশাপাশি ব্যাটারিগুলির পুনর্ব্যবহারযোগ্যকরণ বৃদ্ধি এবং ব্যাটারি পুনর্ব্যবহারের উন্নত পদ্ধতিগুলি সম্পর্কে গবেষণা প্রচারের শর্ত রয়েছে। [৫৯] এই নির্দেশনা মেনে ইইউর মধ্যে বিক্রি হওয়া সমস্ত ব্যাটারির গায়ে অবশ্যই "সংগ্রহ প্রতীক" (ক্রস চিহ্নিত চাকাযুক্ত বিন) দিয়ে চিহ্নিত করতে হয়। এটি অবশ্যই প্রিজম্যাটিক ব্যাটারির পৃষ্ঠের কমপক্ষে ৩% এবং নলাকার ব্যাটারির পৃষ্ঠের ১.৫% জুড়ে থাকতে হবে। সমস্ত প্যাকেজিং একইভাবে চিহ্নিত করা আবশ্যক। [৬০]
আহার
[সম্পাদনা]ব্যাটারি গিলে ফেললে তা ক্ষতিকারক বা মারাত্মক হতে পারে।[৬১] ছোট ছোট বাটন সেলগুলি কেউ গিলে ফেলতে পারে, বিশেষত ছোট বাচ্চারা। পরিপাকতন্ত্রে থাকাকালীন, ব্যাটারির বৈদ্যুতিক ক্ষরণ টিস্যুর ক্ষতি করতে পারে;[৬২] এ জাতীয় ক্ষতি মাঝেমধ্যে মারাত্মক এবং মৃত্যুর কারণ হতে পারে। পরিপাক নালিতে আটকে না গেলে সাধারণত আহারকৃত ডিস্ক ব্যাটারিগুলি সমস্যা তৈরি করে না। ডিস্ক ব্যাটারিগুলি আটকে যাওয়ার সবচেয়ে সাধারণ জায়গা হল খাদ্যনালী, যার ফলে ক্লিনিকাল সিকিউলা হয় । সফলভাবে খাদ্যনালী পেরিয়ে যাওয়া ব্যাটারি অন্য কোথাও আটকে থাকার সম্ভাবনা কম। কোন ডিস্ক ব্যাটারি খাদ্যনালীতে প্রবেশের সম্ভাবনা রোগীর বয়স এবং ব্যাটারির আকারের উপর নির্ভর করে। ১৬ মিমি এর ডিস্ক ব্যাটারি ১ বছরের কম বয়সী ২ জন বাচ্চার খাদ্যনালীতে আটকে গিয়েছে।[তথ্যসূত্র প্রয়োজন] বড় বাচ্চাদের ২১-২৩ মিমি এর চেয়ে ছোট ব্যাটারি নিয়ে সমস্যা হয় না। ব্যাটারিটির (সাধারণত অ্যানোডে) তড়িৎপ্রবাহ দ্বারা সোডিয়াম হাইড্রোক্সাইড উৎপাদিত হওয়ার কারণে লিকুইফ্যকশন নেক্রোসিস হতে পারে। আহারের ৬ ঘণ্টা পর ছিদ্র সৃষ্টি হয়ে থাকে। [৬৩]
রসায়ন
[সম্পাদনা]ভোল্টেজ,শক্তি ঘনত্ব, দাহ্যতা, কোষের ব্যবহারযোগ্য গঠনসমূহ, তাপমাত্রার যে পরিসীমায় সক্রিয় থাকে এবং স্থায়িত্বকালের মতো কোষের অনেক গুরুত্বপূর্ণ বৈশিষ্ট্য ব্যাটারির রসায়ন দ্বারা নির্ধারিত হয়।
প্রাথমিক ব্যাটারি এবং তাদের বৈশিষ্ট্য
[সম্পাদনা]| রসায়ন | অ্যানোড (-) | ক্যাথোড (+) | সর্বাধিক ভোল্টেজ, তাত্ত্বিক (V) | নামমাত্র ভোল্টেজ, ব্যবহারিক (V) | নির্দিষ্ট শক্তি (kJ / kg) | বিবরণ | 25 ° সে. এ
স্থায়িত্বকাল, ৮০% ক্ষমতা (মাস) |
|---|---|---|---|---|---|---|---|
| দস্তা–কার্বন | দস্তা(Zn) | মাঙ্গানিজ-ডাই-অক্সাইড(MnO2) | ১.৬ | ১.২ | ১৩০ | সস্তা। | ১৮ |
| দস্তা–ক্লোরাইড | ১.৫ | সস্তা। "হেভি ডিউটি" নামেও পরিচিত। | |||||
| ক্ষারীয় (দস্তা–ম্যাঙ্গানিজ ডাই অক্সাইড) |
দস্তা(Zn) | মাঙ্গানিজ-ডাই-অক্সাইড(MnO2) | ১.৫ | ১.১৫ | ৪০০-৫৯০ | শক্তির ঘনত্ব মাঝারি।উচ্চ এবং নিম্ন ক্ষরণশীল ব্যবহারের জন্য ভাল। | ৩০ |
| নিকেল অক্সিহাইড্রক্সাইড (দস্তা– ম্যাঙ্গানিজ ডাই অক্সাইড / নিকেল অক্সিহাইড্রক্সাইড) |
১.৭ | শক্তির ঘনত্ব মাঝারি ।উচ্চ ক্ষরণশীল ব্যবহারের জন্য ভাল। | |||||
| লিথিয়াম (লিথিয়াম – কপার অক্সাইড) Li–CuO |
লিথিয়াম(Li) | কপার II অক্সাইড(CuO) | ১.৭ | এটি আর তৈরি করা হয় না। সিলভার অক্সাইড ( আইইসি- টাইপ "এসআর") ব্যাটারি দিয়ে এটিকে প্রতিস্থাপিত করা হয়েছে। |
|||
| লিথিয়াম (লিথিয়াম – আয়রন ডাইসালফাইড) LiFeS2 |
লিথিয়াম(Li) | FeS2 | ১.৮ | ১.৫ | ১০৭০ | ব্যয়বহুল।
'প্লাস' বা 'অতিরিক্ত' ব্যাটারিগুলিতে ব্যবহৃত হয়। |
৩৩৭ [৬৪] |
| লিথিয়াম(লিথিয়াম – ম্যাঙ্গানিজ ডাই অক্সাইড) LiMnO 2 |
লিথিয়াম(Li) | মাঙ্গানিজ-ডাই-অক্সাইড(MnO2) | ৩.০ | ৮৩০-১০১০ | ব্যয়বহুল।সেলফ ক্ষরণের হার খুব কম হওয়ার কারণে কেবলমাত্র উচ্চ-ক্ষরণশীল যন্ত্রে বা দীর্ঘ কার্যকরী জীবনকালের জন্য ব্যবহৃত হয়।'লিথিয়াম 'একাই সাধারণত এই ধরনের রসায়নের সাথে সম্পর্কযুক্ত। | ||
| লিথিয়াম (লিথিয়াম – কার্বন ফ্লোরাইড) Li–(CF)n |
লিথিয়াম(Li) | (CF)n | ৩.৬ | ৩.০ | ১২০ | ||
| লিথিয়াম (লিথিয়াম – ক্রোমিয়াম অক্সাইড) Li–CrO2 |
লিথিয়াম(Li) | CrO2 | ৩.৮ | ৩.০ | ১০৮ | ||
| লিথিয়াম
(লিথিয়াম-সিলিকন ) |
Li22Si5 | ||||||
| মার্কারি অক্সাইড | দস্তা(Zn) | HgO | ১.৩৪ | ১.২ | উচ্চ-ক্ষরণশীল এবং অপরিবর্তনীয় ভোল্টেজ।বেশিরভাগ দেশে স্বাস্থ্যগত ঝুঁকির কারণে এটি নিষিদ্ধ। | 36 | |
| দস্তা-এয়ার | দস্তা(Zn) | O2 | ১.৬ | ১.১ | ১৫৯০ [৬৫] | বেশিরভাগ ক্ষেত্রে শ্রবণ সহায়ক যন্ত্রগুলিতে ব্যবহৃত হয়। | |
| জাম্বনি পাইল | দস্তা(Zn) | Ag অথবা Au | ০.৮ | খুব দীর্ঘ জীবনকাল।খুবই কম (ন্যানো অ্যাম্পিয়ার, nA) প্রবাহ। | > ২ হাজার | ||
| সিলভার-অক্সাইড (সিলভার-দস্তা) | দস্তা(Zn) | Ag2O | ১.৮৫ | ১.৫ | ৪৭০ | খুবই মূল্যবান।কেবলমাত্র 'বাটন' সেলে বাণিজ্যিকভাবে ব্যবহৃত হয়। | ৩০ |
| ম্যাগনেসিয়াম | ম্যাগনেসিয়াম(Mg) | মাঙ্গানিজ-ডাই-অক্সাইড(MnO2) | ২.০ | ১.৫ | ৪০ |
গৌণ (পুনর্ভরণযোগ্য) ব্যাটারি এবং তাদের বৈশিষ্ট্য
[সম্পাদনা]| রসায়ন | কোষের ভোল্টেজ |
নির্দিষ্ট শক্তি (kJ / kg) | শক্তি ঘনত্ব (kJ / liter) |
মন্তব্য |
|---|---|---|---|---|
| নিকেল-ক্যাডমিয়াম(NiCd) | ১.২ | ১৪০ | নিকেল–ক্যাডমিয়ামের রসায়ন।সস্তা।উচ্চ- / নিম্ন-ক্ষরণশীল,শক্তি ঘনত্ব মাঝারি ।কার্যক্ষমতার কোনও ক্ষয় না করে অনেক বেশি ক্ষরণের হার সহ্য করতে পারে।স্বতক্ষরণের হার মাঝারি।ক্যাডমিয়ামের কারণে এটি পরিবেশগত বিপত্তির কারণ - এখন এটির ব্যবহার ইউরোপে কার্যত নিষিদ্ধ। | |
| লেড এসিড | ২.১ | ১৪০ | মাঝারিভাবে ব্যয়বহুল।শক্তির ঘনত্ব মাঝারি ।স্বতক্ষরণের হার মাঝারি । উচ্চ ক্ষরণের হারের ফলে যথেষ্ট পরিমাণের ক্ষয়ক্ষতি ঘটে।সীসা থাকার কারণে পরিবেশগত বিপত্তি ঘটে।মোটরগাড়ির ব্যাটারি হিসেবে এর সাধারণ ব্যবহার রয়েছে। | |
| নিকেল ধাতব হাইড্রাইড(NiMH) | ১.২ | ৩৬০ | নিকেল–ধাতব হাইড্রাইডের রসায়ন।সস্তা।উচ্চ ক্ষরণশীল যন্ত্রগুলিতে ক্ষারীয় ব্যাটারির চেয়ে ভাল কাজ করে।প্রচলিত রসায়নে উচ্চ শক্তি ঘনত্ব আছে, কিন্তু স্বতক্ষরণের উচ্চ হারও রয়েছে।অপেক্ষাকৃত নতুন রসায়নটিতে স্বতক্ষরণের হার কম, তবে ~ ২৫% কম শক্তি ঘনত্বও রয়েছে।কিছু গাড়িতে এটি ব্যবহৃত হয়। | |
| নিকেল-দস্তা(NiZn) | ১.৬ | ৩৬০ | নিকেল-দস্তাের রসায়ন। মাঝারিভাবে সস্তা।উচ্চ ক্ষরণশীল যন্ত্রের জন্য উপযুক্ত। স্বতক্ষরণের হার কম।এটিতে অন্যান্য গৌণ কোষের তুলনায় ক্ষারীয় প্রাথমিক কোষগুলির প্রায় সমান ভোল্টেজ থাকে।কোনও বিষাক্ত উপাদান নেই।নতুনভাবে বাজারে প্রবর্তন করা হয়েছে (২০০৯)। এখনও এটির ট্র্যাক রেকর্ড প্রতিষ্ঠিত হয়নি। প্রাপ্যতার আকার সীমিত। | |
| সিলভার দস্তা(AgZn) | ১.৮৬ ১.৫ |
৪৬০ | রৌপ্য-দস্তার রসায়ন। সমতুল্য লিথিয়াম-আয়ন থেকে আয়তনে ছোট ।রূপার ব্যবহারের কারণে অত্যন্ত ব্যয়বহুল। শক্তি ঘনত্ব খুব উচ্চ।খুব উচ্চ ক্ষরণ সক্ষম। রুপোর উচ্চ দামের কারণে বহু বছর ধরে অপ্রচলিত হিসেবে বিবেচিত।অব্যবহৃত থাকলে এর কোষগুলি জারণ এর মাধ্যমে ক্ষতিগ্রস্ত হয়। বিক্রিয়াগুলি পুরোপুরি বোঝা যায় না।টার্মিনাল ভোল্টেজ খুব স্থিতিশীল তবে হঠাৎ ৭০-৮০% চার্জে ১.৫ ভোল্টে নেমে আসে (ধনাত্মক প্লেটে আরজেন্টাস এবং আরজেন্টিক অক্সাইড উভয়ের উপস্থিতির কারণে - একটি প্রথমে ক্ষয়প্রাপ্ত হয় বলে বিশ্বাস করা হয়)।প্রাথমিক ব্যাটারির (মুন বাগি) পরিবর্তে ব্যবহার করা হয়েছে। লিথিয়াম -আয়নের প্রতিস্থাপক হিসাবে আবারও এটিকে উন্নয়ন করা হচ্ছে। | |
| লিথিয়াম-আয়রন-ফসফেট(LiFePO4) | ৩.৩ ৩.০ |
৩৬০ | ৭৯০ | লিথিয়াম-আয়রন-ফসফেটের রসায়ন। |
| লিথিয়াম আয়ন | ৩.৬ | ৪৬০ | লিথিয়ামের বিভিন্ন রসায়ন। খুবই মূল্যবান। শক্তি ঘনত্ব খুব উচ্চ।সাধারণত "প্রচলিত" ব্যাটারির আকারে পাওয়া যায় না। লিথিয়াম পলিমার ব্যাটারি ল্যাপটপ কম্পিউটার, ডিজিটাল ক্যামেরা, ক্যামকর্ডার এবং সেলফোনগুলিতে প্রচলিত।স্বতক্ষরণের হার খুব কম। টার্মিনাল ভোল্টেজ ক্ষরণের সময় ৪.২ থেকে ৩.০ ভোল্টের মধ্যে পরিবর্তিত হয়। |
কঠিন অবস্থার তড়িৎকোষ
[সম্পাদনা]২৮ ফেব্রুয়ারি, ২০১৭ তে, অস্টিনের টেক্সাস বিশ্ববিদ্যালয় লিথিয়াম-আয়ন ব্যাটারির উদ্ভাবক জন গুডএনাফের নেতৃত্বে একটি দল কর্তৃক তৈরি একটি নতুন ধরনের কঠিন অবস্থার তড়িৎকোষ সম্পর্কে একটি প্রেস বিজ্ঞপ্তি ইস্যু করে, "এটি নিরাপদ, দ্রুত চার্জ হতে পারে, হাতে ধরা মোবাইল যন্ত্র, বৈদ্যুতিক গাড়ি এবং নিশ্চল শক্তি সঞ্চয়স্থানের জন্য দীর্ঘস্থায়ী পুনর্ভরণযোগ্য ব্যাটারি "। [৬৬] সমকক্ষ ব্যক্তি-পর্যালোচিত বিজ্ঞান ভিত্তিক জার্নাল এনার্জি এন্ড এনভায়রনমেন্টাল সায়েন্সে এই নতুন প্রযুক্তি সম্পর্কে আরও বৈশিষ্ট্য প্রকাশিত হয়েছিল।
এই প্রযুক্তিটির স্বতন্ত্র পর্যালোচনাগুলিতে নির্দিষ্ট পরিস্থিতিতে লিথিয়াম-আয়ন ব্যাটারি থেকে আগুন জ্বলা ও বিস্ফোরণ ঘটার ঝুঁকি নিয়ে আলোচনা করা হয় কারণ সেগুলিতে তরল তড়িৎবিশ্লেষ্য পদার্থ ব্যবহার করা হয়। নতুনভাবে বিকশিত হওয়া ব্যাটারি বেশি নিরাপদ হয়ে থাকে কারণ সেটিতে কাচের তড়িৎবিশ্লেষ্য পদার্থ ব্যবহার করা হয় যা শর্ট সার্কিট কমিয়ে দেয়। এটাও বলা হয় যে কঠিন অবস্থার ব্যাটারি "তিনগুণ শক্তির ঘনত্ব" সম্পন্ন, উদাহরণস্বরূপ বৈদ্যুতিক যানগুলিতে এটির কার্যকরী জীবন বৃদ্ধি পাওয়া। এটি পরিবেশগত দিক থেকে আরও বেশি নিরাপদ হয়ে থাকে কারণ এই প্রযুক্তিটিতে কম ব্যয়বহুল, পৃথিবী-বান্ধব উপকরণ যেমন সমুদ্রের জল থেকে প্রাপ্ত সোডিয়াম ব্যবহার করা হয়। এগুলির জীবনকালও দীর্ঘ হয়ে থাকে; " এই কোষগুলি কম কোষ রোধ সহ ১,২০০ এরও বেশি চক্র প্রদর্শন করেছে"। লাক্স রিসার্চের ক্রিস রবিনসনের মতে, গবেষণা এবং প্রোটোটাইপগুলি অদূর ভবিষ্যতে বাণিজ্যিকভাবে ব্যবহারযোগ্য পণ্য হিসেবে নিয়ে আসা যাবে আশা করা যায় না। "পরবর্তী ১৫ বছরের মধ্যে বৈদ্যুতিক যানবাহন গ্রহণের ক্ষেত্রে এর কোনও স্পষ্ট প্রভাব থাকবে না, যদি তা আদৌ হয়। তিনি আমেরিকান এনার্জি নিউজকে একটি ই-মেইলে জানিয়েছেন,"বেশিরভাগ কঠিন অবস্থার তড়িৎবিশ্লেষ্য পদার্থ যে বাঁধার মুখোমুখি হয় সেটি হল একটি পরিমাপযোগ্য এবং সাশ্রয়ী উৎপাদন প্রক্রিয়ার অভাব।" [৬৭]
ঘরে তৈরি তড়িৎকোষ
[সম্পাদনা]বৈদ্যুতিকভাবে পরিবাহী হওয়ার জন্য পর্যাপ্ত আয়ন রয়েছে এমন প্রায় যেকোন তরল বা আর্দ্র বস্তু একটি কোষের জন্য তড়িৎবিশ্লেষ্য পদার্থ হিসাবে কাজ করতে পারে। অভিনবত্ব বা বৈজ্ঞানিক প্রদর্শন হিসাবে, আলাদা ধাতব পদার্থ দ্বারা তৈরি দুটি ইলেক্ট্রোড একটি লেবু,[৬৮] আলু [৬৯] ইত্যাদিতে প্রবেশ করিয়ে স্বল্প পরিমাণে বিদ্যুৎ উৎপাদন করা সম্ভব। শখের জিনিসপত্র এবং খেলনার দোকানগুলিতেও অনেক "দুই-আলুর ঘড়ি" পাওয়া যায়; এগুলিতে এক জোড়া কোষ থাকে, যার প্রতিটিতে একটি আলু (লেবু, ইত্যাদি) থাকে যার মধ্যে দুটি তড়িৎদ্বার প্রবেশ করানো থাকে, এগুলি সিরিজে যুক্ত থেকে একটি ডিজিটাল ঘড়ি চালানোর জন্য পর্যাপ্ত ভোল্টেজ সম্পন্ন একটি ব্যাটারি তৈরি করে। [৭০] এই জাতীয় ঘরে তৈরি কোষগুলির বাস্তবিক ব্যবহার নেই।
দুটি মুদ্রা (যেমন নিকেল এবং একটি পয়সা ) এবং লবণাক্ত জলে ডুবানো এক টুকরো কাগজের তোয়ালে দিয়ে একটি ভোল্টাইক পাইল তৈরি করা যেতে পারে। এই ধরনের পাইল খুব কম ভোল্টেজ উৎপন্ন করে তবে অনেকগুলিকে যখন সিরিজে যুক্ত করা হয়, তখন সেগুলি খুব অল্প সময়ের জন্য সাধারণ ব্যাটারিকে প্রতিস্থাপন করার মতো হয়ে ওঠে। [৭১]
সনি একটি জৈব ব্যাটারি তৈরি করেছে যা চিনির মাধ্যমে এমনভাবে বিদ্যুত উৎপাদন করে যা জীবিত প্রাণীদের মধ্যে পর্যবেক্ষণকৃত প্রক্রিয়ার অনুরূপ। এই ব্যাটারিটি কার্বোহাইড্রেট ভেঙে থাকে এমন এনজাইমগুলি ব্যবহার করে বিদ্যুৎ উৎপাদন করে। [৭২]
সীসা অ্যাসিড কোষ বাড়িতে সহজেই তৈরি করা যায় তবে এর পাতগুলি 'গঠন' করার জন্য একটি একটানা চার্জ / ক্ষরণ সাইকেল প্রয়োজন হয়। এটি এমন একটি প্রক্রিয়া যার মধ্যে পাতগুলি উপর লেড সালফেট গঠিত হয় এবং চার্জের সময় লেড ডাই অক্সাইড (ধনাত্মক পাত) এবং বিশুদ্ধ (নেতিবাচক পাত) এ রূপান্তরিত হয়। এই প্রক্রিয়াটির পুনরাবৃত্তি করার ফলে পৃষ্ঠের ক্ষেত্রফল বৃদ্ধি পেয়ে,কোষটি সরবরাহ করতে পারে এমন তড়িৎপ্রবাহের বৃদ্ধি ঘটে অণুবীক্ষণিকভাবে রুক্ষ একটি পৃষ্ঠের তৈরি হয়। [৭৩]
ড্যানিয়েল কোষ ঘরে তৈরি করা সহজ। অ্যালুমিনিয়াম–এয়ার ব্যাটারি উচ্চ বিশুদ্ধ অ্যালুমিনিয়াম ফয়েল দিয়ে তৈরি করা যেতে পারে। অ্যালুমিনিয়াম ফয়েল ব্যাটারি কিছুটা বিদ্যুৎ উৎপাদন করতে পারে, তবে তা কার্যকর নয়, কারণ কিছু পরিমাণে (জ্বলনযোগ্য) হাইড্রোজেন গ্যাস উৎপাদিত হয়।
আরও দেখুন
[সম্পাদনা]- তড়িৎ প্রবাহ
- ব্যাটারির ইতিহাস
- ব্যাটারিচালিত বৈদ্যুতিক যানবাহন
- তড়িৎ-রসায়ন
- তড়িৎ ও ইলেক্ট্রনিক প্রকৌশল
- তড়িৎবিশ্লেষ্য
- তড়িৎ
- তড়িৎ বিভব
- লেড এসিড ব্যাটারি
- তড়িৎ ক্ষেত্র
- ক্যাটায়ন
- অ্যানায়ন
- ইলেক্ট্রনিক্স
- তড়িৎ বর্তনী
- বিদ্যুৎ উৎপাদন কেন্দ্র
- বিদ্যুৎ শক্তি উৎপাদন
- ইলেক্ট্রনিক্স প্রকৌশল
তথ্যসূত্র
[সম্পাদনা]- ↑ Crompton, T. R. (২০০০-০৩-২০)। Battery Reference Book (third সংস্করণ)। Newnes। পৃষ্ঠা Glossary 3। আইএসবিএন 978-0-08-049995-6। সংগ্রহের তারিখ ২০১৬-০৩-১৮।
- ↑ Pauling, Linus (১৯৮৮)। "15: Oxidation-Reduction Reactions; Electrolysis"। General Chemistry। Dover Publications, Inc.। পৃষ্ঠা 539। আইএসবিএন 978-0-486-65622-9।
- ↑ ক খ Schmidt-Rohr, Klaus (২০১৮)। "How Batteries Store and Release Energy: Explaining Basic Electrochemistry": 1801–1810। ডিওআই:10.1021/acs.jchemed.8b00479
 ।
।
- ↑ Pistoia, Gianfranco (২০০৫-০১-২৫)। Batteries for Portable Devices। Elsevier। পৃষ্ঠা 1। আইএসবিএন 978-0-08-045556-3। সংগ্রহের তারিখ ২০১৬-০৩-১৮।
- ↑ National Geographic Society। "Quiz: What You Don't Know About Batteries"। National Geographic।
- ↑ Stinner, Arthur. Alessandro Volta and Luigi Galvani ওয়েব্যাক মেশিনে আর্কাইভকৃত ১০ সেপ্টেম্বর ২০০৮ তারিখে (PDF). Retrieved 11 August 2008.
- ↑ Electric Battery History – Invention of the Electric Battery ওয়েব্যাক মেশিনে আর্কাইভকৃত ২২ ফেব্রুয়ারি ২০১৯ তারিখে. The Great Idea Finder. Retrieved 11 August 2008.
- ↑ Battery History, Technology, Applications and Development ওয়েব্যাক মেশিনে আর্কাইভকৃত ১২ মে ২০১১ তারিখে. MPower Solutions Ltd. Retrieved 19 March 2007.
- ↑ Borvon, Gérard (১০ সেপ্টেম্বর ২০১২)। "History of the electrical units"। Association S-EAU-S।
- ↑ "Columbia Dry Cell Battery"। National Historic Chemical Landmarks। American Chemical Society। ২৩ ফেব্রুয়ারি ২০১৩ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২৫ মার্চ ২০১৩।
- ↑ Ashcroft, N.W.; Mermin (১৯৭৬)। Solid State Physics। N.D.। Brooks/Cole।
- ↑ Dingrando 665.
- ↑ Saslow 338.
- ↑ Dingrando 666.
- ↑ Knight 943.
- ↑ Knight 976.
- ↑ Terminal Voltage – Tiscali Reference ওয়েব্যাক মেশিনে আর্কাইভকৃত ১১ এপ্রিল ২০০৮ তারিখে. Originally from Hutchinson Encyclopaedia. Retrieved 7 April 2007.
- ↑ Dingrando 674.
- ↑ Dingrando 677.
- ↑ Dingrando 675.
- ↑ Fink, Ch. 11, Sec. "Batteries and Fuel Cells."
- ↑ Franklin Leonard Pope, Modern Practice of the Electric Telegraph 15th Edition, D. Van Nostrand Company, New York, 1899, pp. 7–11. Available on the Internet Archive
- ↑ ক খ Duracell: Battery Care. Retrieved 10 August 2008.
- ↑ ক খ Alkaline Manganese Dioxide Handbook and Application Manual ওয়েব্যাক মেশিনে আর্কাইভকৃত ১৬ ডিসেম্বর ২০১০ তারিখে (PDF). Energizer. Retrieved 25 August 2008.
- ↑ Dynasty VRLA Batteries and Their Application ওয়েব্যাক মেশিনে আর্কাইভকৃত ৬ ফেব্রুয়ারি ২০০৯ তারিখে. C&D Technologies, Inc. Retrieved 26 August 2008.
- ↑ USBCELL – Revolutionary rechargeable USB battery that can charge from any USB port. Retrieved 6 November 2007.
- ↑ "Spotlight on Photovoltaics & Fuel Cells: A Web-based Study & Comparison" (পিডিএফ)। পৃষ্ঠা 1–2। সংগ্রহের তারিখ ১৪ মার্চ ২০০৭।
- ↑ ক খ Battery Knowledge – AA Portable Power Corp. Retrieved 16 April 2007. ওয়েব্যাক মেশিনে আর্কাইভকৃত ২৩ মে ২০০৭ তারিখে
- ↑ "Battery Capacity"। techlib.com।
- ↑ A Guide to Understanding Battery Specifications, MIT Electric Vehicle Team, December 2008
- ↑ Kang, B.; Ceder, G. (২০০৯)। "Battery materials for ultrafast charging and discharging": 190–193। ডিওআই:10.1038/nature07853। পিএমআইডি 19279634। 1:00–6:50 (audio) ওয়েব্যাক মেশিনে আর্কাইভকৃত ২০১২-০২-২২ তারিখে
- ↑ "Elon Musk wins $50m bet with giant battery for South Australia"। Sky News। ২৪ নভেম্বর ২০১৭। সংগ্রহের তারিখ ২০ সেপ্টেম্বর ২০১৮।
- ↑ Dillow, Clay (২১ ডিসেম্বর ২০১২)। "China Builds the World's Largest Battery, a Building-Sized, 36-Megawatt-Hour Behemoth | Popular Science"। Popsci.com। সংগ্রহের তারিখ ৩১ জুলাই ২০১৩।
- ↑ Conway, E. (2 September 2008) "World's biggest battery switched on in Alaska" আর্কাইভইজে আর্কাইভকৃত ২৩ ডিসেম্বর ২০১২ তারিখে Telegraph.co.uk
- ↑ Biello, D. (22 December 2008) "Storing the Breeze: New Battery Might Make Wind Power More Reliable" Scientific American
- ↑ "Auwahi Wind | Energy Solutions | Sempra U.S. Gas & Power, LLC"। Semprausgp.com। ২ মে ২০১৪ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ৩১ জুলাই ২০১৩।
- ↑ Amos, J. (24 August 2008) "Solar plane makes record flight" BBC News
- ↑ Self discharge of batteries – Corrosion Doctors. Retrieved 9 September 2007.
- ↑ Energizer Rechargeable Batteries and Chargers: Frequently Asked Questions ওয়েব্যাক মেশিনে আর্কাইভকৃত ৯ ফেব্রুয়ারি ২০০৯ তারিখে. Energizer. Retrieved 3 February 2009.
- ↑ [১] ওয়েব্যাক মেশিনে আর্কাইভকৃত ২ ফেব্রুয়ারি ২০১০ তারিখে
- ↑ ক খ Rechargeable battery Tips – NIMH Technology Information. Retrieved 10 August 2007. ওয়েব্যাক মেশিনে আর্কাইভকৃত ৮ আগস্ট ২০০৭ তারিখে
- ↑ battery myths vs battery facts – free information to help you learn the difference. Retrieved 10 August 2007.
- ↑ Filip M. Gieszczykiewicz। "Sci.Electronics FAQ: More Battery Info"। repairfaq.org।
- ↑ RechargheableBatteryInfo.com, সম্পাদক (২৮ অক্টোবর ২০০৫), What does 'memory effect' mean?, ১৫ জুলাই ২০০৭ তারিখে মূল থেকে আর্কাইভ করা, সংগ্রহের তারিখ ১০ আগস্ট ২০০৭
- ↑ Rich, Vincent (1994). The International Lead Trade. Cambridge: Woodhead. 129.
- ↑ Deep Cycle Battery FAQ ওয়েব্যাক মেশিনে আর্কাইভকৃত ২২ জুলাই ২০১০ তারিখে. Northern Arizona Wind & Sun. Retrieved 3 February 2009.
- ↑ Car and Deep Cycle Battery FAQ ওয়েব্যাক মেশিনে আর্কাইভকৃত ৬ নভেম্বর ২০২০ তারিখে. Rainbow Power Company. Retrieved 3 February 2009.
- ↑ Deep cycle battery guide ওয়েব্যাক মেশিনে আর্কাইভকৃত ১৭ ফেব্রুয়ারি ২০০৯ তারিখে. Energy Matters. Retrieved 3 February 2009.
- ↑ Ask Yahoo: Does putting batteries in the freezer make them last longer? ওয়েব্যাক মেশিনে আর্কাইভকৃত ২৭ এপ্রিল ২০০৬ তারিখে. Retrieved 7 March 2007.
- ↑ Schweber, Bill (আগস্ট ৪, ২০১৫)। "Lithium Batteries: The Pros and Cons"। GlobalSpec। GlobalSpec। সংগ্রহের তারিখ মার্চ ১৫, ২০১৭।
- ↑ Fowler, Suzanne (২১ সেপ্টেম্বর ২০১৬)। "Samsung's Recall – The Problem with Lithium Ion Batteries"। The New York Times। New York। সংগ্রহের তারিখ ১৫ মার্চ ২০১৬।
- ↑ Hislop, Martin (১ মার্চ ২০১৭)। "Solid-state EV battery breakthrough from Li-ion battery inventor John Goodenough"। North American Energy News। The American Energy News.। সংগ্রহের তারিখ ১৫ মার্চ ২০১৭।
- ↑ "battery hazards"। YouTube। সংগ্রহের তারিখ ২০ সেপ্টেম্বর ২০১৮।
- ↑ Batteries – Product Stewardship ওয়েব্যাক মেশিনে আর্কাইভকৃত ২৯ সেপ্টেম্বর ২০০৬ তারিখে. EPA. Retrieved 11 September 2007.
- ↑ Battery Recycling » Earth 911 ওয়েব্যাক মেশিনে আর্কাইভকৃত ১২ অক্টোবর ২০০৮ তারিখে. Retrieved 9 September 2007.
- ↑ "San Francisco Supervisor Takes Aim at Toxic Battery Waste". Environmental News Network (11 July 2001).
- ↑ "Mercury-Containing and Rechargeable Battery Management Act" (পিডিএফ)। EPA। সংগ্রহের তারিখ ১৫ ফেব্রুয়ারি ২০২১।
- ↑ ক খ [২][স্থায়ীভাবে অকার্যকর সংযোগ]
- ↑ Disposal of spent batteries and accumulators. European Union. Retrieved 27 July 2009.
- ↑ Guidelines on Portable Batteries Marking Requirements in the European Union 2008 – EPBA-EU ওয়েব্যাক মেশিনে আর্কাইভকৃত ৭ অক্টোবর ২০১১ তারিখে
- ↑ Product Safety DataSheet – Energizer ওয়েব্যাক মেশিনে আর্কাইভকৃত ২৭ সেপ্টেম্বর ২০০৭ তারিখে (p. 2). Retrieved 9 September 2007.
- ↑ "Swallowed a Button Battery? | Battery in the Nose or Ear?"। Poison.org। ৩ মার্চ ২০১০। ১৬ আগস্ট ২০১৩ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২৬ জুলাই ২০১৩।
- ↑ "Disk Battery Ingestion: Background, Pathophysiology, Epidemiology"। ২০১৬-০৬-০৯ – eMedicine-এর মাধ্যমে।
- ↑ "Lithium Iron Disulfide Handbook and Application Manual" (পিডিএফ)। energizer.com। ১৭ মার্চ ২০০৬ তারিখে মূল (পিডিএফ) থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২০ সেপ্টেম্বর ২০১৮।
- ↑ Excludes the mass of the air oxidizer.
- ↑ "Lithium-Ion Battery Inventor Introduces New Technology for Fast-Charging, Noncombustible Batteries"। University of Texas at Austin। University of Texas। ২৮ ফেব্রুয়ারি ২০১৭। সংগ্রহের তারিখ ১৫ মার্চ ২০১৭।
...first all-solid-state battery cells that could lead to safer, faster-charging, longer-lasting rechargeable batteries for handheld mobile devices, electric cars and stationary energy storage.
- ↑
Hislop, Martin (১ মার্চ ২০১৭)। "Solid-state EV battery breakthrough from Li-ion battery inventor John Goodenough"। North American Energy News। The American Energy News.। সংগ্রহের তারিখ ১৫ মার্চ ২০১৭।
But even John Goodenough’s work doesn’t change my forecast that EVs will take at least 50 years to reach 70 to 80 percent of the global vehicle market.
- ↑ ushistory.org: The Lemon Battery. Accessed 10 April 2007.
- ↑ ZOOM activities: phenom Potato Battery. Accessed 10 April 2007.
- ↑ Two-Potato Clock – Science Kit and Boreal Laboratories[স্থায়ীভাবে অকার্যকর সংযোগ]. Accessed 10 April 2007.
- ↑ Howstuffworks "Battery Experiments: Voltaic Pile". Accessed 10 April 2007.
- ↑ Sony Develops A Bio Battery Powered By Sugar ওয়েব্যাক মেশিনে আর্কাইভকৃত ১১ অক্টোবর ২০০৭ তারিখে. Accessed 24 August 2007.
- ↑ "Home made lead acid batteries"। Windpower.org.za। ১৬ সেপ্টেম্বর ২০০৭। ৩১ জুলাই ২০১৩ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২৬ জুলাই ২০১৩।
আরও পড়ুন
[সম্পাদনা]- Dingrando, Laurel (২০০৭)। Chemistry: Matter and Change। Glencoe/McGraw-Hill। আইএসবিএন 978-0-07-877237-5। Ch. 21 (pp. 662–695) is on electrochemistry.
- Fink, Donald G.; H. Wayne Beaty (১৯৭৮)। Standard Handbook for Electrical Engineers, Eleventh Edition। McGraw-Hill। আইএসবিএন 978-0-07-020974-9।
- Knight, Randall D. (২০০৪)। Physics for Scientists and Engineers: A Strategic Approach। Pearson Education। আইএসবিএন 978-0-8053-8960-9। Chs. 28–31 (pp. 879–995) contain information on electric potential.
- Linden, David; Thomas B. Reddy (২০০১)। Handbook of Batteries। McGraw-Hill। আইএসবিএন 978-0-07-135978-8।
- Saslow, Wayne M. (২০০২)। Electricity, Magnetism, and Light। Thomson Learning। আইএসবিএন 978-0-12-619455-5। Chs. 8–9 (pp. 336–418) have more information on batteries.
বহিঃসংযোগ
[সম্পাদনা]- কার্লিতে Batteries (ইংরেজি)
- নন-রিচার্জেবল ব্যাটারি
- হাউস্টফ ওয়ার্কস: ব্যাটারি কীভাবে কাজ করে
- অন্যান্য ব্যাটারি সেল প্রকার
- DoITPoMS টিচিং এবং লার্নিং প্যাকেজ- "ব্যাটারি"
- The Physics arXiv Blog (১৭ আগস্ট ২০১৩)। "First Atomic Level Simulation of a Whole Battery | MIT Technology Review"। Technologyreview.com। সংগ্রহের তারিখ ২১ আগস্ট ২০১৩।












