পর্যায় সারণি

পর্যায় সারণি (Periodic table), যা মৌলের পর্যায় সারণি নামেও পরিচিত, রসায়নের একটি অত্যন্ত গুরুত্বপূর্ণ উপাদান। এই সারণীতে রাসায়নিক মৌলগুলোকে সুবিন্যস্তভাবে সারি ("পর্যায়") এবং কলাম ("গ্রুপ") আকারে সাজানো থাকে। বিজ্ঞানের অঙ্গনে, বিশেষ করে রসায়ন এবং পদার্থবিদ্যায় এর ব্যাপক ব্যবহার লক্ষ্য করা যায়। পর্যায় আইনের একটি চিত্ররূপ হচ্ছে এই পর্যায় সারণী। এই আইনে বলা হয়, মৌলসমূহকে যদি পারমাণবিক সংখ্যা অনুসারে সাজানো হয়, তবে তাদের বৈশিষ্ট্যের মধ্যে একধরনের নিয়মিত পুনরাবৃত্তি লক্ষ্য করা যায়। সারণিতে চারটি আয়তাকার অঞ্চল রয়েছে যেগুলোকে ব্লক বলা হয়। একই গ্রুপের মৌলগুলো একই রকম রাসায়নিক বৈশিষ্ট্য প্রদর্শন করে।
পর্যায় সারণির উল্লম্ব, অনুভূমিক এবং তির্যক রেখা বরাবর কিছু নির্দিষ্ট প্রবণতা লক্ষ্য করা যায়। একটি গ্রুপে নিচে নামার সাথে সাথে ধাতব বৈশিষ্ট্য বৃদ্ধি পায় এবং একটি পর্যায়ে বাম থেকে ডান দিকে যাওয়ার সাথে তা হ্রাস পায়। আবার, পর্যায় সারণির নিচের বাম থেকে উপরের ডান দিকে যাওয়ার সাথে অধাতব বৈশিষ্ট্য বৃদ্ধি পায়।
রাশিয়ান রসায়নবিদ দিমিত্রি মেন্ডেলেভ ১৮৬৯ সালে সর্বপ্রথম সর্বজনীনভাবে গৃহীত পর্যায় সারণিটি প্রণয়ন করেন। তিনি পারমাণবিক ভরের ওপর ভিত্তি করে রাসায়নিক বৈশিষ্ট্য সম্পর্কিত পর্যায় সারণিটি তৈরি করেন। যেহেতু সেসময় সকল মৌল আবিষ্কৃত হয়নি, তাই তার পর্যায় সারণিতে কিছু ফাঁকা জায়গা ছিল। তবে আশ্চর্যজনকভাবে মেন্ডেলেভ এই পর্যায় সারণি কাজে লাগিয়ে কয়েকটি অনুপস্থিত মৌলের বৈশিষ্ট্য সম্পর্কে ভবিষ্যদ্বাণী করেন। ১৯ শতকের শেষের দিকে পর্যায় সারণিকে মৌলিক আবিষ্কার হিসেবে স্বীকৃতি দেওয়া হয়, এবং বিংশ শতাব্দীর শুরুর দিকে পারমাণবিক সংখ্যা এবং কোয়ান্টাম মেকানিক্সের সাহায্যে এর ব্যাখ্যা সম্ভব হয়। ১৯৪৫ সালে গ্লেন টি. সিবোর্গের অ্যাক্টিনাইড মৌলগুলোর আবিষ্কারের পর এগুলোকে f-ব্লকের অন্তর্ভুক্ত করা হয়, যার ফলে পর্যায় সারণী তার আধুনিক রূপটি পায়। পর্যায় সারণী এবং পর্যায় আইন বর্তমানে আধুনিক রসায়নের একটি কেন্দ্রীয় এবং অপরিহার্য অংশ।
প্রকৃতিতে ৯৪ পারমাণবিক সংখ্যা পর্যন্ত মৌলের অস্তিত্ব পাওয়া যায়। এর চেয়ে বেশি পারমাণবিক সংখ্যার মৌলগুলোকে গবেষণাগারে কৃত্রিমভাবে তৈরি করা হয়েছে। আজ, ১১৮ পর্যন্ত সমস্ত মৌল আবিষ্কৃত হয়েছে যা সারণীর প্রথম সাতটি সারি পূর্ণ করে। তবে, সবচেয়ে ভারী মৌলগুলোর কিছু রাসায়নিক বৈশিষ্ট্য পরীক্ষামূলকভাবে যাচাই করা এখনো বাকি। পর্যায় সারণী যে সাতটি সারি নিয়ে শেষ হবে না, তা নিয়ে অনেকের ধারণা রয়েছে। তবে, তত্ত্ব অনুযায়ী সারণী কতদূর বিস্তৃত হবে তা এখনো জানা যায়নি। আবার, বৈজ্ঞানিক আলোচনায় আজও পর্যায় সারণীতে কিছু মৌলের সঠিক অবস্থান নিয়ে বিতর্ক রয়েছে। পর্যায় আইনের অনেকগুলো বিকল্প রূপ রয়েছে, এবং পর্যায় সারণীর কোনো সর্বোত্তম রূপ আছে কিনা তা নিয়ে কিছু আলোচনা রয়েছে।
বিবরণ
[সম্পাদনা]প্রত্যেকটি মৌলিক পদার্থের একটি অনন্য পারমাণবিক সংখ্যা (Z) রয়েছে যা এর নিউক্লিয়াসে প্রোটনের সংখ্যা নির্দেশ করে।[৩] সব মৌলেরই একাধিক আইসোটোপ আছে। আইসোটোপের প্রোটনের সংখ্যা একই, কিন্তু নিউট্রনের সংখ্যা ভিন্ন। উদাহরণস্বরূপ, কার্বনের তিনটি প্রাকৃতিকভাবে সংঘটিত আইসোটোপ রয়েছে। এর সমস্ত পরমাণুর ছয়টি প্রোটন থাকে এবং বেশিরভাগ পরমাণুতে ছয়টি নিউট্রনও থাকে। কিন্তু প্রায় এক শতাংশের সাতটি নিউট্রন থাকে এবং খুব অল্প সংখ্যক পরমাণুতে আটটি নিউট্রন থাকে। আইসোটোপ কখনই পর্যায় সারণীতে আলাদা হয় না; অনেক আইসোটোপকে সবসময় একটি মৌলের অধীনে একসঙ্গে রাখা হয়। পারমাণবিক ভর নির্দেশ করা হলে, এটি সাধারণত প্রাকৃতিকভাবে সংঘটিত আইসোটোপের ভরের গড়; কিন্তু যদি কোনো আইসোটোপ যথেষ্ট পরিমাণে প্রকৃতিতে না থাকে, তবে সবচেয়ে স্থিতিশীল আইসোটোপের ভর সাধারণত প্রদর্শিত হয়, প্রায়ই বন্ধনীর মধ্যে।[৪]
প্রমিত পর্যায় সারণীতে, উপাদানগুলিকে পারমাণবিক সংখ্যা (Z) বাড়ানোর ক্রমে তালিকাভুক্ত করা হয়। একটি নতুন শক্তিস্তরের প্রথম ইলেকট্রন থাকলে একটি নতুন সারি (পর্যায়কাল) শুরু হয়। স্তম্ভগুলি (গ্রুপ) পরমাণুর ইলেকট্রন বিন্যাস দ্বারা নির্ধারিত হয়; একটি নির্দিষ্ট সাবশেলের ইলেকট্রনের সংখ্যা সমান থাকা উপাদানগুলি একই স্তম্ভগুলির অন্তর্গত থাকে (যেমন অক্সিজেন, সালফার এবং সেলেনিয়াম একই স্তম্ভে রয়েছে, কারণ বাইরেরতম p-সাবশেলের সবার চারটি ইলেকট্রন আছে)। একই রকম রাসায়নিক বৈশিষ্ট্যযুক্ত উপাদানগুলি সাধারণত পর্যায় সারণির একই গ্রুপে পড়ে। যদিও f-ব্লকে, এবং কিছু ক্ষেত্রে d-ব্লকে, একই পর্যায়ের উপাদানগুলির একই রকম বৈশিষ্ট্য থাকে । সুতরাং, আপনি যদি কোনো মৌলের আশেপাশের উপাদানগুলির বৈশিষ্ট্য সম্পর্কে জানেন, তবে আপনি সহজেই একটি উপাদানের রাসায়নিক বৈশিষ্ট্যগুলো অনুমান করতে পারেন।
প্রথম 94টি উপাদান প্রাকৃতিকভাবে সংঘটিত হয়। বাকি ২৪ টি উপাদান অ্যামেরিসিয়াম থেকে ওগানেসন (95–118), ল্যাবরেটরিতে তৈরি করা হলেই পাওয়া যায়। 94টি প্রাকৃতিকভাবে সংঘটিত উপাদানের মধ্যে, 83টি আদিম যৌগ এবং 11টি শুধুমাত্র ক্ষয়কারী আদিম উপাদানের শৃঙ্খলে পাওয়া যায়। এগুলির মধ্যে কিছু এত বিরল যে সেগুলি প্রকৃতিতে আবিষ্কৃত হয়নি। প্রথমে ল্যাবরেটরিতে এগুলো সংশ্লেষ করা হয়। এরপর নির্ধারিত হয় যে এগুলো সত্ত্বেও প্রকৃতিতে বিদ্যমান: টেকনিটিয়াম (উপাদান 43), প্রমিথিয়াম (উপাদান 61), অ্যাস্টাটাইন (উপাদান 85), নেপচুনিয়াম (উপাদান 93), এবং প্লুটোনিয়াম (উপাদান 94)। আইনস্টাইনিয়ামের (উপাদান 99) চেয়ে ভারী কোনও উপাদানকে তার বিশুদ্ধ রূপে দৃশ্যমান পরিমাণে পর্যবেক্ষণ করা হয়নি। ফ্র্যান্সিয়াম (উপাদান 87) কেবলমাত্র (300,000 পরমাণু) অণুবীক্ষণিক পরিমাণ থেকে নির্গত আলোর রূপে ফটোগ্রাফ করা হয়েছে।
গ্রুপের নাম এবং সংখ্যা
[সম্পাদনা]একটি আন্তর্জাতিক নামকরণ প্রথা অনুসারে, বামতম কলাম (ক্ষার ধাতু) থেকে ডানতম কলাম (নিষ্ক্রিয় গ্যাস) পর্যন্ত গ্রুপগুলিকে ১ থেকে ১৮ সংখ্যা দিয়ে ক্রমান্বয়ে নম্বর দেওয়া হয়। এই নম্বরকরণে f-ব্লক গ্রুপগুলিকে উপেক্ষা করা হয়। গ্রুপগুলি তাদের প্রথম উপাদান দিয়েও নামকরণ করা যেতে পারে, যেমন, গ্রুপ ৩-এর জন্য "স্ক্যান্ডিয়াম গ্রুপ"।
আগে, গ্রুপগুলিকে রোমান সংখ্যা দ্বারা চিহ্নিত করা হতো। আমেরিকায়, গ্রুপটি s- বা p-ব্লকে থাকলে রোমান সংখ্যার পরে একটি "A", বা গ্রুপটি d-ব্লকে থাকলে "B" যুক্ত করা হতো। ব্যবহৃত রোমান সংখ্যাগুলি আজকের নামকরণের শেষ সংখ্যাটির সাথে মিলে যায় (যেমন, গ্রুপ ৪ উপাদানগুলি গ্রুপ IVB ছিল, এবং গ্রুপ ১৪ উপাদানগুলি গ্রুপ IVA ছিল)। ইউরোপে, অক্ষরগুলি একই রকম ছিল, শুধু গ্রুপ ১ থেকে ৭ এর জন্য "A" এবং গ্রুপ ১১ থেকে ১৭ এর জন্য "B" ব্যবহার করা হতো। উপরন্তু, গ্রুপ-৮, ৯ এবং ১০ কে একটি তিন-আকারের গ্রুপ হিসাবে গণ্য করা হতো, উভয় প্রকারেই গ্রুপ VIII হিসাবে পরিচিত ছিল। ১৯৮৮ সালে, নতুন IUPAC (ইন্টারন্যাশনাল ইউনিয়ন অফ পিওর অ্যান্ড অ্যাপ্লাইড কেমিস্ট্রি) নামকরণ পদ্ধতি (১-১৮) কার্যকরী করা হয় এবং পুরানো গ্রুপের নামগুলি (I-VIII ) বাতিল করা হয়।
| IUPAC শ্রেণি | ১a | ২ | নেই | ৩b | ৪ | ৫ | ৬ | ৭ | ৮ | ৯ | ১০ | ১১ | ১২ | ১৩ | ১৪ | ১৫ | ১৬ | ১৭ | ১৮ |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| মেন্ডেলিভ (I–VIII) | I | II | III | IV | V | VI | VII | VIII | I | II | III | IV | V | VI | VII | c | |||
| CAS (যুক্তরাষ্ট্র, A-B-A) | IA | IIA | IIIB | IVB | VB | VIB | VIIB | VIIIB | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |||
| পুরোনো IUPAC (ইউরোপ, A-B) | IA | IIA | IIIA | IVA | VA | VIA | VIIA | VIII | IB | IIB | IIIB | IVB | VB | VIB | VIIB | 0 | |||
| ট্রিভিয়াল নাম | H ও ক্ষার ধাতুr | মৃৎ ক্ষার ধাতুr | মুদ্রা ধাতুd | ট্রাইয়েলস | টেট্রেলস | নিক্টোজেনr | চ্যালকোজেনr | হ্যালোজেনr | নিষ্ক্রিয় গ্যাসr | ||||||||||
| মৌলভিত্তিক নামr | লিথিয়াম গ্রুপ | বেরিলিয়াম গ্রুপ | স্ক্যান্ডিয়াম গ্রুপ | টাইটেনিয়াম গ্রুপ | ভ্যানাডিয়াম গ্রুপ | ক্রোমিয়াম গ্রুপ | ম্যাঙ্গানিজ গ্রুপ | লোহা গ্রুপ | কোবাল্ট গ্রুপ | নিকেল গ্রুপ | তামা গ্রুপ | জিঙ্ক গ্রুপ | বোরন গ্রুপ | কার্বন গ্রুপ | নাইট্রোজেন গ্রুপ | অক্সিজেন গ্রুপ | ফ্লুরিন গ্রুপ | হিলিয়াম বা নিয়ন গ্রুপ | |
| পর্যায় ১ | H | He | |||||||||||||||||
| Period 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||
| Period 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| Period 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| Period 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Period 6 | Cs | Ba | La–Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Period 7 | Fr | Ra | Ac–No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
n/a গ্রুপ নম্বর নেই
b গ্রুপ ৩ এর উপাদান নিয়ে সব উৎস একমত নয়। (আরও জানতে পিরিয়ডিক টেবিল#গ্রুপ ৩: https://en.wikipedia.org/wiki/Group_3_element এবং গ্রুপ ৩ উপাদান: https://en.wikipedia.org/wiki/Group_3_element লিংকগুলি দেখতে পারেন)। সাধারণ অজৈব রসায়নের লেখাপড়ায় সাধারণত গ্রুপ ৩ এ স্ক্যান্ডিয়াম (Sc), ইট্রিয়াম (Y), ল্যান্থানাম (La), এবং অ্যাক্টিনিয়াম (Ac) আছে বলে ধরে নেওয়া হয়। এর ফলে গ্রুপ ৩ এবং ৪ এর মধ্যে Ce-Lu এবং Th-Lr f-ব্লক হিসেবে অবস্থান করে। তবে, যেসব উৎস এই বিষয় নিয়ে গভীরভাবে অধ্যয়ন করে তারা সাধারণত স্ক্যান্ডিয়াম, ইট্রিয়াম, লুটেটিয়াম (Lu), এবং লরেনসিয়াম (Lr) কে গ্রুপ ৩ এর অন্তর্ভুক্ত করে, যেমন এখানে দেখানো হয়েছে। IUPAC-সহ কিছু উৎস বর্তমানে একটি আপোষ অনুসরণ করে যা La-Lu এবং Ac-Lr কে f-ব্লক সারি হিসাবে রাখে, গ্রুপ ৩ এর ভারী সদস্যদের দ্ব্যর্থক রেখে। গ্রুপ ৩ এ Sc, Y, Lu, এবং Lr রাখার এই বিন্যাসটি ২০২১ সালের একটি IUPAC প্রাথমিক প্রতিবেদনে সুপারিশ করা হয়েছে।
c মেন্ডেলিফের মূল পর্যায় সারণি তৈরী করার সময় গ্রুপ ১৮, বা নিষ্ক্রিয় গ্যাসগুলি, আবিষ্কৃত হয়নি। পরে (১৯০২ সালে), মেন্ডেলিফ তাদের উপস্থিতির প্রমাণ গ্রহণ করেন। ফলে এগুলিকে পর্যায় সারণির মূলনীতির ব্যাঘাত না ঘটিয়ে একটি নতুন "গ্রুপ ০"-এ রাখা যায়।
d রোয়েন্টজেনিয়াম (Rg) কে একটি কয়নেজ ধাতু হিসাবে বিবেচনা করা হবে কিনা সে বিষয়ে লেখকদের মধ্যে মতভেদ রয়েছে। এটি গ্রুপ ১১ এ অবস্থিত, অন্যান্য কয়নেজ ধাতুর মতোই, এবং রাসায়নিকভাবে সোনার অনুরূপ বলে আশা করা হয়। তবে অত্যন্ত তেজস্ক্রিয় এবং স্বল্পস্থায়ী হওয়ার কারণে, মুদ্রার জন্য ব্যবহার করা যেতে পারে না বলেই এর নাম থেকে বোঝা যায়। এই কারণেই কখনও কখনও এটিকে কয়নেজ ধাতুর তালিকা থেকে বাদ দেওয়া হয়।[৫][৬]
r IUPAC দ্বারা সুপারিশকৃত গ্রুপগুলোর নাম তালিকায় r দিয়ে চিহ্নিত করা হয়েছে।
উপস্থাপনার রূপভেদ
[সম্পাদনা]জায়গা বাঁচানোর জন্য পর্যায় সারণিকে সাধারণত f-ব্লক উপাদানগুলি সরিয়ে নিয়ে মূল বডির নীচে আলাদাভাবে দেখানো হয়। এর ফলে মৌলের কলামের সংখ্যা ৩২ থেকে কমে ১৮-তে নেমে আসে।
উভয় রূপই একই পর্যায় সারণি উপস্থাপন করে। মূল অংশে f-ব্লক যুক্ত যে রূপটি তাকে কখনও কখনও ৩২-কলাম বা দীর্ঘ সংস্করণ বলা হয়; যে রূপে f-ব্লক সরানো থাকে তাকে ১৮-কলাম বা মাঝারি-দীর্ঘ সংস্করণ বলা হয়। ৩২-কলাম বিশিষ্ট সংস্করণের সুবিধা হল এটি সমস্ত উপাদান ক্রমানুসারে দেখায়, তবে এতে বেশি জায়গার প্রয়োজন হয়। নির্বাচিত রূপটি সম্পাদকীয় সিদ্ধান্ত, এর মাধ্যমে কোনো বৈজ্ঞানিক দাবি বা বিবৃতিতে কোনো পরিবর্তন বোঝায় না। উদাহরণস্বরূপ, গ্রুপ ৩-এর উপাদান নিয়ে আলোচনা করার সময়, উভয় রূপে পর্যায় সারণির বিকল্পগুলোকে সমানভাবে (নিরপেক্ষভাবে) দেখানো যেতে পারে।
পর্যায় সারণিতে সাধারণত অন্তত মৌলের সংকেতগুলি থাকে; অনেকগুলিতে রং-কোডিং বা সারণির ঘরে তথ্য সংযোজনের মাধ্যমে মৌল সম্পর্কে আরো তথ্য দেওয়া থাকে। উপরে দেওয়া সারণিতে মৌলের নাম এবং পারমাণবিক সংখ্যা রয়েছে, সেই সাথে সেগুলির ব্লক, প্রাকৃতিকভাবে পাওয়া যায় কিনা, এবং আদর্শ পারমাণবিক ভর দেখানো হয়েছে। স্বল্পস্থায়ী মৌলগুলোর ক্ষেত্রে আদর্শ পারমাণবিক ভর না থাকায়, তাদের সবচেয়ে স্থিতিশীল আইসোটোপের ভর সংখ্যা ব্যবহার করা হয়েছে। অন্যান্য সারণিতে বস্তুর অবস্থা, গলনাঙ্ক এবং স্ফুটনাঙ্ক, ঘনত্বের মতো বৈশিষ্ট্য থাকতে পারে, সেই সাথে মৌলের বিভিন্ন শ্রেণিবিন্যাসও দেখানো যেতে পারে।
উপাদানের পারমাণবিক গঠন
[সম্পাদনা]নিউক্লিয়াস এবং তার চারপাশে ঘূর্ণায়মান ইলেকট্রন
[সম্পাদনা]
সকল স্বাভাবিক বস্তুর ক্ষুদ্রতম অংশগুলোকে পরমাণু বলে। পরমাণুগুলি অত্যন্ত ছোট, প্রায় দশ বিলিয়ন ভাগের এক মিটার দৈর্ঘ্যের। এদের অভ্যন্তরীণ গঠন কোয়ান্টাম মেকানিক্স দ্বারা নিয়ন্ত্রিত হয়। পরমাণুতে একটি ক্ষুদ্র ধনাত্মক চার্জযুক্ত নিউক্লিয়াস থাকে। এই নিউক্লিয়াসের ভিতরে থাকে ধনাত্মক চার্জযুক্ত প্রোটন এবং চার্জহীন নিউট্রন। নিউক্লিয়াসের চারপাশে ঋণাত্মক চার্জযুক্ত ইলেকট্রনের সমন্বয়ে একটি মেঘের মত অবস্থা বিরাজ করে। এসব চার্জ একে অপরকে নিষ্ক্রিয় করে দেয়, তাই পরমাণু নিরপেক্ষ। ইলেকট্রন রাসায়নিক বিক্রিয়ায় অংশ নেয়, কিন্তু নিউক্লিয়াস অংশগ্রহণ করে না। পরমাণু যখন রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করে, তখন তারা ধনাত্মক বা ঋণাত্মক চার্জযুক্ত আয়নে পরিণত হওয়ার জন্য ইলেকট্রন লাভ করে বা হারায়, অথবা একে অপরের সাথে ইলেকট্রন শেয়ার করে।
প্রোটনের সংখ্যার উপর ভিত্তি করে (এবং একইসাথে ইলেক্ট্রনেরও উপর) পরমাণুকে বিভিন্ন প্রকারে ভাগ করা যায়। একে পারমাণবিক সংখ্যা বলা হয়, প্রায়শই Z (জার্মান "Zahl" থেকে - যার অর্থ "সংখ্যা") দ্বারা প্রতীকী করা হয়। তাই প্রতিটি স্বতন্ত্র পারমাণবিক সংখ্যা একটি পরমাণুর শ্রেণীর সাথে মিলে যায়: এই শ্রেণিগুলিকে রাসায়নিক উপাদান বলা হয়। পর্যায় সারণী এই উপাদানগুলোকেই শ্রেণীবদ্ধ করে। হাইড্রোজেন হল ১ পারমাণবিক সংখ্যা বিশিষ্ট মৌল; হিলিয়ামের পারমাণবিক সংখ্যা ২; লিথিয়ামের ৩; এবং এইভাবে চলতে থাকে। এই নামগুলি আরও সংক্ষেপে এক বা দুই অক্ষরের রাসায়নিক প্রতীক দ্বারা প্রকাশ করা যেতে পারে; যেমন হাইড্রোজেন, হিলিয়াম এবং লিথিয়ামের যথাক্রমে H, He, এবং Li। নিউট্রন পরমাণুর রাসায়নিক পরিচয়কে প্রভাবিত করে না, তবে এর ওজনকে প্রভাবিত করে। একই সংখ্যক প্রোটন কিন্তু বিভিন্ন সংখ্যক নিউট্রন বিশিষ্ট পরমাণুকে একই রাসায়নিক উপাদানের আইসোটোপ বলা হয়। স্বাভাবিকভাবেই বিভিন্ন আইসোটোপের মিশ্রণ হিসেবে উপাদানগুলো পাওয়া যায়। যেহেতু প্রতিটি আইসোটোপ সাধারণত একটি নির্দিষ্ট পরিমাণে পাওয়া যায়, তাই স্বাভাবিক উপাদানের সুনির্দিষ্ট পারমাণবিক ওজন থাকে। একটি স্বাভাবিকভাবে উপস্থিত পরমাণুর গড় ভরকে পারমাণবিক ভর হিসেবে সংজ্ঞায়িত করা হয়।
বর্তমানে ১১৮ টি মৌল জানা গেছে, যার মধ্যে প্রথম ৯৪টি স্বাভাবিকভাবে পৃথিবীতে পাওয়া যায়। ৯৪টি প্রাকৃতিক উপাদানের মধ্যে আশিটির একটি স্থিতিশীল আইসোটোপ রয়েছে এবং আরও একটি (বিসমাথ) এর প্রায় স্থিতিশীল আইসোটোপ রয়েছে (২.০১×১০১৯ বছর হাফ-লাইফ সহ, মহাবিশ্বের বয়সের চেয়ে এক বিলিয়ন গুণ বেশি)। আরও দুটি, থোরিয়াম এবং ইউরেনিয়ামের আইসোটোপ আছে যাদের তেজস্ক্রিয় ক্ষয় পৃথিবীর বয়সের সাথে তুলনীয় হাফ-লাইফের মধ্যে দিয়ে যায়। স্থিতিশীল উপাদানগুলি আর বিসমাথ, থোরিয়াম এবং ইউরেনিয়াম মিলে ৮৩টি আদিম উপাদান তৈরি করে যা পৃথিবীর গঠনের সময় থেকেই বেঁচে আছে। অবশিষ্ট একাদশ প্রাকৃতিক মৌল যথেষ্ট দ্রুত ক্ষয় হয়ে যায় এবং তাই থোরিয়াম এবং ইউরেনিয়ামের ক্ষয়ের কারণে মধ্যবর্তী পণ্য হিসেবে এগুলোর ক্ষুদ্র উপস্থিতি অব্যাহত থাকে। বাকি ২৪টি কৃত্রিম উপাদান সবগুলোই তেজস্ক্রিয়।
ইলেকট্রন বিন্যাস
[সম্পাদনা]মৌলিক পদার্থগুলোর পর্যাবৃত্ত সূত্রকে চিত্রের মাধ্যমে উপস্থাপন করার সরঞ্জাম হলো পর্যায় সারণি। এই সূত্রটি বলে, মৌলসমূহের পারমাণবিক সংখ্যার একটি পর্যায়ক্রমিক বিশেষ ধরন অনুযায়ী রাসায়নিক উপাদানের ধর্ম ও পারমাণবিক গঠন পরিবর্তিত হয়। ইলেকট্রন বিন্যাসের উপর ভিত্তি করেই পর্যায় সারণিতে মৌলগুলোকে স্থান দেওয়া হয় এবং এই ইলেকট্রন বিন্যাসের পর্যায়ক্রমিক পুনরাবৃত্তির কারণেই পর্যায় সারণিতে উপাদানগুলোর ধর্মের প্রবণতা ব্যাখ্যা করা যায়।
প্রত্যেকটি ইলেকট্রনকে পারমাণবিক কক্ষকের অধিবাসী বলে ধরে নেওয়া যেতে পারে। এই কক্ষকগুলো নির্দেশ করে যে, কতটুকু সম্ভাবনা আছে যে কোনও নির্দিষ্ট সময়ে পরমাণুর কোনও নির্দিষ্ট অঞ্চলে একটি ইলেকট্রন খুঁজে পাওয়া যাবে। ইলেকট্রনগুলোর শক্তি কোয়ান্টাইজড, অর্থাৎ শুধুমাত্র বিচ্ছিন্ন মান গ্রহণ করতে পারে। উপরন্তু, ইলেকট্রনরা পাউলির বর্জন নীতিকে মেনে চলে: ভিন্ন ইলেকট্রনদের অবস্থা সবসময় ভিন্ন হতে হবে। এর ফলে ইলেকট্রনগুলি বিভিন্ন শক্তিস্তরে যেসব সম্ভাব্য অবস্থা নিতে পারে সেগুলিকে শ্রেণিবদ্ধ করা সম্ভব। শক্তিস্তরগুলোকে 'শেল' বলা হয়, আর এরা আবার পৃথক উপশক্তিস্তরে বা 'সাবশেল'-এ বিভক্ত। প্রতিটি সাবশেল একটি বা একাধিক অরবিটাল ধারণ করে। প্রতিটি অরবিটালে সর্বোচ্চ দুটি ইলেকট্রন থাকতে পারে, এদের সনাক্ত করা হয় "আপ" বা "ডাউন" নামক স্পিন কোয়ান্টাম সংখ্যা দ্বারা। শীতল পরমাণুতে (নিম্ন শক্তিস্তরে থাকা পরমাণু) ইলেকট্রনসমূহ নিজেদের এমনভাবে সাজায় যাতে তাদের মোট শক্তি সর্বনিম্ন হয়, আর তাই তারা সর্বনিম্ন শক্তির কক্ষকগুলো দখল করে। শুধু বহিঃস্থ ইলেকট্রনদের (যাদের 'যোজ্যতা ইলেকট্রন' বলা হয়) শক্তি পরমাণুর নিউক্লিয়াসের আকর্ষণ থেকে মুক্ত হয়ে অন্য পরমাণুর সাথে রাসায়নিক বিক্রিয়ায় অংশ নিতে যথেষ্ট হয়। অন্য ইলেকট্রনগুলোকে বলা হয় কেন্দ্রীয় ইলেকট্রন।
| ℓ = | 0 | 1 | 2 | 3 | 4 | 5 | 6 | শক্তিস্তরের ধারণক্ষমতা (2n2)[৭] |
|---|---|---|---|---|---|---|---|---|
| অরবিটাল | s | p | d | f | g | h | i | |
| n = 1 | 1s | 2 | ||||||
| n = 2 | 2s | 2p | 8 | |||||
| n = 3 | 3s | 3p | 3d | 18 | ||||
| n = 4 | 4s | 4p | 4d | 4f | 32 | |||
| n = 5 | 5s | 5p | 5d | 5f | 5g | 50 | ||
| n = 6 | 6s | 6p | 6d | 6f | 6g | 6h | 72 | |
| n = 7 | 7s | 7p | 7d | 7f | 7g | 7h | 7i | 98 |
| উপশক্তিস্তরের ধারণক্ষমতা (4ℓ+2) | 2 | 6 | 10 | 14 | 18 | 22 | 26 | |
এখন পর্যন্ত যে উপাদানগুলো আবিষ্কৃত হয়েছে, তাদের মধ্যে সাতটি শেল পর্যন্ত পূর্ণ হয়েছে। প্রথম শেলে শুধুমাত্র একটি অরবিটাল আছে, একটি গোলকাকার s অরবিটাল। যেহেতু এটি প্রথম শেলে, একে 1s অরবিটাল বলা হয়। এতে সর্বোচ্চ দুটি ইলেকট্রন থাকতে পারে। দ্বিতীয় শেলেও একটি 2s অরবিটাল থাকে, এছাড়া থাকে তিনটি ডাম্বেল আকৃতির 2p অরবিটাল, ফলে এ শেলে আটটি পর্যন্ত ইলেকট্রন থাকতে পারে (2×1 + 2×3 = 8)। তৃতীয় শেলে একটি 3s অরবিটাল, তিনটি 3p অরবিটাল, এবং পাঁচটি 3d অরবিটাল থাকে, আর তাই এর সক্ষমতা হলো: 2×1 + 2×3 + 2×5 = 18 । চতুর্থ শেলে থাকে একটি 4s অরবিটাল, তিনটি 4p অরবিটাল, পাঁচটি 4d অরবিটাল এবং সাতটি 4f অরবিটাল, সেহেতু এর সক্ষমতা: 2×1 + 2×3 + 2×5 + 2×7 = 32। উচ্চতর শেলগুলোতে নানা ধরনের অরবিটাল থাকে যেগুলো একই প্যাটার্ন অনুসরণ করে, কিন্তু আবিষ্কৃত উপাদানগুলোর নিম্ন শক্তিস্তরে এই অরবিটালগুলো পূর্ণ হয় না। এই সাবশেলগুলো কোয়ান্টাম সংখ্যা দিয়ে চিহ্নিত করা হয়। চারটি সংখ্যা দিয়ে পারমাণবিক কক্ষকের ইলেকট্রনগুলোকে সম্পূর্ণরূপে বর্ণনা করা যায়: মুখ্য কোয়ান্টাম সংখ্যা n, অরবিটাল কোয়ান্টাম সংখ্যা ℓ, চৌম্বক কোয়ান্টাম সংখ্যা mℓ, এবং স্পিন কোয়ান্টাম সংখ্যা s।
ইলেকট্রনের উপস্তরে পূরণ হবার ক্রম
[সম্পাদনা]
ইলেকট্রন কোনো পরমাণুর শক্তিস্তরের নিম্নশক্তির উপস্তর থেকে উচ্চশক্তির উপস্তরে স্থানান্তরিত হয়ে থাকে। এই ইলেকট্রন বিন্যাসের ক্রম Aufbau নীতি বা Madelung নীতি বা Klechkovsky নীতি নামে পরিচিত। এই নীতি অনুযায়ী ইলেকট্রনের উপস্তরে ভরাট হবার ক্রম নিম্নরূপ:
1s ≪ 2s < 2p ≪ 3s < 3p ≪ 4s < 3d < 4p ≪ 5s < 4d < 5p ≪ 6s < 4f < 5d < 6p ≪ 7s < 5f < 6d < 7p ≪ ...
এখানে ≪ চিহ্নটি 'অপেক্ষাকৃত অনেক কম' বোঝায়। কক্ষপথসমূহে ইলেকট্রন (n + ℓ) এর মানের ক্রম অনুসারে প্রবেশ করে। যদি দুইটি কক্ষপথের (n + ℓ) এর মান সমান হয় তবে যে কক্ষপথের n এর মান কম সে কক্ষপথে ইলেকট্রন আগে প্রবেশ করে।
সাধারণত, একই (n + ℓ) মানযুক্ত কক্ষপথগুলি শক্তিতে প্রায় সমান। তবে s-অরবিটালের (ℓ = 0) ক্ষেত্রে, কোয়ান্টাম প্রভাব তাদের শক্তিকে পরবর্তী (n + ℓ) শক্তিস্তরের কাছাকাছি বাড়িয়ে দেয়। এভাবে পর্যায় সারণি তৈরী করা হয় যেখানে প্রতিটি সারি (প্রায়শই একটি পর্যায় বা পিরিয়ড বলা হয়) একটি নতুন s-অরবিটালকে পূরণ করার সাথে শুরু হয়, যা একটি নতুন শক্তিস্তর বা শেলের সূচনা নির্দেশ করে।
সরলতম পরমাণু হাইড্রোজেন থেকে শুরু করে আমরা পারমাণবিক সংখ্যার ক্রমে পর্যায় সারণী তৈরি করতে পারি। হাইড্রোজেনে, কেবল একটি ইলেকট্রন রয়েছে, যা অবশ্যই সর্বনিম্ন-শক্তির কক্ষপথ 1s এ অবস্থান করে। এই ইলেকট্রন কনফিগারেশনটিকে1s1 হিসাবে লেখা হয়, যেখানে সুপারস্ক্রিপ্টটি উপস্তরে ইলেকট্রনের সংখ্যা নির্দেশ করে। হিলিয়ামে একটি দ্বিতীয় ইলেকট্রন যোগ হয়, যা 1s এ প্রবেশ করে সম্পূর্ণরূপে প্রথম শেল পূরণ করে এবং 1s2 কনফিগারেশন তৈরী করে।
তৃতীয় মৌল লিথিয়াম থেকে প্রথম শেলটি পূর্ণ হয়। তাই লিথিয়ামের তৃতীয় ইলেকট্রন একটি 2s কক্ষপথ দখল করে, একটি 1s2 2s1 কনফিগারেশন তৈরী করে। 2s ইলেকট্রন হলো লিথিয়ামের একমাত্র যোজনী ইলেকট্রন। যেহেতু 1s উপস্তরটি এখন অন্যান্য পরমাণুর সাথে রাসায়নিক বন্ধনে অংশগ্রহণ করার জন্য নিউক্লিয়াসের সাথে খুব শক্তভাবে আবদ্ধ। তাই এই ধরনের শেলকে "কোর শেল" বলা হয়। 1s উপস্তরটি লিথিয়াম থেকে পরবর্তী সকল মৌলের কোর শেল।
পরবর্তী মৌল বেরিলিয়ামে 2s উপস্তর সম্পূর্ণ হয় (1s2 2s2)। এরপরের মৌলগুলি 2p উপস্তর পূরণ করতে এগিয়ে যায়। বোরনের (1s2 2s2 2p1) নতুন ইলেক্ট্রন একটি 2p অরবিটালে যায়; কার্বন (1s2 2s2 2p2) একটি দ্বিতীয় 2p কক্ষপথ পূরণ করে; এবং নাইট্রোজেনের (1s2 2s2 2p3) সাথে সবকটি 2p অরবিটাল পৃথকভাবে দখল হয়ে যায়। এটি হুন্ডের নিয়মের সাথে সামঞ্জস্যপূর্ণ। অক্সিজেন (1s2 2s2 2p4), ফ্লোরিন (1s2 2s2 2p5), এবং নিয়ন (1s2 2s2 2p6) এরপর ইতিমধ্যেই পৃথকভাবে পূর্ণ 2p কক্ষপথগুলি সম্পূর্ণ করে৷ নিয়ন সম্পূর্ণরূপে দ্বিতীয় শেলটি পূরণ করে।
প্রথম আঠারোটি মৌলকে পর্যায় সারণীর একটি অংশ হিসেবে সাজানো যায়। একই কলামে থাকা মৌলগুলোর যোজনী ইলেকট্রনের সংখ্যা সমান এবং তাদের যোজনী ইলেকট্রনের ধরণ একই রকম। এই কলামগুলোকে গ্রুপ বলা হয়। এক্ষেত্রে একমাত্র ব্যতিক্রম হলো হিলিয়াম। এর দুটি যোজনী ইলেকট্রন রয়েছে - বেরিলিয়াম এবং ম্যাগনেসিয়ামের মতোই। কিন্তু হিলিয়ামকে সাধারণত নিওন এবং আর্গনের কলামে স্থাপন করা হয় যাতে এটির বহিঃস্থ শক্তিস্তরটি পূর্ণ তা জোর দেওয়া যায়। (কিছু সমসাময়িক লেখক এই ব্যতিক্রমটি নিয়েও প্রশ্ন তোলেন এবং যোজনী ইলেকট্রনের বিন্যাসের ধারাবাহিকতা অনুসরণ করে হিলিয়ামকে বেরিলিয়ামের ওপরে স্থাপনের পক্ষে মত দেন।) এই পর্যায় সারণীর অংশে আটটি কলাম রয়েছে, যা সর্বোচ্চ আটটি বহিঃস্থ শক্তিস্তরের ইলেকট্রন থাকার সম্ভাবনা নির্দেশ করে। একটি নতুন শক্তিস্তর পূরণ হতে শুরু করলেই একটি পর্যায় শুরু হয়। সর্বশেষে, বিভিন্ন ব্লকের বর্ণের মাধ্যমে ইলেকট্রনের কক্ষপথের সম্পর্ক তুলে ধরা হয়েছে: s-ব্লকের মৌলগুলির (লাল রঙের) s-কক্ষপথ পূরণ হয় এবং p-ব্লকের মৌলগুলির (হলুদ রঙের) p-কক্ষপথ পূরণ হয়।
| ১ H |
২ He |
2×1 = 2 elements
1s | ||||||
| ৩ Li |
৪ Be |
৫ B |
৬ C |
৭ N |
৮ O |
৯ F |
১০ Ne |
2×(1+3) = 8 elements
2s 2p |
| ১১ Na |
১২ Mg |
১৩ Al |
১৪ Si |
১৫ P |
১৬ S |
১৭ Cl |
১৮ Ar |
2×(1+3) = 8 elements
3s 3p |
পরবর্তী সারিতে, পটাসিয়াম ও ক্যালসিয়ামের ক্ষেত্রে 4s উপকক্ষের শক্তি সর্বনিম্ন, এবং সেজন্য সেগুলো আগে ইলেকট্রন দ্বারা পূর্ণ হয়। পটাশিয়াম 4s কক্ষে একটি ইলেকট্রন যোগ করে ([Ar] 4s1), এবং তারপর ক্যালসিয়াম এটি সম্পূর্ণ করে ([Ar] 4s2)। যাইহোক, স্ক্যান্ডিয়াম ([Ar] 3d1 4s2) থেকে শুরু করে 3d উপকক্ষ পরবর্তী সর্বোচ্চ শক্তির স্তরে পরিণত হয়। 4s এবং 3d উপকক্ষের প্রায় একই শক্তি আছে এবং সেগুলো ইলেকট্রন দ্বারা পূর্ণ হওয়ার জন্য প্রতিযোগিতা করে। তাই 3d কক্ষকগুলো সবসময় ক্রমান্বয়ে একটি করে ইলেকট্রন দ্বারা পূর্ণ হচ্ছে না। এই সারি বরাবর 3d এবং 4s এর সঠিক শক্তি ক্রম পরিবর্তিত হয়। এই পরিবর্তন এই বিষয়ের উপরও নির্ভর করে যে পরমাণু থেকে কতগুলো ইলেকট্রন অপসারিত হয়েছে। উদাহরণস্বরূপ, 3d এবং 4s ইলেকট্রনের মধ্যে বিকর্ষণের কারণে, ক্রোমিয়ামের ক্ষেত্রে 4s শক্তিস্তরটি 3d তুলনায় সামান্য উচ্চতর হয়ে যায়, এবং তাই ক্রোমিয়াম পরমাণুর জন্য [Ar] 3d4 4s2 এর পরিবর্তে [Ar] 3d5 4s1 কনফিগারেশনে থাকা বেশি লাভজনক হয়ে পড়ে। একই ধরনের ব্যতিক্রম দেখা যায় কপারের ক্ষেত্রে, যার পরমাণুর [Ar] 3d9 4s2 এই প্রত্যাশিত কনফিগারেশনের পরিবর্তে [Ar] 3d10 4s1 কনফিগারেশন আছে। এগুলো Madelung এর নিয়মের ব্যতিক্রম। যাইহোক, এই ধরনের ব্যতিক্রমগুলোর রাসায়নিকভাবে তেমন গুরুত্ব নেই। রসায়নের অধিকাংশ বিষয় বিচ্ছিন্ন গ্যাসীয় পরমাণু নিয়ে নয়। বিভিন্ন কনফিগারেশনগুলোর শক্তির পার্থক্য এতই কম যে নিকটবর্তী একটি পরমাণুও এই ভারসাম্য পরিবর্তন করে দিতে পারে। সুতরাং পর্যায় সারণী এগুলোকে উপেক্ষা করে শুধুমাত্র আদর্শ কনফিগারেশনগুলোকেই বিবেচনা করে।
জিংকের ক্ষেত্রে ([Ar] 3d10 4s2), 3d অরবিটালগুলো মোট দশটি ইলেকট্রন দ্বারা সম্পূর্ণরূপে পূর্ণ হয়। এরপর আসে 4p অরবিটাল, যা গ্যালিয়াম ([Ar] 3d10 4s2 4p1) থেকে ক্রিপটন ([Ar] 3d10 4s2 4p6) পর্যন্ত ক্রমান্বয়ে পূর্ণ হয়, আগের p-ব্লক মৌলগুলোর মতই। গ্যালিয়াম থেকে শুরু করে, 3d অরবিটালগুলি ইলেকট্রন-কোর বা অন্তঃস্তর গঠন করে এবং রসায়নে আর অংশগ্রহণ করে না। s- এবং p-ব্লক মৌলগুলি, যাদের বহিঃস্তরে ইলেকট্রন পূরণ হয়, তাদের প্রধান-গ্রুপ মৌল বলে; d-ব্লক মৌলগুলি (নীচে নীল রঙে দেখানো হয়েছে), যেগুলো অন্তঃস্তর পূরণ করে সেগুলোকে রূপান্তর মৌল বলে (অথবা রূপান্তর ধাতু, কারণ এরা সবাই ধাতু)।
পরের আঠারোটি মৌল 5s অরবিটালগুলি পূরণ করে (রুবিডিয়াম এবং স্ট্রনটিয়াম), তারপর 4d (ইট্রিয়াম থেকে ক্যাডমিয়াম, কিছু ব্যতিক্রম আছে), এবং তারপর 5p (ইন্ডিয়াম থেকে জেনন)। আবারও, ইন্ডিয়াম থেকে শুরু করে 4d অরবিটালগুলি কোর-এ যুক্ত হয়। সুতরাং পঞ্চম সারির গঠন চতুর্থ সারির মতই।
| ১ H |
২ He |
2×1 = 2 elements
1s | ||||||||||||||||
| ৩ Li |
৪ Be |
৫ B |
৬ C |
৭ N |
৮ O |
৯ F |
১০ Ne |
2×(1+3) = 8 elements
2s 2p | ||||||||||
| ১১ Na |
১২ Mg |
১৩ Al |
১৪ Si |
১৫ P |
১৬ S |
১৭ Cl |
১৮ Ar |
2×(1+3) = 8 elements
3s 3p | ||||||||||
| ১৯ K |
২০ Ca |
২১ Sc |
২২ Ti |
২৩ V |
২৪ Cr |
২৫ Mn |
২৬ Fe |
২৭ Co |
২৮ Ni |
২৯ Cu |
৩০ Zn |
৩১ Ga |
৩২ Ge |
৩৩ As |
৩৪ Se |
৩৫ Br |
৩৬ Kr |
2×(1+3+5) = 18 elements
4s 3d 4p |
| ৩৭ Rb |
৩৮ Sr |
৩৯ Y |
৪০ Zr |
৪১ Nb |
৪২ Mo |
৪৩ Tc |
৪৪ Ru |
৪৫ Rh |
৪৬ Pd |
৪৭ Ag |
৪৮ Cd |
৪৯ In |
৫০ Sn |
৫১ Sb |
৫২ Te |
৫৩ I |
৫৪ Xe |
2×(1+3+5) = 18 elements
5s 4d 5p |
পর্যায় সারণির ষষ্ঠ সারি বা শ্রেণীটিও দুটি s-ব্লক মৌল দিয়ে শুরু হয়: সিজিয়াম ও বেরিয়াম। এরপর, প্রথম f-ব্লক উপাদানসমূহ (নীচে সবুজ রঙে দেখানো হয়েছে) উপস্থিত হতে শুরু করে; ল্যান্থানাম দিয়ে শুরু। এদেরকে কখনও কখনও অন্তঃঅবস্থান্তর মৌল বলা হয়। যেহেতু এখন কেবল 4f নয়, 5d এবং 6s সাবশেলগুলিও একই রকম শক্তিতে রয়েছে, তাই অনেক অনিয়মিত কনফিগারেশনের সাথে আবারও প্রতিযোগিতা শুরু হয়। এতে করে f-ব্লক আসলে কোথায় শুরু হয় তা নিয়ে কিছুটা বিতর্ক দেখা দেয়, তবে অধিকাংশ গবেষক একমত যে এটি Aufbau নীতি অনুসারে ল্যান্থানামে শুরু হয়। যদিও ল্যান্থানাম নিজে থেকে একটি মাত্র পরমাণু হিসেবে 4f সাবশেল পূরণ করে না ইলেকট্রনগুলোর পারস্পরিক বিকর্ষণের কারণে, রসায়নে অংশগ্রহণের জন্য এর 4f অরবিটালগুলো শক্তিতে যথেষ্ট কম থাকে। ইটারবিয়ামের ক্ষেত্রে, সাতটি 4f অরবিটাল পুরোপুরি চৌদ্দটি ইলেকট্রন দিয়ে ভরাট হয়ে যায়; এরপরে, দশটি অবস্থান্তর মৌলের একটি শ্রেণী (লুটেটিয়াম থেকে পারদ) অনুসরণ করে এবং অবশেষে ছয়টি মূল-গ্রুপ উপাদান (থ্যালিয়াম থেকে রেডন) এই পর্যায়টি শেষ করে। লুটেটিয়াম থেকে শুরু করে 4f অরবিটালগুলি ভেতরের স্তরে থাকে এবং থ্যালিয়াম থেকে 5d অরবিটালগুলিও তাই।
সপ্তম শ্রেণীটি ষষ্ঠ শ্রেণীর অনুরূপ: 7s পূরণ হয় (ফ্র্যান্সিয়াম এবং রেডিয়াম), তারপর 5f (অ্যাক্টিনিয়াম থেকে নোবেলিয়াম), তারপর 6d (লরেনসিয়াম থেকে কোপার্নিসিয়াম) এবং অবশেষে 7p (নিহোনিয়াম থেকে ওগানেসন)। লরেনসিয়াম থেকে শুরু করে 5f অরবিটালগুলি ভেতরের স্তরে থাকে এবং সম্ভবত 6d অরবিটালগুলি নিহোনিয়াম থেকে শুরু হয়ে ভেতরের স্তরে যোগ দেয়। এখানেও কিছু ব্যতিক্রম আছে: উদাহরণস্বরূপ, একক পরমাণু হিসাবে অ্যাক্টিনিয়াম বা থোরিয়াম আসলে 5f সাবশেল পূরণ করে না, এবং লরেনসিয়াম 6d শেল পূরণ করে না, তবে রাসায়নিক পরিবেশে এই সমস্ত সাবশেলগুলি এখনও পূরণ হতে পারে। অনেক দিন ধরেই, সপ্তম শ্রেণীটি অসম্পূর্ণ ছিল কারণ এর বেশিরভাগ উপাদান প্রকৃতিতে পাওয়া যায় না। ইউরেনিয়ামের পর থেকে নিখোঁজ মৌলগুলো ১৯৪০ সালে পরীক্ষাগারে তৈরি করা শুরু হয়, যখন নেপচুনিয়াম তৈরি করা হয়েছিল। (যদিও, প্রকৃতিতে না পাওয়া গিয়ে প্রথম যে উপাদানটি পরীক্ষাগারে আবিষ্কৃত হয় তা হলো ১৯৩৭ সালের টেকনিশিয়াম।) ২০১০ সালে টেনেসিন তৈরির মাধ্যমে এই শ্রেণীটি সম্পূর্ণ হয় (শেষ উপাদান ওগানেসন ইতিমধ্যেই ২০০২ সালে তৈরি করা হয়েছিল), এবং এই সপ্তম শ্রেণীর শেষ মৌলগুলোকে ২০১৬ সালে নাম দেওয়া হয়।
| ১ H |
২ He |
২×১ = ২টি মৌল
1s | ||||||||||||||||||||||||||||||
| ৩ Li |
৪ Be |
৫ B |
৬ C |
৭ N |
৮ O |
৯ F |
১০ Ne |
২×(১+৩) = ৮টি মৌল
2s 2p | ||||||||||||||||||||||||
| ১১ Na |
১২ Mg |
১৩ Al |
১৪ Si |
১৫ P |
১৬ S |
১৭ Cl |
১৮ Ar |
২×(১+৩) = ৮টি মৌল
3s 3p | ||||||||||||||||||||||||
| ১৯ K |
২০ Ca |
২১ Sc |
২২ Ti |
২৩ V |
২৪ Cr |
২৫ Mn |
২৬ Fe |
২৭ Co |
২৮ Ni |
২৯ Cu |
৩০ Zn |
৩১ Ga |
৩২ Ge |
৩৩ As |
৩৪ Se |
৩৫ Br |
৩৬ Kr |
২×(১+৩+৫) = ১৮টি মৌল
4s 3d 4p | ||||||||||||||
| ৩৭ Rb |
৩৮ Sr |
৩৯ Y |
৪০ Zr |
৪১ Nb |
৪২ Mo |
৪৩ Tc |
৪৪ Ru |
৪৫ Rh |
৪৬ Pd |
৪৭ Ag |
৪৮ Cd |
৪৯ In |
৫০ Sn |
৫১ Sb |
৫২ Te |
৫৩ I |
৫৪ Xe |
২×(১+৩+৫) = ১৮টি মৌল
5s 4d 5p | ||||||||||||||
| ৫৫ Cs |
৫৬ Ba |
৫৭ La |
৫৮ Ce |
৫৯ Pr |
৬০ Nd |
৬১ Pm |
৬২ Sm |
৬৩ Eu |
৬৪ Gd |
৬৫ Tb |
৬৬ Dy |
৬৭ Ho |
৬৮ Er |
৬৯ Tm |
৭০ Yb |
৭১ Lu |
৭২ Hf |
৭৩ Ta |
৭৪ W |
৭৫ Re |
৭৬ Os |
৭৭ Ir |
৭৮ Pt |
৭৯ Au |
৮০ Hg |
৮১ Tl |
৮২ Pb |
৮৩ Bi |
৮৪ Po |
৮৫ At |
৮৬ Rn |
২×(১+৩+৫+৭) = ৩২টি মৌল
6s 4f 5d 6p |
| ৮৭ Fr |
৮৮ Ra |
৮৯ Ac |
৯০ Th |
৯১ Pa |
৯২ U |
৯৩ Np |
৯৪ Pu |
৯৫ Am |
৯৬ Cm |
৯৭ Bk |
৯৮ Cf |
৯৯ Es |
১০০ Fm |
১০১ Md |
১০২ No |
১০৩ Lr |
১০৪ Rf |
১০৫ Db |
১০৬ Sg |
১০৭ Bh |
১০৮ Hs |
১০৯ Mt |
১১০ Ds |
১১১ Rg |
১১২ Cn |
১১৩ Nh |
১১৪ Fl |
১১৫ Mc |
১১৬ Lv |
১১৭ Ts |
১১৮ Og |
২×(১+৩+৫+৭) = ৩২টি মৌল
7s 5f 6d 7p |
এটি আধুনিক পর্যায় সারণির সাতটি সারি বা শ্রেণীকে সম্পূর্ণভাবে তাদের ধারণক্ষমতা অনুযায়ী পূরণ করে সম্পূর্ণ করে।
ইলেকট্রন বিন্যাস সারণী
[সম্পাদনা]ইলেকট্রন বিন্যাস হলো একটি পরমাণুর মধ্যে বিভিন্ন শক্তিস্তরে ইলেকট্রনের বিন্যাসকে বুঝায়। নিচের সারণীটি প্রতিটি মৌলের নিরপেক্ষ গ্যাসীয়-অবস্থার পরমাণুর জন্য ইলেকট্রন বিন্যাস প্রদর্শন করে। অনুগ্রহ করে মনে রাখবেন যে, বিভিন্ন রাসায়নিক পরিবেশে ভিন্ন ধরনের ইলেকট্রন বিন্যাস সম্ভব। মূল-গ্রুপের মৌলগুলির সম্পূর্ণ নিয়মিত ইলেকট্রন বিন্যাস রয়েছে। অন্যদিকে, ট্রানজিশন মৌল ও অভ্যন্তরীণ ট্রানজিশন মৌলগুলি কক্ষপথের শক্তিস্তরের মধ্যকার ঘনিষ্ঠতা বা প্রতিযোগিতার কারণে বিশটি ক্ষেত্রে অনিয়ম দেখায়। সর্বশেষ দশটি মৌলের (109-118) জন্য পরীক্ষামূলক তথ্যের অভাব রয়েছে। তাই, সেই মৌলগুলোর জন্য তাত্ত্বিকভাবে গণনা করা সম্ভাব্য ইলেকট্রন বিন্যাসগুলি দেখানো হয়েছে। সম্পূর্ণরূপে পূর্ণ কক্ষপথগুলিকে ধূসর রঙে চিহ্নিত করা হয়েছে।
| Group: | 1 | 2 | | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1s: | 1 H 1 |
2 He 2 | |||||||||||||||||||||||||||||||
| [He] 2s: 2p: |
3 Li 1 - |
4 Be 2 - |
5 B 2 1 |
6 C 2 2 |
7 N 2 3 |
8 O 2 4 |
9 F 2 5 |
10 Ne 2 6 | |||||||||||||||||||||||||
| [Ne] 3s: 3p: |
11 Na 1 - |
12 Mg 2 - |
13 Al 2 1 |
14 Si 2 2 |
15 P 2 3 |
16 S 2 4 |
17 Cl 2 5 |
18 Ar 2 6 | |||||||||||||||||||||||||
| [Ar] 4s: 3d: 4p: |
19 K 1 - - |
20 Ca 2 - - |
21 Sc 2 1 - |
22 Ti 2 2 - |
23 V 2 3 - |
24 Cr 1 5 - |
25 Mn 2 5 - |
26 Fe 2 6 - |
27 Co 2 7 - |
28 Ni 2 8 - |
29 Cu 1 10 - |
30 Zn 2 10 - |
31 Ga 2 10 1 |
32 Ge 2 10 2 |
33 As 2 10 3 |
34 Se 2 10 4 |
35 Br 2 10 5 |
36 Kr 2 10 6 | |||||||||||||||
| [Kr] 5s: 4d: 5p: |
37 Rb 1 - - |
38 Sr 2 - - |
39 Y 2 1 - |
40 Zr 2 2 - |
41 Nb 1 4 - |
42 Mo 1 5 - |
43 Tc 2 5 - |
44 Ru 1 7 - |
45 Rh 1 8 - |
46 Pd - 10 - |
47 Ag 1 10 - |
48 Cd 2 10 - |
49 In 2 10 1 |
50 Sn 2 10 2 |
51 Sb 2 10 3 |
52 Te 2 10 4 |
53 I 2 10 5 |
54 Xe 2 10 6 | |||||||||||||||
| [Xe] 6s: 4f: 5d: 6p: |
55 Cs 1 - - - |
56 Ba 2 - - - |
57 La 2 - 1 - |
58 Ce 2 1 1 - |
59 Pr 2 3 - - |
60 Nd 2 4 - - |
61 Pm 2 5 - - |
62 Sm 2 6 - - |
63 Eu 2 7 - - |
64 Gd 2 7 1 - |
65 Tb 2 9 - - |
66 Dy 2 10 - - |
67 Ho 2 11 - - |
68 Er 2 12 - - |
69 Tm 2 13 - - |
70 Yb 2 14 - - |
71 Lu 2 14 1 - |
72 Hf 2 14 2 - |
73 Ta 2 14 3 - |
74 W 2 14 4 - |
75 Re 2 14 5 - |
76 Os 2 14 6 - |
77 Ir 2 14 7 - |
78 Pt 1 14 9 - |
79 Au 1 14 10 - |
80 Hg 2 14 10 - |
81 Tl 2 14 10 1 |
82 Pb 2 14 10 2 |
83 Bi 2 14 10 3 |
84 Po 2 14 10 4 |
85 At 2 14 10 5 |
86 Rn 2 14 10 6 | |
| [Rn] 7s: 5f: 6d: 7p: |
87 Fr 1 - - - |
88 Ra 2 - - - |
89 Ac 2 - 1 - |
90 Th 2 - 2 - |
91 Pa 2 2 1 - |
92 U 2 3 1 - |
93 Np 2 4 1 - |
94 Pu 2 6 - - |
95 Am 2 7 - - |
96 Cm 2 7 1 - |
97 Bk 2 9 - - |
98 Cf 2 10 - - |
99 Es 2 11 - - |
100 Fm 2 12 - - |
101 Md 2 13 - - |
102 No 2 14 - - |
103 Lr 2 14 - 1 |
104 Rf 2 14 2 - |
105 Db 2 14 3 - |
106 Sg 2 14 4 - |
107 Bh 2 14 5 - |
108 Hs 2 14 6 - |
109 Mt 2 14 7 - |
110 Ds 2 14 8 - |
111 Rg 2 14 9 - |
112 Cn 2 14 10 - |
113 Nh 2 14 10 1 |
114 Fl 2 14 10 2 |
115 Mc 2 14 10 3 |
116 Lv 2 14 10 4 |
117 Ts 2 14 10 5 |
118 Og 2 14 10 6 | |
|
| |||||||||||||||||||||||||||||||||
বৈচিত্র
[সম্পাদনা]পিরিয়ড ১
[সম্পাদনা]যদিও আধুনিক পর্যায় সারণি বর্তমানে স্ট্যান্ডার্ড হিসেবে ব্যবহৃত হয়, পিরিয়ড ১ এর উপাদান হাইড্রোজেন ও হিলিয়ামের স্থান নিয়ে বিতর্ক থেকেই যায় এবং তাতে কিছু বৈচিত্র্য দেখা যায়। এদের ক্রমিক s1 এবং s2 ইলেকট্রন বিন্যাস অনুযায়ী, হাইড্রোজেনকে গ্রুপ ১ এ এবং হিলিয়ামকে গ্রুপ ২ এ স্থাপন করা যেতে পারে। হাইড্রোজেনের জন্য গ্রুপ ১ এ স্থাপন অধিক প্রচলিত। তবে হিলিয়ামকে প্রায় সবসময় অন্যান্য নিষ্ক্রিয় গ্যাসের সাথে গ্রুপ ১৮ তে রাখা হয়। এই বিতর্কের মূল কারণ হলো পর্যায় সারণিতে উপাদানের স্থানীয়করণে রাসায়নিক বৈশিষ্ট্যের প্রাধান্য নাকি ইলেকট্রন বিন্যাসের প্রাধান্য - এই বিষয়ে ভিন্নধর্মী বোধগম্যতার সংঘাত।
গ্রুপ ১ এর মৌলগুলোর মতোই, হাইড্রোজেনের বহিঃস্থ কক্ষপথে একটি মাত্র ইলেকট্রন থাকে এবং বিক্রিয়ায় সাধারণত এই একটি ইলেকট্রনই ত্যাগ করে। হাইড্রোজেন কিছু ধাতুর লবণ থেকে সেই ধাতুগুলোকে অপসারণ করতে পারে, যা ধাতব বৈশিষ্ট্যের লক্ষণ। তবে আদর্শ অবস্থায় এটি একটি দ্বি-পরমাণুক অধাতব গ্যাস, যা ক্ষার ধাতুগুলোর মতো কঠিন নয়। হাইড্রোজেন যখন হাইড্রাইড গঠন করে তখন একটি ইলেকট্রন গ্রহণ করে, যা একে হ্যালোজেন মৌলগুলোর কাছাকাছি নিয়ে যায়। তবে হাইড্রোজেনের H− গঠনের প্রবণতা H+ গঠনের তুলনায় অনেক কম। উপরন্তু, হালকা হ্যালোজেনসমূহের (ফ্লোরিন ও ক্লোরিন) মতোই আদর্শ অবস্থায় হাইড্রোজেনও গ্যাসীয়। হাইড্রোজেনের কিছু বৈশিষ্ট্য দুই গ্রুপের সাথেই পুরোপুরি খাপ খায় না। এটি উচ্চমাত্রায় জারক বা বিজারক কোনটিই নয় এবং পানির সাথেও বিক্রিয়া করে না। সুতরাং, হাইড্রোজেনের বৈশিষ্ট্য ক্ষার ধাতু এবং হ্যালোজেন - উভয়ের সাথেই মেলে, কিন্তু কোনোটির সাথেই পুরোপুরি খাপ খায় না। তাই, এর রাসায়নিক বৈশিষ্ট্যের ভিত্তিতে পর্যায় সারণিতে একে সঠিকভাবে স্থান দেওয়া কঠিন। যদিও ইলেকট্রনের বিন্যাস অনুযায়ী হাইড্রোজেনকে গ্রুপ ১ এ রাখাই প্রচলিত, কিছু বিরল সারণিতে হয় একে গ্রুপ ১৭ তে দেখানো হয়, নয়তো গ্রুপ ১ ও ১৭ উভয়েই, অথবা সমস্ত গ্রুপ থেকে আলাদা করে ভাসমান অবস্থায়। রসায়নবিদ ও বিজ্ঞান দার্শনিক এরিক সেরি এই শেষ অপশনটির সমালোচনা করেছেন এই যুক্তিতে যে, এটি পর্যায় সারণির নিয়মের উর্ধ্বে হাইড্রোজেনকে স্থাপন করে, যা অন্য কোনো মৌলের জন্য প্রযোজ্য নয়।
পর্যায় সারণিতে হিলিয়াম হলো এমন একটি মৌল যার অবস্থান নিয়ে বিতর্ক রয়েছে। এর কারণ এর ইলেকট্রন বিন্যাস অন্যান্য মৌলের তুলনায় ভিন্ন। হিলিয়ামের সর্ববহিঃস্থ কক্ষপথে দুটি ইলেক্ট্রন রয়েছে, যেখানে অন্যান্য নিষ্ক্রিয় গ্যাসের (Noble Gas) আটটি করে থাকে। তাছাড়া, এটি একটি s-block মৌল যখন বাকি নিষ্ক্রিয় গ্যাসগুলো p-block এ অবস্থিত। তবে মৌলটি সাধারণ পরিস্থিতিতে নিষ্ক্রিয়। এর সর্ববহিঃস্থ কক্ষপথটি পূর্ণ, যা গ্রুপ ১৮-এর নিষ্ক্রিয় গ্যাসগুলোর সাথে মিলে যায়। অপরদিকে গ্রুপ ২-এর ক্ষারীয় মৃৎ ধাতুগুলোর বৈশিষ্ট্যের সাথে হিলিয়ামের কোনো মিল নেই। এই কারণগুলির জন্য, হিলিয়ামকে প্রায় সর্বজনীনভাবে গ্রুপ ১৮-এ রাখা হয় যেখানে এর বৈশিষ্ট্যগুলি সবচেয়ে ভালোভাবে মেলে। ১৯৮৮ সালে IUPAC হিলিয়ামকে গ্রুপ ২ তে স্থানান্তর করার একটি প্রস্তাব প্রত্যাখ্যান করে। তবুও, হিলিয়ামকে মাঝে মধ্যে গ্রুপ ২-এ রাখা হয়। এর কিছু ভৌত এবং রাসায়নিক বৈশিষ্ট্য গ্রুপ ২-এর মৌলের কাছাকাছি এবং এর ইলেকট্রনিক বিন্যাসের সাথে মিলে যায়। উদাহরণস্বরূপ, কঠিন হিলিয়াম ষড়ভুজাকার কাঠামো তৈরি করে, যা গ্রুপ ২-এর বেরিলিয়াম এবং ম্যাগনেসিয়ামের মতো কিন্তু গ্রুপ ১৮-এর অন্যান্য নিষ্ক্রিয় গ্যাসগুলির মতো নয়। সাম্প্রতিক তাত্ত্বিক অগ্রগতি দ্বারা দেখানো হয় যে হিলিয়াম নিয়নের তুলনায় সামান্য কম নিষ্ক্রিয় এবং (HeO)(LiF)2 গঠন করতে পারে, যার বিন্যাস বেরিলিয়ামের সাথে সমরূপ। এটি ইলেকট্রনিক বিন্যাস ব্যাখ্যা করে, যেহেতু নিয়ন এমন একটি পূর্ণ p-শেল থেকে বিকর্ষণ অনুভব করে যা হিলিয়ামের নেই। যদিও এটা মনে রাখা গুরুত্বপূর্ণ যে হিলিয়াম সম্বলিত অণুগুলি হয়তো চরম নিম্ন তাপমাত্রার (প্রায় ১০ কেলভিন) বাইরে স্থিতিশীল হবে না। পর্যায় সারণির প্রথম কাতারে যেসব মৌলের অবস্থান তাদের জন্য 'প্রথম-স্তরের অস্বাভাবিকতা' বলা হয়। এই ঘটনা ঘটে কারণ যেকোনো কক্ষপথের প্রথম স্তরটি অস্বাভাবিকভাবে ছোট। এর বড় কারণ হলো কক্ষপথটি একই ধরণের ছোট অরবিটাল থেকে আন্তঃইলেকট্রন বিকর্ষণ অনুভব করে না। এটি প্রতিটি ব্লকের প্রথম কাতারের মৌলকে করে তোলে অস্বাভাবিকভাবে ছোট, এবং এই ধরনের মৌলগুলি তাদের গ্রুপের জন্য আলাদা ধরনের বৈশিষ্ট্য প্রদর্শন করে। হিলিয়ামকে গ্রুপ ২-এ স্থানান্তর করার পক্ষে যারা যুক্তি দেন তারা উল্লেখ করেছেন যে, সেখানে থাকলে হিলিয়াম এইসব বৈশিষ্ট্যগুলো দেখায়, কিন্তু যদি এটি গ্রুপ ১৮-এ স্থান পায় তবে তা করে না। অপরদিকে, নিয়ন এইসব বৈশিষ্ট্য প্রদর্শন করত যদি হিলিয়ামকে গ্রুপ ১৮ থেকে সরিয়ে নেওয়া হতো। এভাবে বলা যায় যে, হিলিয়াম এবং বেরিলিয়ামের মধ্যে সম্পর্ক তখন হাইড্রোজেন এবং লিথিয়ামের মধ্যকার সম্পর্কের মতোই হয়, যা অনেক বেশি গ্রহণযোগ্য। উদাহরণস্বরূপ পর্যায় সারণির ১ এবং ১৩-১৭ নম্বর গ্রুপে, প্রথম ও দ্বিতীয় মৌলের পারমাণবিক ব্যাসার্ধের মধ্যে বড় পার্থক্য আছে। এটি নিয়ন এবং আর্গনের মধ্যে, এবং হিলিয়াম এবং বেরিলিয়ামের মধ্যে বিদ্যমান, কিন্তু হিলিয়াম এবং নিয়নের মধ্যে নয়। এটি একইভাবে নিষ্ক্রিয় গ্যাসগুলির স্ফুটনাঙ্ক এবং জলে দ্রবণীয়তাকে প্রভাবিত করে, যেখানে হিলিয়াম নিয়নের খুব কাছাকাছি বৈশিষ্ট্য দেখায়। একটি গ্রুপের প্রথম দুটি মৌলের মধ্যে যে বড় পার্থক্য দেখা যায় তা নিয়ন এবং আর্গনের মধ্যেই দেখা যায়। হিলিয়ামকে গ্রুপ ২ তে স্থানান্তর করলে ২ এবং ১৮ গ্রুপে এই প্রবণতা সামঞ্জস্যপূর্ণ হবে। গ্রুপ ২-এ হিলিয়ামকে প্রথম মৌল এবং গ্রুপ ১৮-এ নিয়নকে প্রথম মৌল বানিয়ে দেয়। দুটি মৌলই তাদের গ্রুপের প্রথম মৌলের স্বতন্ত্র বৈশিষ্ট্য প্রদর্শন করে। তবে হিলিয়ামের চরম নিষ্ক্রিয়তার কারণে গ্রুপ ১৮-এ হিলিয়ামের স্থান প্রায় সার্বজনীনই রয়ে গেছে। এছাড়াও, এমন পর্যায় সারণিও পাওয়া যেতে পারে যেখানে হাইড্রোজেন এবং হিলিয়ামকে সব গ্রুপের বাইরে রাখা হয়েছে।
পিরিয়ড-১ এর সারসংক্ষেপ
[সম্পাদনা]পর্যায় সারণি উপাদানগুলিকে রাসায়নিক বৈশিষ্ট্যের ভিত্তিতে একটি সুশৃঙ্খল সারণিতে সজ্জিত করে। যদিও আধুনিক পর্যায় সারণি একটি আদর্শ রূপ, প্রথম পর্যায়ের উপাদান হাইড্রোজেন ও হিলিয়ামের অবস্থান নিয়ে বিতর্ক থেকেই যায়। এখানে কিছু বৈচিত্র্য লক্ষ্য করা যায়।
হাইড্রোজেন (H)
[সম্পাদনা]ইলেকট্রন বিন্যাস অনুযায়ী, হাইড্রোজেনকে গ্রুপ ১ এ রাখা যায়। আবার এর কিছু ধাতব বৈশিষ্ট্যের কারণে একে গ্রুপ ১৭ তেও স্থাপন করা হয়। গ্রুপ ১ এর মৌলের মতো হাইড্রোজেনের বহিঃস্তরে একটি ইলেক্ট্রন থাকে এবং রাসায়নিক বিক্রিয়ায় ইলেক্ট্রন ত্যাগ করে। এর কিছু ধাতব বৈশিষ্ট্যও আছে। অন্যদিকে হাইড্রোজেন হ্যালোজন গ্রুপের মৌলের মতো আচরণ করে ইলেকট্রন গ্রহণ করে হাইড্রাইড গঠন করে। যেহেতু হাইড্রোজেন উভয় গ্রুপের বৈশিষ্ট্যই প্রদর্শন করে, তাই পর্যায় সারণিতে এর অবস্থান নিয়ে বিতর্ক আছে। অনেক সময় হাইড্রোজেনকে কোন গ্রুপেই অন্তর্ভূক্ত না করে সারণির উপরে ভাসমান অবস্থায় দেখানো হয়।
হিলিয়াম (He)
[সম্পাদনা]ইলেকট্রন বিন্যাস অনুযায়ী, হিলিয়াম গ্রুপ ২ এর অন্তর্ভুক্ত হওয়া উচিত। কিন্তু এর নিষ্ক্রিয় গ্যাসীয় বৈশিষ্ট্য এবং বহিঃস্তরে সম্পূর্ণ ইলেকট্রন বিন্যাসের কারণে একে প্রায় সবসময় গ্রুপ ১৮ তে রাখা হয়। গ্রুপ ১৮ এর অন্যান্য নিষ্ক্রিয় গ্যাসের মতোই হিলিয়ামও রাসায়নিকভাবে নিষ্ক্রিয়। তবে এর কিছু ভৌত ও রাসায়নিক বৈশিষ্ট্য গ্রুপ ২ এর মৌলের কাছাকাছি। যেমন, কঠিন হিলিয়াম গ্রুপ ২ এর বেরিলিয়াম ও ম্যাগনেসিয়ামের মত হেক্সাগোনাল ক্লোজ প্যাকড কাঠামোতে কেলাসিত হয়। বিজ্ঞানীদের একটি অংশ এই যুক্তি উপস্থাপন করে হিলিয়ামকে গ্রুপ ২ তে রাখার পক্ষে রায় দিয়েছেন। তবে, অধিকাংশ ক্ষেত্রেই গ্রুপ ১৮ তেই হিলিয়ামের অবস্থান দেখা যায়।
পর্যায় সারণির এই বিতর্কিত দিকটি মৌলের ইলেকট্রন বিন্যাস এবং রাসায়নিক বৈশিষ্ট্যের মধ্যেকার একটি সূক্ষ্ম সম্পর্ক তুলে ধরে।
গ্রুপ ৩
[সম্পাদনা]অনেক পর্যায় সারণিতে, f-ব্লকটি এক ধাপ ডানদিকে সরানো হয়, ফলে ল্যান্থানাম এবং অ্যাক্টিনিয়াম গ্রুপ ৩ এ d-ব্লকের উপাদান হয়ে যায়। ফলস্বরূপ Ce–Lu এবং Th–Lr উপাদান f-ব্লক তৈরি করে, যার ফলে d-ব্লকটি দুটি অসম অংশে বিভক্ত হয়ে পড়ে। এটি ইলেকট্রন কনফিগারেশন পরিমাপ করার সময়কার ভুল ধারণা থেকে চলে আসছে। আধুনিক মাপকাঠিতে লুটেটিয়াম এবং লরেনসিয়ামকে গ্রুপ ৩, এবং La–Yb এবং Ac–No কে f-ব্লক উপাদান হিসেবে গণ্য করা হয়।
ইটারবিয়ামের ক্ষেত্রে 4f শেল সম্পূর্ণরূপে পূর্ণ থাকে। এই কারণেই ১৯৪৮ সালে লেভ ল্যান্ডাউ এবং ইয়েভজেনি লিফশিটজ লুটেটিয়ামকে f-ব্লকের উপাদান হিসেবে মেনে নিতে পারেননি। যদিও তারা এটাও বুঝতে পেরেছিলেন যে, ল্যান্থানামকে d-ব্লক থেকে সরানো উচিত। ১৯৬৩ সালে জুন কনডো উপলব্ধি করেন যে ল্যান্থানামের নিম্ন-তাপমাত্রার অতিপরিবাহিতা এর 4f শেলের সক্রিয়তা নির্দেশ করে। পরবর্তীতে, ১৯৬৫ সালে ডেভিড সি. হ্যামিলটন এই পর্যবেক্ষণকে পর্যায় সারণীতে ল্যান্থানামের অবস্থানের সাথে যুক্ত করে দাবি করেন যে, La–Yb এবং Ac–No এই উপাদানগুলোই f-ব্লক গঠনে সক্ষম। তখন থেকেই, বিভিন্ন ভৌত, রাসায়নিক এবং ইলেকট্রনিক প্রমাণ এই সংযোজনকেই সমর্থন করে আসছে। ১৯৮২ সালে উইলিয়াম বি. জেনসেন বিষয়টি ব্যাপক আলোচনার মুখে নিয়ে আসেন, এবং ১৯৮৮ (১-১৮ গ্রুপের নামকরণের সময়) এবং ২০২১ সালে IUPAC -এর প্রতিবেদনে লুটেটিয়াম এবং লরেনসিয়ামকে গ্রুপ ৩ -এ পুনঃনির্ধারণের বিষয়টি সমর্থিত হয়। তারপরও পাঠ্যপুস্তকগুলোতে এই পুরনো ধারণাই প্রচলিত, যেহেতু বেশিরভাগ লেখক এই পরিবর্তন সম্পর্কে ওয়াকিবহাল নন।
তৃতীয় গ্রুপে ইট্রিয়ামের (Y) নিচের সারিতে থাকা মৌল নিয়ে বেশ কিছু বিতর্ক আছে। আইইউপিএসি'র ওয়েবসাইটে একটি কাঠামো আছে যেখানে ইট্রিয়ামের নিচের স্থান দুটি খালি রাখা হয়েছে। এই কাঠামোটি কোয়ান্টাম মেকানিক্সের সাথে অসঙ্গতিপূর্ণ কারণ তত্ত্ব অনুযায়ী f-ব্লকে সর্বোচ্চ ১৪টি ইলেকট্রন থাকতে পারে, কিন্তু এই কাঠামোতে f-ব্লককে ১৫টি মৌল (La–Lu and Ac–Lr) সম্বলিত দেখানো হয়। এর ফলে সাহিত্যেও তৃতীয় গ্রুপের মৌল নিয়ে কিছুটা দ্বিধাদ্বন্দ্ব দেখা যায়। ২০২১ সালের একটি আইইউপিএসি প্রতিবেদন অনুসারে f-ব্লকে ১৫টি মৌলের ধারণাকে আপেক্ষিক কোয়ান্টাম মেকানিক্সের বিশেষ শাখায় সমর্থন করা হয়, যেখানে অতিভারী মৌলসমূহের বৈশিষ্ট্য নিয়ে আলোচনা করা হয়। তবে লেখকরা মনে করেন যে, সাধারণ রাসায়নিক ও বৈজ্ঞানিক সম্প্রদায়ের কাছে পর্যায় সারণি উপস্থাপনের সময় এই বিশেষ ক্ষেত্রের স্বার্থ-সংশ্লিষ্ট বিষয়াদির প্রভাব থাকা উচিত নয়। অতিভারী মৌল নিয়ে কাজ করা কিছু লেখক স্পষ্ট করেছেন যে, f-ব্লকের "১৫তম স্থান" আসলে d-ব্লকের প্রথম স্থান, যা খালি রাখা হয় f-ব্লকের অবস্থান নির্দেশ করার জন্য। এর মানে হলো এই কাঠামোতে লুটেসিয়াম (Lu) এবং লরেনসিয়াম (Lr) d-ব্লকের মৌল হিসেবে তৃতীয় গ্রুপে থাকবে। আসলে, আইইউপিএসি প্রকাশনায় যখন পর্যায় সারণিকে ৩২ কলামে প্রসারিত করা হয়, তখন লুটেসিয়াম এবং লরেনসিয়ামকে স্পষ্টভাবে ইট্রিয়ামের নিচে তৃতীয় গ্রুপে স্থাপন করা হয়।
সাহিত্যে Sc-Y-La-Ac কাঠামোর পক্ষে কিছু যুক্তি দেখা যায়, কিন্তু সেগুলিকে যুক্তিগতভাবে অসামঞ্জস্যপূর্ণ হিসেবে চ্যালেঞ্জ করা হয়েছে। উদাহরণস্বরূপ, একটি যুক্তিতে বলা হয় যে, গ্যাসীয় অবস্থায় ল্যান্থানাম (La) ও অ্যাক্টিনিয়াম (Ac) মৌলদুটির f-সাবশেল ইলেক্ট্রন দ্বারা পূর্ণ হতে শুরু করে না, তাই এদেরকে f-ব্লকের মৌল বলা যায় না। কিন্তু একই কথা থোরিয়ামের (Th) ক্ষেত্রেও সত্য, যাকে কখনো f-ব্লকের বাইরে রাখা নিয়ে প্রশ্ন তোলা হয় না। এছাড়া, সমস্যা দেখা যায় অন্যপ্রান্তেও: f-শেলের ইলেকট্রন পূরণ সম্পন্ন হয় ইটারবিয়াম (Yb) এবং নোবেলিয়ামে (No) যেটা Sc-Y-Lu-Lr কাঠামোর সাথে মেলে, Sc-Y-La-Ac না। বাস্তবে এইসব ব্যতিক্রমী ইলেকট্রন বিন্যাস সংখ্যালঘু। আর এগুলোর ভিত্তিতে পর্যায় সারণির অন্য কোনো মৌলের অবস্থান নির্ধারণ করা হয় না। গ্যাসীয় পরমাণুতে কপার (Cu), প্যালাডিয়াম (Pd), ও সোনায় (Au) d-শেলের ইলেকট্রন পূরণ সম্পন্ন হয়। কিন্তু রসায়নবিদদের কাছে এটা সর্বজনস্বীকৃত যে এগুলো ব্যতিক্রমী কনফিগারেশন এবং ম্যাডেলুং নিয়ম অনুসারে d-ব্লক আসলে দস্তা (Zn), ক্যাডমিয়াম (Cd), এবং পারদে (Hg) শেষ হয়। পর্যায় সারণিতে অবস্থানের জন্য গুরুত্বপূর্ণ তথ্য হলো, ল্যান্থানাম ও অ্যাক্টিনিয়ামের (থোরিয়ামের মতো) যোজনী f-অরবিটাল রয়েছে যেগুলো রাসায়নিক পরিবেশে অধিকৃত হতে পারে। অন্যদিকে লুটেসিয়াম ও লরেনসিয়ামের ক্ষেত্রে সেটা হয় না। তাদের f-শেল মৌলের কেন্দ্রে থাকে এবং রাসায়নিক বিক্রিয়ায় অংশ নিতে পারে না। তাই ইট্রিয়াম ও ল্যান্থানামের সম্পর্কটা, ক্রোমিয়াম ও ইউরেনিয়ামের মধ্যকার মতো গৌণ। তারা যোজনী ইলেকট্রনের সংখ্যায় মিলে যায়, কিন্তু যোজনী অরবিটালের ধরন ভিন্ন। অপরদিকে, ইট্রিয়াম ও লুটেসিয়ামের মধ্যকার সম্পর্ক প্রাথমিক, কারণ তারা যোজনী ইলেকট্রন সংখ্যা এবং যোজনী অরবিটালের ধরন - উভয়ক্ষেত্রেই মিলে যায়।
পর্যায় সারণির প্রবণতা
[সম্পাদনা]যেহেতু রাসায়নিক বিক্রিয়াগুলোতে যোজনী ইলেকট্রনের ভূমিকা থাকে, তাই একই রকম বহিঃস্থ ইলেকট্রন বিন্যাসধারী মৌলগুলোর বিক্রিয়াও অনুরূপ হতে পারে। এছাড়া, তারা একই অনুপাতে অন্যান্য মৌলের সাথে যুক্ত হয়ে যৌগ গঠন করে। এমন মৌলগুলোকে পর্যায় সারণির একই গ্রুপে স্থান দেওয়া হয়। তাই একটি গ্রুপের উপর থেকে নিচের দিকে গেলে রাসায়নিক আচরণে মিল ও প্রবণতা দেখা যায়। একই রকম ইলেকট্রন বিন্যাস নিয়মিত বিরতিতে পাওয়া যায় বলে, মৌলগুলোর ধর্মগুলোতেও প্রবণতা লক্ষ্য করা যায়। এজন্যই এর নাম পর্যায় সারণি (Periodic Table) এবং এখানকার নিয়মকে পর্যাবৃত্ততা নিয়ম (Periodic Law) বলা হয়। এই পর্যাবৃত্ততা লক্ষ্য করা হয়েছিল অনেক আগেই, যখন এদের পেছনের তত্ত্ব সম্পর্কে আমরা জানতাম না।
পারমাণবিক ব্যাসার্ধ
[সম্পাদনা]ঐতিহাসিকভাবে, বিংশ শতাব্দীর গোড়ার দিকে পর্যন্ত পরমাণুর আসল আকার জানা ছিল না। হাইড্রোজেনের পারমাণবিক ব্যাসার্ধের প্রথম গণনা করা অনুমান প্রকাশ করেছিলেন পদার্থবিজ্ঞানী আর্থার হাস ১৯১০ সালে। গৃহীত মানের অর্থাৎ বোর ব্যাসার্ধের (~0.529 Å) এককের দশগুনের মধ্যেই ছিল হাসের গণনা। জে জে থমসন ১৯০৪ সালে তাঁর মডেলে একটি একক-ইলেক্ট্রন কনফিগারেশন ব্যবহার করেছিলেন, যা "প্লাম-পুডিং মডেল" নামেও পরিচিত। সেই মডেলের উপর ভিত্তি করেই হাস তার গণনা করেছিলেন।
পারমাণবিক ব্যাসার্ধ (পরমাণুর আকার) নির্ভর করে কক্ষপথের বাহিরের স্তরের আকারের উপর। সাধারণত, পর্যায় সারণির মূল-গ্রুপের বাম দিক থেকে ডান দিকে গেলে পারমাণবিক ব্যাসার্ধ হ্রাস পায়, কারণ নিউক্লিয়ার চার্জ বাড়তে থাকে, কিন্তু বাইরের ইলেকট্রনগুলি একই শেলে অবস্থান করে। যাইহোক, কোন কলামে উপর থেকে নীচে নামলে ব্যাসার্ধ সাধারণত বৃদ্ধি পায়, কারণ সবচেয়ে বাইরের ইলেকট্রনগুলি আরও উঁচু শেলে অবস্থান করে, সেগুলো নিউক্লিয়াস থেকে আরও দূরে থাকে। ব্লকের প্রতিটি সারির প্রথম সারটি অস্বাভাবিকভাবে ছোট, এটি একটি প্রভাব যার নাম কাইনোসিমেট্রি বা প্রাইমোজেনিক বিকর্ষণ (kainosymmetry or primogenic repulsion): 1s, 2p, 3d এবং 4f উপস্তরের অভ্যন্তরীণ কোনও অ্যানালগ নেই। উদাহরণস্বরূপ, 2p কক্ষপথগুলি 1s এবং 2s কক্ষপথ থেকে শক্তিশালী বিকর্ষণ অনুভব করে না, এদের সম্পূর্ণ ভিন্ন কৌণিক চার্জ বন্টন রয়েছে, এবং তাই এগুলি খুব বড় হয় না; তবে 3p কক্ষপথগুলি 2p অরবিটাল থেকে শক্তিশালী বিকর্ষণ অনুভব করে, যাদের একইরকম কৌণিক চার্জ বন্টন রয়েছে। এই কারণেই উচ্চতর s-, p-, d-, এবং f- উপস্তরে তাদের অভ্যন্তরীণ অ্যানালগগুলি থেকে শক্তিশালী বিকর্ষণ অনুভব হয় এবং সেই বিকর্ষণ এড়াতে এদের প্রসারিত হতে হয়। এটি ছোট 2p এলিমেন্টগুলির মধ্যে উল্লেখযোগ্য পার্থক্য তৈরি করে, যারা একাধিক বন্ধন পছন্দ করে (multiple bonding) এবং বড় 3p এবং উচ্চতর p-এলিমেন্টগুলির মধ্যে এমন পার্থক্য তৈরি করে যারা একাধিক বন্ধন পছন্দ করে না। একই রকম ঘটনা ঘটে 1s, 2p, 3d, 4f এবং কাল্পনিক 5g এলিমেন্টগুলির মধ্যে। এই প্রথম সারির ঘটনার মাত্রা s- ব্লকে সর্বোচ্চ, p- ব্লকে মাঝারি এবং d- এবং f- ব্লকে কম প্রকট।
সংক্রমণ মৌলসমূহে (পরিবর্তনশীল মৌল), একটি ভিতরের শক্তিস্তর ইলেকট্রন দ্বারা পূর্ণ হয়। তবে, পরমাণুর আকার এখনও বাইরের ইলেকট্রন দ্বারা নির্ধারিত হয়। সারির বিভিন্ন পরমাণুর ক্রমবর্ধমান নিউক্লীয় চার্জ এবং অভ্যন্তরীণ ইলেকট্রনসমূহের সংখ্যা বৃদ্ধি পরস্পরকে কিছুটা ক্ষতিপূরণ দেয়। ফলে, পরমাণুর ব্যাসার্ধ যতটুকু কম হওয়া উচিত ছিল তার থেকে কিছুটা বড়ই থেকে যায়। যখনই সংক্রমণ মৌলের নতুন ধারার সূচনা হয়, তৎক্ষণাৎ পরবর্তী 4p এবং 5d পরমাণুগুলি প্রত্যাশার চেয়ে ছোট হয়। এর কারণ হল যুক্ত হওয়া মূল 3d এবং 4f উপস্তরগুলি বাইরের ইলেকট্রনগুলির জন্য নিউক্লিয় চার্জের বিরুদ্ধে শুধুমাত্র আংশিকভাবে রক্ষাকারী ঢাল হিসেবে কাজ করে। তাই, উদাহরণস্বরূপ, গ্যালিয়াম পরমাণু অ্যালুমিনিয়াম পরমাণুর চেয়ে সামান্য ছোট। 'কাইনোসিমেট্রি'র সাথে মিলিত হয়ে এর ফলে পর্যায়গুলিতে সম-বিজোড় পার্থক্য তৈরি হয় (s-ব্লক ব্যতীত)। একে কখনও কখনও গৌণ পর্যায়ক্রম বলা হয়। সম-পর্যায়ের মৌলগুলির পারমাণবিক ব্যাসার্ধ ছোট হয় এবং সেগুলি কম ইলেকট্রন বর্জন করে। অন্যদিকে বিজোড়-পর্যায়ের মৌলগুলি (প্রথম পর্যায় ব্যতীত) বিপরীতভাবে আচরণ করে। উদাহরণস্বরূপ, p-ব্লকের অনেক বৈশিষ্ট্য গ্রুপটি বরাবর মসৃণ ধারার পরিবর্তে একটি জিগজ্যাগ পথ দেখায়। বিজোড় পর্যায়ের 15 নং গ্রুপের ফসফরাস এবং অ্যান্টিমনি সহজে +5 জারণ অবস্থায় পৌঁছে যায়। কিন্তু, সম-পর্যায়ের নাইট্রোজেন, আর্সেনিক এবং বিসমাথ +3 জারণ অবস্থাতেই থাকতে পছন্দ করে। d-ব্লকেও একই রকম পরিস্থিতি দেখা যায়। মল্বিডেনাম পরমাণুর তুলনায় ইট্রিয়াম পরমাণু বড়, আবার লুটেটিয়াম পরমাণু টাংস্টেন পরমাণুর তুলনায় সামান্য ছোট।

থ্যালিয়াম এবং সীসার পরমাণুর আকার প্রায় ইন্ডিয়াম ও টিনের সমান হলেও, বিসমাথ থেকে রেডন পর্যন্ত 6p পরমাণুগুলো তুলনামূলকভাবে 5p পরমাণুর থেকে বড়। এর কারণ হলো যখন পরমাণুর নিউক্লিয়াস উচ্চমাত্রায় আধানপ্রাপ্ত হয়, তখন নিউক্লিয়াসের ইলেকট্রন ক্লাউডের উপর প্রভাব বুঝতে বিশেষ আপেক্ষিকতা তত্ত্বের (special relativity) সাহায্য নিতে হয়। আপেক্ষিকতার এই প্রভাব ভারী মৌলগুলিকে পর্যায় সারণির হালকা মৌলের তুলনায় ক্রমবর্ধমানভাবে আলাদা বৈশিষ্ট্য প্রদান করে। স্পিন-অরবিট মিথস্ক্রিয়া (Spin–orbit interaction) p-সাবশেলকে বিভক্ত করে দেয়: একটি p-অরবিটাল আপেক্ষিকতার প্রভাবে স্থিতিশীল হয় ও সঙ্কুচিত হয়ে যায় (এটা থ্যালিয়াম ও সীসাতে পূর্ণ হয়), অপর দুটি অরবিটাল (যেগুলি বিসমাথ থেকে রেডন পর্যন্ত পূর্ণ হয়) সেগুলো আপেক্ষিকভাবে অস্থিতিশীল হয় এবং প্রসারিত হয়। আপেক্ষিকতা প্রভাব এটাও ব্যাখ্যা করে কেন সোনার রং সোনালী এবং পারদ কক্ষতাপমাত্রায় তরল অবস্থায় থাকে। পর্যায় সারণির সপ্তম পর্যায়ের শেষের দিকে আপেক্ষিকতা প্রভাব আরও তীব্র হতে পারে, যার কারণে পর্যায়বৃত্ততার একটি বিপর্যয় হতে পারে । ইলেকট্রন বিন্যাস শুধুমাত্র ১০৮ নম্বর মৌল (হ্যাসিয়াম) পর্যন্ত পরিষ্কারভাবে বোঝা যায়। ১০৮ এর পরের মৌল নিয়ে পরীক্ষামূলক রসায়ন শুধুমাত্র ১১২ (কোপারনিসিয়াম), ১১৩ (নিহোনিয়াম), এবং ১১৪ (ফ্লেরোভিয়াম) পর্যন্ত করা হয়েছে। তাই, ভারী মৌলগুলোর রাসায়নিক বৈশিষ্ট্য এখনো বর্তমান গবেষণার একটি বিষয়।
পারমাণবিক ব্যাসার্ধ পর্যায় সারণির বাম থেকে ডানে ক্রমান্বয়ে হ্রাস পায়। আয়নিক ব্যাসার্ধের ক্ষেত্রেও একই প্রবণতা দেখা যায়, তবে পরপর উপাদানের সবচেয়ে সাধারণ আয়নগুলি সাধারণত চার্জের দিক থেকে আলাদা হয় বলে তুলনা করাটা বেশ কঠিন হয়ে পড়ে।
- একই ইলেকট্রন বিন্যাসের আয়ন: যেসব আয়নের ইলেকট্রন বিন্যাস একই, সেক্ষেত্রে পারমাণবিক সংখ্যা বৃদ্ধির সাথে সাথে এদের আকার হ্রাস পায়। এর কারণ, ধনাত্মক চার্জযুক্ত নিউক্লিয়াসের আকর্ষণ বৃদ্ধিপ্রাপ্ত হয়। উদাহরণস্বরূপ, Se2−, Br−, Rb+, Sr2+, Y3+, Zr4+, Nb5+, Mo6+, Tc7+ এর ক্রমে আয়নিক ব্যাসার্ধ হ্রাস পায়।
- একই উপাদানের আয়ন: একটি নির্দিষ্ট উপাদানের একাধিক আয়ন থাকতে পারে। যত বেশি ইলেকট্রন অপসারিত হবে, আয়নের আকার ততই ছোট হয়ে যাবে। কারণ, নিউক্লিয়াসের আকর্ষণ ইলেকট্রনগুলোর মধ্যকার বিকর্ষণের চেয়ে বেশি প্রভাবশালী হয়ে ওঠে, যার ফলে ইলেকট্রন মেঘ সংকুচিত হয়। উদাহরণস্বরূপ, V2+, V3+, V4+, V5+ এর ক্রমানুসারে আয়নিক ব্যাসার্ধ হ্রাস পায়।
আয়নীকরণ শক্তি
[সম্পাদনা]
একটি পরমাণুর প্রথম আয়নীকরণ শক্তি বলতে বোঝায়, একটি পরমাণু থেকে একটি ইলেকট্রন অপসারণ করতে যে পরিমাণ শক্তির প্রয়োজন হয়। পরমাণুর ব্যাসার্ধের সাথে আয়নীকরণ শক্তির পরিবর্তন হয়: বাম থেকে ডানে এবং নিচ থেকে উপরে আয়নীকরণ শক্তি বৃদ্ধি পায়, কারণ নিউক্লিয়াসের কাছাকাছি থাকা ইলেকট্রনগুলি আরও শক্তভাবে আবদ্ধ থাকে এবং এদের অপসারণ করা আরও কঠিন হয়। এই কারণে, প্রতিটি পর্যায়ের প্রথম মৌলে - হাইড্রোজেন এবং ক্ষার ধাতুতে আয়নীকরণ শক্তি সবচেয়ে কম হয়। এরপর এই শক্তি বাড়তে থাকে এবং পর্যায়ের শেষে অবস্থিত নিষ্ক্রিয় গ্যাসের ক্ষেত্রে সর্বোচ্চ পরিমাণে পৌঁছায়। এই প্রবণতায় কিছু ব্যতিক্রম রয়েছে, যেমন অক্সিজেন, যেখানে অপসারিত ইলেকট্রনটি জোড়যুক্ত (paired) থাকে এবং তাই আন্তঃইলেকট্রন বিকর্ষণের (interelectronic repulsion) কারণে প্রত্যাশিত চেয়ে সহজে অপসারণ করা যায়।
ট্রানজিশন শ্রেণিতে, অভ্যন্তরীণ অরবিটাল পূরণ হওয়া সত্ত্বেও বাইরের ইলেকট্রনগুলিই অগ্রাধিকারের সাথে অপসারিত হয়। উদাহরণস্বরূপ, 3d শ্রেণিতে, 3d অরবিটাল পূরণ হচ্ছে, কিন্তু 4s ইলেকট্রনগুলি আগে অপসারিত হয়। একটি অতিরিক্ত 3d ইলেকট্রন যোগ করার শিল্ডিং প্রভাব পারমাণবিক চার্জের বৃদ্ধিকে প্রায় ক্ষতিপূরণ করে দেয় এবং তাই আয়নীকরণ শক্তি বেশিরভাগ ক্ষেত্রেই ধ্রুব থাকে, যদিও প্রতিটি ট্রানজিশন ধারার শেষের দিকে এটি কিছুটা বৃদ্ধি পায়।
যেহেতু ধাতব পরমাণুগুলি রাসায়নিক বিক্রিয়ায় ইলেকট্রন হারাতে থাকে, তাই আয়নীকরণ শক্তি সাধারণত রাসায়নিক বিক্রিয়ার (chemical reactivity) সাথে সম্পর্কযুক্ত, যদিও এতে অন্যান্য বিষয়ও জড়িত রয়েছে।
ইলেকট্রন আসক্তি
[সম্পাদনা]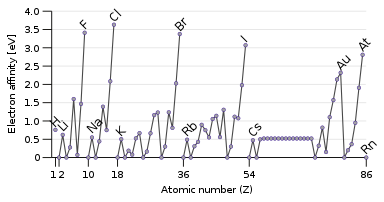
আয়নীকরণ শক্তির বিপরীত ধর্ম হলো ইলেকট্রন আসক্তি। এই ধর্মটি মূলত কোনো পরমাণুতে একটি ইলেকট্রন যোগ করার সময় যে শক্তি নির্গত হয় তাকেই নির্দেশ করে। পরমাণুর নিউক্লিয়াসের আকর্ষণ যত বেশি, ইলেকট্রনকে তত বেশি টান অনুভব করবে। বিশেষ করে যদি পরমাণুর কক্ষপথে আংশিক পূর্ণ শক্তিস্তর থাকে যেখানে ইলেকট্রনটি যুক্ত হতে পারে, তখন ইলেকট্রন আসক্তি বৃদ্ধি পায়। তাই, পর্যায় সারণির উপর থেকে নিচের দিকে এবং বাম থেকে ডান দিকে ইলেকট্রন আসক্তি বাড়তে থাকে। ব্যতিক্রম শুধু গ্রুপ ১৮-এর নিষ্ক্রিয় গ্যাসগুলো। এদের শেষ কক্ষপথ সম্পূর্ণ পূর্ণ হওয়ায় নতুন ইলেকট্রন ধারণের স্থান নেই। ফলশ্রুতিতে, পর্যায় সারণির গ্রুপ ১৭-এর হ্যালোজেনসমূহ সর্বোচ্চ ইলেকট্রন আসক্তি প্রদর্শন করে।
নিষ্ক্রিয় গ্যাসের মতো কিছু পরমাণুর শূন্য ইলেকট্রন আসক্তি থাকে; তারা স্থিতিশীল গ্যাস-দশার অ্যানায়ন (ঋণাত্মক আয়ন) গঠন করে না। নিষ্ক্রিয় গ্যাসের আয়নীকরণ শক্তি উচ্চ এবং ইলেকট্রন আসক্তি নেই, সেজন্য এরা ইলেকট্রন গ্রহণ বা বর্জন করতে আগ্রহী হয় না, ফলে সাধারণত নিষ্ক্রিয় থাকে।
তবে কিছু ব্যতিক্রমও আছে: অক্সিজেন ও ফ্লোরিনের ইলেকট্রন আসক্তি তাদের পরের মৌল সালফার ও ক্লোরিনের চেয়ে কম। এর কারণ অক্সিজেন ও ফ্লোরিন খুবই ক্ষুদ্র পরমাণু; নতুন ইলেকট্রন আসলে আগে থেকে বর্তমান ইলেকট্রনগুলোর বিকর্ষণের মুখে পড়ে। অধাতব মৌলের ইলেকট্রন আসক্তি রাসায়নিক সক্রিয়তার সাথে কিছুটা সম্পর্কিত, তবে পুরোপুরি নয়। অন্যান্য কিছু কারণও জড়িত থাকে। যেমন, ফ্লোরিনের ইলেকট্রন আসক্তি ক্লোরিনের চেয়ে কম (ক্ষুদ্র আকারের কারণে বিকর্ষণ), তবে ফ্লোরিন ক্লোরিনের তুলনায় বেশি সক্রিয়।
যোজনী ও জারণ অবস্থা
[সম্পাদনা]কোনো মৌলের একটি পরমাণুর সাথে যতটি হাইড্রোজেন পরমাণু যুক্ত হয়ে সরল বাইনারি হাইড্রাইড গঠন করতে পারে, সেই সংখ্যাই ঐ মৌলটির যোজনী। এভাবে, কোনো মৌলের একটি পরমাণুর সাথে যতটি অক্সিজেন পরমাণু যুক্ত হয়ে সরল বাইনারি অক্সাইড (পারঅক্সাইড বা সুপারঅক্সাইড নয়) তৈরি করতে পারে, তার দ্বিগুণ সংখ্যাকেও ওই মৌলের যোজনী হিসেবে সংজ্ঞায়িত করা হয়। মূল-গ্রুপের মৌলগুলোর যোজনী সরাসরি গ্রুপ নম্বরের সাথে সম্পর্কিত। ১ম থেকে ২য় এবং ১৩শ থেকে ১৭শ গ্রুপের মৌলগুলোর হাইড্রাইডগুলোর সাধারণ সংকেত যথাক্রমে MH, MH2, MH3, MH4, MH3, MH2, এবং MH। অন্যদিকে, সর্বোচ্চ অক্সাইডগুলোর যোজনী বাড়তে থাকে এবং M2O, MO, M2O3, MO2, M2O5, MO3, M2O7 সংকেতগুলো মেনে চলে।
যোজনীর ধারণাটিকে আজকাল জারণ অবস্থার ধারণায় সম্প্রসারিত করা হয়েছে। কোনো যৌগ থেকে অন্য সকল মৌলকে আয়ন হিসেবে অপসারণ করলে যে আনুষ্ঠানিক (ফর্মাল) চার্জ অবশিষ্ট থাকে, সেটিই হলো ওই যৌগে ঐ মৌলের জারণ অবস্থা। ইলেকট্রন বিন্যাস যোজনীর একটি সহজ ব্যাখ্যা দেয়। ইলেকট্রন বিন্যাস থেকে যোজ্যতা ইলেকট্রনের সংখ্যা জানা যায়, যা বন্ধন গঠনে কাজে লাগে। পর্যায় সারণির ১ম গ্রুপের যোজ্যতা ইলেকট্রন ১ থেকে শুরু হয়ে ডান দিকে বাড়তে থাকে এবং প্রতিটি নতুন ব্লকের শুরুতে তা পুনরায় ৩ এ সেট হয়ে যায়। এভাবে, ষষ্ঠ পর্যায়ে Cs-Ba এর যোজ্যতা ইলেকট্রন ১-২টি, La-Yb এর ৩-১৬টি, Lu-Hg এর ৩-১২টি, এবং Tl-Rn এর ৩-৮টি। তবে, d -ব্লক ও f-ব্লকের ডান দিকে সকল যোজ্যতা ইলেকট্রন বন্ধনে ব্যবহারের সর্বোচ্চ তাত্ত্বিক সীমায় পৌঁছানো যায় না। অক্সিজেন, ফ্লোরিন এবং ক্রিপ্টন পর্যন্ত হালকা নিষ্ক্রিয় গ্যাসগুলোর ক্ষেত্রেও এটিই সত্য।
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H 1 |
He 2 | ||||||||||||||||||||||||||||||
| 2 | Li 1 |
Be 2 |
B 3 |
C 4 |
N 5 |
O 6 |
F 7 |
Ne 8 | ||||||||||||||||||||||||
| 3 | Na 1 |
Mg 2 |
Al 3 |
Si 4 |
P 5 |
S 6 |
Cl 7 |
Ar 8 | ||||||||||||||||||||||||
| 4 | K 1 |
Ca 2 |
Sc 3 |
Ti 4 |
V 5 |
Cr 6 |
Mn 7 |
Fe 8 |
Co 9 |
Ni 10 |
Cu 11 |
Zn 12 |
Ga 3 |
Ge 4 |
As 5 |
Se 6 |
Br 7 |
Kr 8 | ||||||||||||||
| 5 | Rb 1 |
Sr 2 |
Y 3 |
Zr 4 |
Nb 5 |
Mo 6 |
Tc 7 |
Ru 8 |
Rh 9 |
Pd 10 |
Ag 11 |
Cd 12 |
In 3 |
Sn 4 |
Sb 5 |
Te 6 |
I 7 |
Xe 8 | ||||||||||||||
| 6 | Cs 1 |
Ba 2 |
La 3 |
Ce 4 |
Pr 5 |
Nd 6 |
Pm 7 |
Sm 8 |
Eu 9 |
Gd 10 |
Tb 11 |
Dy 12 |
Ho 13 |
Er 14 |
Tm 15 |
Yb 16 |
Lu 3 |
Hf 4 |
Ta 5 |
W 6 |
Re 7 |
Os 8 |
Ir 9 |
Pt 10 |
Au 11 |
Hg 12 |
Tl 3 |
Pb 4 |
Bi 5 |
Po 6 |
At 7 |
Rn 8 |
| 7 | Fr 1 |
Ra 2 |
Ac 3 |
Th 4 |
Pa 5 |
U 6 |
Np 7 |
Pu 8 |
Am 9 |
Cm 10 |
Bk 11 |
Cf 12 |
Es 13 |
Fm 14 |
Md 15 |
No 16 |
Lr 3 |
Rf 4 |
Db 5 |
Sg 6 |
Bh 7 |
Hs 8 |
Mt 9 |
Ds 10 |
Rg 11 |
Cn 12 |
Nh 3 |
Fl 4 |
Mc 5 |
Lv 6 |
Ts 7 |
Og 8 |
শুধুমাত্র ইলেকট্রন বিন্যাসের উপর নির্ভর না করে, কোন মৌল ভিন্ন যোজনীতে যৌগ তৈরি করে তা ব্যাখ্যার সময় সেই যৌগ গঠনের ফলে যে শক্তির নির্গমন হয় তা বিবেচনায় নেওয়া প্রয়োজন। উদাহরণস্বরূপ, ম্যাগনেসিয়াম পানিতে দ্রবীভূত হলে Mg+ এর চেয়ে Mg2+ ক্যাটায়ন তৈরি করে, কারণ Mg+ স্বতঃস্ফূর্তভাবে Mg0 এবং Mg2+ ক্যাটায়নে পরিণত হতে চায়। এই ঘটনার কারণ হল, আয়নের চার্জ এবং ব্যাসার্ধের সাথে হাইড্রেশন এনথালপি (পানির অণু দ্বারা আয়নকে ঘিরে রাখা) বাড়তে থাকে। Mg+ আয়নে, বহিঃস্থ কক্ষপথটি (যা আয়নিক ব্যাসার্ধ নির্ধারণ করে) হল 3s, তাই হাইড্রেশন এনথালপি ছোট এবং একটি ইলেকট্রন অপসারণের জন্য প্রয়োজনীয় শক্তিকে ক্ষতিপূরণের জন্য অপর্যাপ্ত; তবে পুনরায় Mg2+ এ আয়নিত হলে ভেতরের 2p উপকক্ষটি প্রকাশিত হয়, ফলে হাইড্রেশন এনথালপি যথেষ্ট বড় হয় যা ম্যাগনেসিয়াম(II) যৌগ গঠনে সহায়তা করে। একই কারণে, ভারী p-ব্লক মৌলগুলির সাধারণ জারণ অবস্থাও (যেখানে ns ইলেকট্রনগুলি np এর চেয়ে শক্তিতে নিম্নগামী হয়) ২ পরপর বৃদ্ধি পেতে থাকে। এর কারণ হল একটি অভ্যন্তরীণ উপকক্ষ প্রকাশ এবং আয়নিক ব্যাসার্ধ হ্রাসের জন্য দুটি ইলেকট্রন অপসারণ করা প্রয়োজন (উদাহরণস্বরূপ, Tl+ 6s প্রকাশ করে, এবং Tl3+ 5d প্রকাশ করে, তাই থ্যালিয়াম একবার দুটি ইলেকট্রন হারালে এটি তৃতীয়টিও হারাতে চায়)। কম তড়িৎ ঋণাত্মক p-ব্লক মৌলগুলির জন্য কক্ষপথ সংকরণের উপর ভিত্তি করে অনুরূপ যুক্তি ব্যবহার করা যেতে পারে।

ট্রানজিশন ধাতুগুলোর (অবস্থান্তর/পরিবর্তনশীল মৌল) সাধারণ অক্সিডেশন অবস্থা (জারণ অবস্থা) প্রায় সবসময়ই +2 বা তার অধিক হয়, এর কারণ অনুরূপ (পরবর্তী সাবশেল উন্মোচিত করা)। এই প্রবণতা এমনকি ব্যতিক্রমী dx+1s1 বা dx+2s0 কনফিগারেশনযুক্ত ধাতুগুলির জন্যেও প্রযোজ্য (রুপা বাদে), কারণ d-ইলেকট্রনগুলির মধ্যকার বিকর্ষণের ফলে s- থেকে d-সাবশেলের দ্বিতীয় ইলেকট্রনের স্থানান্তর আয়নীকরণ শক্তিকে উল্লেখযোগ্যভাবে পরিবর্তন করে না। যেহেতু ট্রানজিশন ধাতুগুলিকে আরও আয়নিত করা কোনও নতুন অভ্যন্তরীণ সাবশেল প্রকাশ করে না, তাই তাদের অক্সিডেশন অবস্থা ক্রমান্বয়ে ১ ধাপ করে পরিবর্তিত হতে থাকে। ল্যান্থানাইড এবং শেষের দিকের অ্যাক্টিনাইডগুলি সাধারণত একটি স্থিতিশীল +3 অক্সিডেশন অবস্থা দেখায়, বাইরের s-ইলেকট্রনগুলি অপসারণ করে এবং তারপরে (সাধারণত) (n-2)f-অরবিটাল থেকে একটি ইলেকট্রন অপসারিত হয়, যেগুলো ns এর সাথে শক্তিতে অনুরূপ। d- এবং f-ব্লক উপাদানগুলির সাধারণ এবং সর্বাধিক অক্সিডেশন অবস্থা আয়নীকরণ শক্তির উপর নির্ভর করে। প্রতিটি ট্রানজিশন সিরিজের মধ্যে (n−1)d এবং ns অরবিটালগুলির মধ্যে শক্তির পার্থক্য বাড়ার সাথে সাথে, আরও ইলেকট্রনকে আয়নিত করা শক্তিগতভাবে কম অনুকূল হয়ে পড়ে। সুতরাং, প্রাথমিক ট্রানজিশন ধাতব গ্রুপগুলি উচ্চতর অক্সিডেশন অবস্থা পছন্দ করে, তবে +2 অক্সিডেশন অবস্থা পরবর্তী ট্রানজিশন ধাতব গ্রুপগুলির জন্য আরও স্থিতিশীল হয়ে ওঠে। সর্বোচ্চ আনুষ্ঠানিক অক্সিডেশন অবস্থা এইভাবে প্রতিটি d-ব্লক সারির শুরুতে +3 থেকে বৃদ্ধি পায়, মাঝখানে +7 বা +8 এ পৌঁছায় (যেমন OsO4), এবং তারপর শেষে +2 এ নেমে যায়। ল্যান্থানাইড এবং শেষের দিকের অ্যাক্টিনাইডগুলির সাধারণত উচ্চ চতুর্থ আয়নীকরণ শক্তি থাকে এবং তাই খুব কমই +3 অক্সিডেশন অবস্থা ছাড়িয়ে যায়। অপরদিকে, প্রারম্ভিক অ্যাক্টিনাইডগুলির চতুর্থ আয়নীকরণ শক্তি কম থাকে এবং তাই উদাহরণস্বরূপ নেপচুনিয়াম এবং প্লুটোনিয়াম +7 এ পৌঁছাতে পারে। অনেক শেষের অ্যাক্টিনাইডগুলি ল্যান্থানাইডগুলির তুলনায় কম অক্সিডেশন অবস্থাকে প্রাধান্য দেয়: মেন্ডেলিভিয়াম থুলিয়াম বা এমনকি ইউরোপিয়ামের চেয়ে আরও সহজে +2 অবস্থায় হ্রাস পায় (অর্ধ-পূর্ণ f-শেলের কারণে সবচেয়ে স্থিতিশীল +2 অবস্থা সহ ল্যান্থানাইড), এবং নোবেলিয়াম আউটরাইট ভাবে ইটারবিয়ামের বিপরীতে +2 কে +3 এর চেয়ে অধিক প্রাধান্য দেয়।
যৌগের যেকোনো পরমাণুর সর্ববহিঃস্থ শক্তিস্তরের ইলেকট্রন বিন্যাসকে যোজনী কাঠামো বলে। পর্যায় সারণির একই গ্রুপের মৌলগুলোর যোজনী কাঠামো একই রকম হওয়ায় এরা সাধারণত একই ধরনের রাসায়নিক বৈশিষ্ট্য প্রদর্শন করে থাকে। উদাহরণস্বরূপ, প্রথম গ্রুপের ক্ষার ধাতুগুলোর সবার একটি করে যোজনী ইলেকট্রন আছে, যার ফলে এই মৌলগুলোর মধ্যে এক প্রকারের সমসত্ত্বতা দেখা যায়: এগুলো সবই নরম এবং উচ্চ বিক্রিয়াশীল ধাতু। যদিও এই বৈশিষ্ট্যের ক্ষেত্রে আরও অনেক বিষয় জড়িত, তাই কোনো গ্রুপের মধ্যেও প্রায়শই বৈচিত্র্য দেখা যেতে পারে। যেমন, হাইড্রোজেনেরও একটি যোজনী ইলেকট্রন আছে এবং এটি ক্ষার ধাতুগুলোর মতোই একই গ্রুপে অবস্থান করে, কিন্তু রাসায়নিক বৈশিষ্ট্যের দিক থেকে এটি সম্পূর্ণ ভিন্ন। আবার, গ্রুপ ১৪ এর স্থিতিশীল মৌলগুলোর মধ্যে রয়েছে একটি অধাতু (কার্বন), দুটি অর্ধপরিবাহী (সিলিকন ও জার্মেনিয়াম) এবং দুটি ধাতু (টিন ও সীসা)। তবুও এদের সবার চারটি করে যোজনী ইলেকট্রন থাকায় এদের মধ্যে এক ধরণের মিল রয়েছে। এর কারণে এদের সর্বোচ্চ এবং সর্বনিম্ন জারণ সংখ্যা প্রায় একই হয় (যেমন, গ্রুপ ১৬ এর সালফার এবং সেলেনিয়াম উভয়ের সর্বোচ্চ জারণ সংখ্যা +৬, যেমন SO3 এবং SeO3 যৌগে; আবার উভয়ের সর্বনিম্ন জারণ সংখ্যা -২, সালফাইড ও সেলেনাইডের ক্ষেত্রে)। তবে সবসময় একই বৈশিষ্ট্য নাও পাওয়া যেতে পারে (যেমন, অক্সিজেনকে সালফার বা সেলেনিয়ামের মতো +৬ জারণ অবস্থায় পাওয়া যায় না)।
তড়িৎ ঋণাত্মকতা
[সম্পাদনা]
মৌলের আরেকটি গুরুত্বপূর্ণ বৈশিষ্ট্য হলো এদের তড়িৎ ঋণাত্মকতা। পরমাণুগুলো ইলেকট্রন যুগল শেয়ার করে সমযোজী বন্ধন তৈরি করতে পারে, এবং এর মাধ্যমে ভ্যালেন্স কক্ষপথগুলো পরষ্পর অধিক্রমণ করে। শেয়ার করা ইলেকট্রন যুগলকে কোন পরমাণু কতটা আকর্ষণ করবে তা নির্ভর করে তার তড়িৎ ঋণাত্মকতার উপর। তড়িৎ ঋণাত্মকতা হলো কোনো পরমাণুর ইলেকট্রন লাভ বা হারাবার প্রবণতা। যে পরমাণু বেশি তড়িৎ ঋণাত্মক সেটি শেয়ারকৃত ইলেকট্রন যুগলকে নিজের দিকে বেশি আকর্ষণ করবে। আর যে পরমাণু যত কম তড়িৎ ঋণাত্মক (বা বেশি তড়িৎ ধনাত্মক), সে ইলেক্ট্রনকে তত কম আকর্ষণ করবে। চরম ক্ষেত্রে, এটা ধরে নেওয়া যায় যে, ইলেকট্রনটি আরো তড়িৎ ধনাত্মক পরমাণু থেকে সম্পূর্ণরূপে তড়িৎ ঋণাত্মক পরমাণুতে স্থানান্তরিত হয়েছে, যদিও এটি একটি সরলীকৃত ব্যাখ্যা। বন্ধনটি তখন দুটি আয়নকে সংযুক্ত করে, একটি ধনাত্মক (ইলেকট্রন ত্যাগের মাধ্যমে) এবং একটি ঋণাত্মক (ইলেকট্রন গ্রহণ এর মাধ্যমে), এবং এটিকে আয়নিক বন্ধন বলা হয়।
তড়িৎ ঋণাত্মকতা নির্ভর করে নিউক্লিয়াস কতটা শক্তিশালীভাবে একটি ইলেকট্রন যুগলকে আকর্ষণ করতে পারে তার উপর। তাই তড়িৎ ঋণাত্মকতা অন্যান্য বৈশিষ্ট্যের মতোই একই ধরণের তারতম্য প্রদর্শন করে: নিচ থেকে উপরের দিকে গেলে তড়িৎ ঋণাত্মকতা হ্রাস পায় এবং বাম থেকে ডানে গেলে তা বৃদ্ধি পায়। ক্ষার ও ক্ষারীয় মৃত্তিকা ধাতুগুলি সবচেয়ে তড়িৎ ধনাত্মক মৌলগুলির মধ্যে, যখন চ্যালকোজেন, হ্যালোজেন এবং নিষ্ক্রিয় গ্যাসগুলি সবচেয়ে তড়িৎ ঋণাত্মক।
তড়িৎ ঋণাত্মকতা সাধারণত পাউলিং স্কেলে পরিমাপ করা হয়, যেখানে সবচেয়ে তড়িৎ ঋণাত্মক মৌল (ফ্লোরিন) কে 4.0 তড়িৎ ঋণাত্মকতা দেওয়া হয়, এবং সবচেয়ে কম তড়িৎ ঋণাত্মক মৌল (সিজিয়াম) কে দেওয়া হয় 0.79 তড়িৎ ঋণাত্মকতা। আসলে নিয়ন হল সবচেয়ে তড়িৎ ঋণাত্মক মৌল, কিন্তু পাউলিং স্কেল এর তড়িৎ ঋণাত্মকতা পরিমাপ করতে পারে না কারণ এটি বেশিরভাগ মৌলের সাথে সমযোজী বন্ধন তৈরি করে না।
একটি মৌলের তড়িৎ ঋণাত্মকতা এর যোজ্যতা অবস্থা এবং কয়টি পরমাণুর সাথে এটি যুক্ত তার উপর নির্ভর করে। এছাড়াও এটা নির্ভর করে এর ইতিমধ্যে কতগুলো ইলেকট্রন হারিয়েছে তার উপরও। একটি পরমাণু যত বেশি ইলেকট্রন হারায়, ততই বেশি তড়িৎ ঋণাত্মক হয়ে ওঠে। এটি কখনও কখনও একটি বড় পার্থক্য তৈরি করে: পাউলিং স্কেলে +2 যোজ্যতা অবস্থায় সীসার (লেড) তড়িৎ ঋণাত্মকতা 1.87, কিন্তু +4 যোজ্যতা অবস্থায় সীসার তড়িৎ ঋণাত্মকতা 2.33।
ধাতবতা (Metallicity)
[সম্পাদনা]
একক উপাদান বা মৌল দিয়ে গঠিত পদার্থকে সাধারণ পদার্থ বলা হয়। তুলনামূলকভাবে বেশি তড়িৎঋণাত্মক (electronegative) মৌলের পরমাণুগুলো নিজেদের মধ্যে ইলেকট্রন শেয়ার করে সমযোজী বন্ধন তৈরি করে। এরা হয় ছোট অণু (যেমন হাইড্রোজেন বা অক্সিজেন যাদের পরমাণু জোড়ায় জোড়ায় বন্ধন তৈরি করে) নয়তো অনির্দিষ্টভাবে বিস্তৃত কাঠামো (যেমন কার্বন বা সিলিকন) তৈরি করে। নিষ্ক্রিয় গ্যাসগুলো একক পরমাণু হিসেবেই অবস্থান করে কারণ তাদের ইতোমধ্যে শেষ কক্ষপথটি ইলেকট্রন দিয়ে পূর্ণ। অণু বা একক পরমাণু দিয়ে গঠিত পদার্থগুলো অণুগুলোর মধ্যেকার তুলনামূলক দুর্বল আকর্ষণ বল দ্বারা সংযুক্ত থাকে। যেমন লন্ডন ডিসপারশন বল (London Dispersion force) যেখানে অণুর মধ্যে ইলেকট্রন চলাচলের কারণে তাৎক্ষণিক তড়িৎ ভারসাম্যহীনতার সৃষ্টি হয়, যা আশেপাশের অণুতেও অনুরূপ ভারসাম্যহীনতা তৈরি করে এবং অনেকগুলো অণু জুড়ে ইলেকট্রনের সুসংগত চলাচল তৈরি করে।

অপরদিকে, তুলনামূলকভাবে বেশি তড়িৎধনাত্মক (electropositive) মৌলগুলো ইলেকট্রন ত্যাগ করে ধনাত্মক আয়নে পরিণত হয়, ফলে ইলেকট্রনের এক বিশাল সমুদ্র তৈরি হয়। এক্ষেত্রে, একটি পরমাণুর বাইরের অরবিটালগুলো আশেপাশের পরমাণুগুলোর সাথে অধিক্রমণ করে ইলেক্ট্রন ভাগাভাগি করে, যার ফলে বিশাল আকারের আণবিক অরবিটাল সৃষ্টি হয় যা সমস্ত পরমাণু জুড়ে বিস্তৃত থাকে। এই ঋণাত্মক চার্জযুক্ত "ইলেকট্রন সমুদ্র" সমস্ত আয়নকে আকর্ষণ করে ধাতব বন্ধনের মাধ্যমে একসাথে রাখে। এই ধরনের বন্ধন তৈরি করে যে মৌলগুলো রয়েছে সেগুলোকে প্রায়শই ধাতু বলা হয়; যেসব মৌল এই বন্ধন তৈরি করে না সেগুলোকে অধাতু বলা হয়। কিছু মৌল ভিন্ন কাঠামোবিশিষ্ট একাধিক সাধারণ পদার্থ তৈরি করতে পারে: এদেরকে অ্যালোট্রপ (allotropes) বলা হয়। উদাহরণস্বরূপ, হীরা এবং গ্রাফাইট হল কার্বনের দুটি অ্যালোট্রপ।
একটি মৌলের ধাতবতা তার ইলেকট্রনিক বৈশিষ্ট্য পর্যালোচনা করে অনুমান করা সম্ভব। যখন পারমাণবিক অরবিটালগুলো ধাতব বা সমযোজী বন্ধনের সময় পরস্পরের উপর অধিক্রমণ (overlap) করে, তখন সমান সংখ্যক যোজন (bonding) ও বিযোজন (antibonding) আণবিক অরবিটাল সৃষ্টি হয়। বিযোজন অরবিটালগুলোর শক্তি বেশি থাকে। বিযোজন অরবিটালের তুলনায় যোজন অরবিটালে যখন অধিক সংখ্যক ইলেকট্রন থাকে, তখন নীট যোজন (bonding) ধর্ম প্রকাশ পায়। যেসব মৌলের প্রতিটি পরমাণু থেকে বিচ্যুত ইলেকট্রনের সংখ্যা অধিক্রমণকারী অরবিটাল সংখ্যার দ্বিগুণের চেয়ে কম, সেগুলো সাধারণত ধাতব বন্ধনের মাধ্যমে ধাতুতে পরিণত হয়। মৌলিক সারণীর ১ম থেকে ১৩শ গ্রুপের মৌলগুলোর ক্ষেত্রে এমনটিই ঘটে। এছাড়া, এইসব মৌলের যোজ্যতা ইলেকট্রন সংখ্যা পরমাণুগুলোর সমতুল্য অবস্থান নিয়ে বিশাল সমযোজী কাঠামো গঠনের জন্য খুবই নগণ্য; তাই এরা প্রায় সবাই ধাতুতে পরিণত হয়। ব্যতিক্রম হলো হাইড্রোজেন ও বোরন। এদের আয়নীকরণ শক্তি অনেক বেশি। হাইড্রোজেন সমযোজী H2 অণু গঠন করে এবং বোরন আইকোসাহেড্রাল B12 গুচ্ছের উপর ভিত্তি করে একটি বিশাল সমযোজী কাঠামো গঠন করে। ধাতুর ক্ষেত্রে, যোজন এবং বিযোজন অরবিটালগুলোর শক্তি পরস্পর অধিক্রমণ করে। ফলে একটি পটি (band) তৈরি হয় যেখানে ইলেকট্রনগুলো অবাধে প্রবাহিত হতে পারে। এর ফলে তড়িৎ পরিবহন সম্ভব হয়।

গ্রুপ ১৪ এর মৌলগুলোতে আমরা ধাতব এবং সমযোজী উভয় ধরণের বন্ধন লক্ষ্য করি। হীরকের ক্ষেত্রে, কার্বন পরমাণুর মধ্যেকার সমযোজী বন্ধন অত্যন্ত শক্তিশালী। এর কারণ কার্বনের ছোট পরমাণবিক ব্যাসার্ধ, যার ফলে নিউক্লিয়াসের ইলেকট্রনগুলোর ওপর আকর্ষণ বেশি থাকে। এই কারণে সমযোজী বন্ধনে যে বন্ধন কক্ষপথের সৃষ্টি হয়, তার শক্তি বন্ধন-বিরোধী কক্ষপথের চেয়ে অনেক কম থাকে এবং এদের মধ্যে সমাপতন (overlap) থাকে না। ফলে তড়িৎ পরিবহন অসম্ভব হয়ে পড়ে - কার্বন অধাতু হিসেবে পরিচিতি পায়। তবে, বৃহত্তর পরমাণুর ক্ষেত্রে সমযোজী বন্ধন দুর্বল হয়ে যায় এবং বন্ধন ও বন্ধন-বিরোধী কক্ষপথের শক্তির পার্থক্য হ্রাস পায়। কক্ষপথগুলোর মধ্যেকার এই শক্তিগত ব্যবধানকে ব্যান্ড গ্যাপ বলা হয়। সিলিকন ও জার্মেনিয়ামের ব্যান্ড গ্যাপ কম থাকায়, সাধারণ পরিবেশে এগুলো অর্ধপরিবাহী হিসেবে কাজ করে। তাপ শক্তি পেলে ইলেকট্রন এই শক্তি ব্যবধান অতিক্রম করতে পারে। (বোরনও সাধারণ অবস্থায় অর্ধপরিবাহী।) টিনের ক্ষেত্রে ব্যান্ড গ্যাপ থাকে না, তাই টিন ও লেড ধাতুর মতো আচরণ করে। তাপমাত্রা বৃদ্ধি পেলে সকল অধাতুই কিছুটা অর্ধপরিবাহীর বৈশিষ্ট্য লাভ করে, এর মাত্রা নির্ভর করে ব্যান্ড গ্যাপের আকারের ওপর। এর মাধ্যমে ধাতু ও অধাতুকে পৃথক করা যায় – তাপমাত্রা বৃদ্ধিতে ধাতুর পরিবাহিতা কমে যায় (কারণ তাপীয় গতিশক্তি ইলেকট্রন প্রবাহকে বাধা দেয়), আর অধাতুর পরিবাহিতা বৃদ্ধি পায় (কেননা তখন আরও বেশি ইলেকট্রন ব্যান্ড গ্যাপ অতিক্রম করার সুযোগ পায়)।
গ্রুপ ১৫ থেকে ১৭ পর্যন্ত বিস্তৃত মৌলগুলিতে অনেক বেশি ইলেকট্রন থাকে। তাই এগুলো সুবৃহৎ সমযোজী অণু তৈরি করে না যেগুলো ত্রিমাত্রিকভাবে বিস্তৃত হতে পারে। হালকা মৌলের ক্ষেত্রে, ছোট দ্বি-পারমাণবিক অণুর মধ্যকার বন্ধন এতই শক্তিশালী যে, ঘনীভূত পদার্থ তৈরিতে বাঁধার সৃষ্টি করে। এই কারণে নাইট্রোজেন (N2), অক্সিজেন (O2), সাদা ফসফরাস ও হলুদ আর্সেনিক (P4 ও As4), সালফার ও লাল সেলেনিয়াম (S8 ও Se8), এবং স্থিতিশীল হ্যালোজেনসমূহ (F2, Cl2, Br2, ও I2) সহজেই কয়েকটি পরমাণু দিয়ে সমযোজী অণু গঠন করে। ভারী মৌলগুলো সাধারণত দীর্ঘ শৃঙ্খল (যেমন লাল ফসফরাস, ধূসর সেলেনিয়াম, টেলুরিয়াম) অথবা স্তরীভূত কাঠামো (যেমন গ্রাফাইট হিসেবে কার্বন, কালো ফসফরাস, ধূসর আর্সেনিক, অ্যান্টিমনি, বিসমাথ) তৈরি করে। এই কাঠামো এক বা দুই মাত্রার বদলে ত্রিমাত্রিকভাবে বিস্তৃত হয়। ফসফরাস, আর্সেনিক এবং সেলেনিয়াম – এই তিনটি মৌলের ক্ষেত্রেই উভয় ধরণের কাঠামো তথা বিন্যাস পাওয়া যায়। তবে দীর্ঘ শৃঙ্খলের বিন্যাসগুলি অধিকতর স্থিতিশীল। যেহেতু এই কাঠামোগুলি বন্ধন গঠনের জন্য সমস্ত কক্ষপথ ব্যবহার করে না, তাই ক্রমবর্ধমান শক্তির ভিত্তিতে এখানে বন্ধন, অ-বন্ধন, ও বন্ধন-বিরোধী ব্যান্ড তৈরি হয়। গ্রুপ ১৪ এর সাথে সামঞ্জস্য রেখে, ভারী মৌলগুলোর ক্ষেত্রে ব্যান্ড ফাঁক ছোট হয়ে যায় এবং শৃঙ্খল বা স্তরগুলির মধ্যে ইলেকট্রনের মুক্ত চলাচল সম্ভব হয়। উদাহরণস্বরূপ, কালো ফসফরাস, কালো আর্সেনিক, ধূসর সেলেনিয়াম, টেলুরিয়াম এবং আয়োডিন হলো অর্ধপরিবাহী। আবার ধূসর আর্সেনিক, অ্যান্টিমনি এবং বিসমাথ হলোধাতুকল্প (এরা প্রায়-ধাতব পরিবাহিতা প্রদর্শন করে, খুব সামান্য ব্যান্ডের ওভারল্যাপ সহ)। অবশেষে, পোলোনিয়াম এবং সম্ভবত অ্যাস্টাটিন হলো প্রকৃত ধাতু। অবশেষে, গ্রুপ ১৮ এর প্রাকৃতিক মৌলগুলি সবই পৃথক পরমাণু হিসেবে অবস্থান করে।
ধাতু এবং অধাতুর মধ্যে বিভাজন রেখাটি প্রায় তীর্যকভাবে উপরের বাম দিক থেকে নীচের ডানদিকে অবস্থিত। ধাতুসমূহ এই তীর্যক রেখার বামদিকে পরিদৃশ্যমান হয় (কারণ এদের অনেকগুলি মুক্ত অরবিটাল উপলব্ধ থাকে)। এটিই প্রত্যাশিত, কেননা ধাতব-চরিত্র বৈদ্যুতিক ধনাত্মকতা এবং ইলেকট্রন ত্যাগ করার প্রবণতার সাথে সম্পর্কিত, যা ডান থেকে বামে এবং উপর থেকে নীচের দিকে বৃদ্ধি পায়। সুতরাং, অধাতুর সংখ্যার তুলনায় ধাতুর সংখ্যা অনেক বেশি। বিভাজন রেখার কাছাকাছি অবস্থিত মৌলগুলিকে শ্রেণীবদ্ধ করা বেশ কঠিন হয়ে পড়ে। এগুলোর বৈশিষ্ট্যসমূহ ধাতু ও অধাতুর মধ্যবর্তী হতে থাকে; অনেক ক্ষেত্রে এদের উভয়ের কিছু নির্দিষ্ট বৈশিষ্ট্যও থাকতে পারে। এগুলোকে প্রায়শই "উপধাতু" বা "মেটালয়েড" বলা হয়। তবে, রসায়নবিদরা যে অর্থে "উপধাতু" শব্দটি ব্যবহার করেন, সেটি পদার্থবিজ্ঞানের কঠোর সংজ্ঞা থেকে আলাদা। উদাহরণস্বরূপ, বিসমাথকে পদার্থবিজ্ঞানের অর্থে একটি উপধাতু হিসেবে বিবেচনা করা হলেও, রসায়নবিদরা এটিকে একটি ধাতু হিসেবেই গ্রহণ করেন।
নিম্নলিখিত সারণিতে আদর্শ পরিস্থিতিতে সর্বাধিক স্থিতিশীল বরাদ্দ (allotrope) বিবেচনা করা হয়েছে। হলুদ রঙের উপাদানগুলি সাধারণ পদার্থ তৈরি করে যেগুলি ধাতব বন্ধন দ্বারা ভালভাবে চিহ্নিত হয়। হালকা নীল রঙের উপাদানগুলি বিশাল নেটওয়ার্কের সমযোজী কাঠামো তৈরি করে, যেখানে গাঢ় নীল রঙের উপাদানগুলি ছোট সমযোজীভাবে বন্ধিত অণু তৈরি করে যেগুলি দুর্বল ভ্যান ডার ওয়ালস বল দ্বারা একসাথে ধরে রাখা হয়। নিষ্ক্রিয় গ্যাসগুলো বেগুনি রঙে রঙিন: তাদের অণু হল একক পরমাণু এবং কোনও সমযোজী বন্ধন হয় না। ধূসর রঙের ঘরগুলি সেই উপাদানগুলির জন্য যেগুলি তাদের সর্বাধিক স্থিতিশীল অ্যালোট্রোপগুলিকে এইভাবে চিহ্নিত করার জন্য পর্যাপ্ত পরিমাণে প্রস্তুত করা হয়নি। তাত্ত্বিক বিবেচনা এবং বর্তমান পরীক্ষামূলক প্রমাণগুলি থেকে বোঝা যায় যে সমস্ত উপাদান ধাতব হবে যদি তারা ঘনীভূত পর্যায় গঠন করতে পারে, সম্ভবত অগনেসন ব্যতীত।
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Group → | ||||||||||||||||||||||||||||||||
| ↓ Period | ||||||||||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
|
ধাতব নেটওয়ার্ক সমযোজী অণু সমযোজী একক পরমাণু অজানা মৌলিক পদার্থের ক্ষেত্রে পর্যায় সারণিতে পটভূমির রং (Background color) বন্ধন প্রকার নির্দেশ করে। যদি একাধিক রূপভেদ (allotrope) থাকে, তাহলে সবচেয়ে স্থিতিশীল রূপভেদ বিবেচনা করা হয়। |
-
লোহা, একটি ধাতু
-
সালফার, একটি অধাতু
-
আর্সেনিক, একটি উপাদান যা প্রায়শই একটি অর্ধ-ধাতু বা মেটালয়েড নামে পরিচিত
সাধারণত, ধাতু চকচকে এবং ঘন হয়। ধাতব বন্ধনের শক্তির কারণে এদের সাধারণত গলনাঙ্ক এবং স্ফুটনাঙ্ক বেশি হয়। এছাড়া, ধাতব বন্ধন ভাঙার ঝুঁকি না নিয়ে পরমাণুগুলোর অবস্থান পরিবর্তন করা যায় বলে, ধাতুগুলোকে সাধারণত পিটিয়ে বা টেনে বিভিন্ন আকার দেওয়া যায় (নমনীয় ও নম্য)। ধাতুর ইলেকট্রনগুলো ত্রিমাত্রিকভাবে মুক্তভাবে চলাচল করতে পারে বলে এগুলো বিদ্যুৎ পরিবহন করে। অনুরূপভাবে, ধাতু তাপ পরিবহন করে, কারণ ইলেকট্রনগুলো অতিরিক্ত গতিশক্তি হিসেবে তাপকে স্থানান্তর করে; এরা আরও দ্রুত গতিতে চলাচল করে। এই বৈশিষ্ট্যগুলো গলিত অবস্থাতেও বজায় থাকে, কারণ গলনের সময় স্ফটিক কাঠামো নষ্ট হয়ে গেলেও পরমাণুগুলোর সংযোগ বিদ্যমান থাকে এবং ধাতব বন্ধন দুর্বল হলেও টিকে থাকে। ধাতুসমূহ অধাতুর সাথে বিক্রিয়াশীল হতে থাকে। এই সাধারণ বৈশিষ্ট্যগুলোর কিছু ব্যতিক্রম আছে: উদাহরণস্বরূপ, বেরিলিয়াম, ক্রোমিয়াম, ম্যাঙ্গানিজ, অ্যান্টিমনি, বিসমাথ এবং ইউরেনিয়াম ভঙ্গুর (এই তালিকা সব ধারণ করে না); ক্রোমিয়াম অত্যন্ত শক্ত; গ্যালিয়াম, রুবিডিয়াম, সিজিয়াম এবং পারদ কক্ষ তাপমাত্রায় বা তার কাছাকাছি অবস্থায় তরল থাকে; এবং সোনার মতো নিষ্ক্রিয় ধাতুগুলি রাসায়নিকভাবে নিষ্ক্রিয়।
অধাতব পদার্থগুলোর বৈচিত্র্যময় বৈশিষ্ট্য রয়েছে। যেসব অধাতু বিশাল সমযোজী স্ফটিক তৈরি করে তাদের গলনাঙ্ক এবং স্ফুটনাঙ্ক সাধারণত অনেক বেশি হয়। এর কারণ এই শক্তিশালী সমযোজী বন্ধন ভাঙতে উল্লেখযোগ্য পরিমাণ শক্তির প্রয়োজন হয়। অন্যদিকে, যেসব অধাতু বিচ্ছিন্ন অণু তৈরি করে সেগুলো মূলত বিচ্ছুরণ বল দ্বারা একত্রে আবদ্ধ থাকে। এই বলগুলি সহজেই কাটিয়ে ওঠা যায়। ফলে, এদের গলনাঙ্ক এবং স্ফুটনাঙ্ক তুলনামূলকভাবে কম হয় এবং কক্ষ তাপমাত্রায় এদের অনেকেই তরল বা গ্যাসীয় অবস্থায় থাকে। অধাতব পদার্থগুলো প্রায়শই নিষ্প্রভ দেখায়। নিষ্ক্রিয় গ্যাসগুলো বাদে, এরা ধাতুর সাথে বিক্রিয়াশীল হতে থাকে; নিষ্ক্রিয় গ্যাসগুলো অধিকাংশ পদার্থের সাথে নিষ্ক্রিয় থাকে। কঠিন অবস্থায় এরা ভঙ্গুর হয় কারণ এদের পরমাণুগুলো নিজেদের জায়গায় শক্তভাবে আবদ্ধ থাকে। এরা কম ঘনত্বের হয় এবং তড়িৎ পরিবহনও ভালোভাবে করে না কারণ এদের কোনো মুক্ত ইলেকট্রন থাকে না। সীমান্তবর্তী অঞ্চলে, ব্যান্ড ফাঁক ছোট থাকে এবং তাই সেই অঞ্চলের অনেক মৌলই যেমন সিলিকন, জার্মেনিয়াম এবং টেলুরিয়াম অর্ধপরিবাহী হয়। সেলেনিয়ামের একটি অর্ধপরিবাহী ধূসর বর্তন এবং একটি অন্তরক লাল বর্তন রয়েছে। আর্সেনিকের একটি ধাতব ধূসর বর্তন, একটি অর্ধপরিবাহী কালো বর্তন এবং একটি অন্তরক হলুদ বর্তন রয়েছে (যদিও পরিবেষ্টিত অবস্থায় শেষটি অস্থির থাকে)। এখানেও ব্যতিক্রম আছে; উদাহরণস্বরূপ, হীরার তাপ পরিবাহিতা যেকোনো ধাতুর চেয়ে সবচেয়ে বেশি।
ধাতব ও অধাতব পদার্থের সংযোগস্থলে থাকা কিছু মৌলিক পদার্থকে 'উপধাতু' হিসেবে গণ্য করা হয়। এই মৌলগুলো ধাতু ও অধাতুর ভৌত ও রাসায়নিক বৈশিষ্ট্যের মধ্যবর্তী বৈশিষ্ট্য প্রদর্শন করে। তবে উপধাতু হিসেবে কোন মৌলগুলোকে ঠিক স্থান দেওয়া উচিত সে ব্যাপারে বিজ্ঞানীদের মধ্যে সর্বসম্মত মত নেই। সিলিকন, জার্মেনিয়াম, আর্সেনিক, এবং টেলুরিয়াম মৌলগুলোকে প্রায়শই উপধাতু বলা হয়, এবং বোরন ও অ্যান্টিমনি'কেও অনেকসময় উপধাতু হিসেবে ধরা হয়। বেশিরভাগ তথ্যসূত্র অন্যান্য মৌলকেও এর অন্তর্ভূক্ত করে, তবে কোন মৌলগুলোকে যুক্ত করা বা বাদ দেওয়া উচিত সে ব্যাপারে ঐকমত্য নেই। যেমন, সাধারণত উপধাতু বা অধাতু হিসেবে গণ্য করা অন্যান্য মৌলগুলোর বিপরীতে, অ্যান্টিমনির একমাত্র স্থায়ী রূপ ধাতুর ন্যায় তড়িৎ পরিবাহী। উপরন্তু, এই মৌলটি তার ভৌত ও রাসায়নিক আচরণে বিসমাথ এবং অন্যান্য পি-ব্লক মৌল সমূহের অনুরূপ। এই ভিত্তিতে, অনেক লেখক যুক্তি দেন যে অ্যান্টিমনিকে উপধাতুর পরিবর্তে একটি ধাতু হিসেবে শ্রেণিবদ্ধ করা অধিকতর যৌক্তিক। অন্যদিকে, সবচেয়ে স্থিতিশীল রূপে সেলেনিয়ামের কিছুটা অর্ধপরিবাহীর বৈশিষ্ট্য আছে (যদিও এর অন্তরক রূপভেদও আছে)। এই ভিত্তিতে অনেকে যুক্তি দেখান যে একে উপধাতু হিসেবে বিবেচনা করা উচিত, যদিও একই অবস্থা ফসফরাসের ক্ষেত্রেও প্রযোজ্য, যেটিকে উপধাতুর তালিকায় অনেক কম দেখা যায়।
মৌলসমূহের আবর্তন ধর্মের আরও কিছু উদাহরণ
[সম্পাদনা]মৌলসমূহের পর্যায় সারণিতে একই গ্রুপে না থেকেও কিছু মৌলের মধ্যে পারস্পরিক সম্পর্ক লক্ষ্য করা যায়। যেমন, লিথিয়াম ও ম্যাগনেসিয়াম মৌল দুটি পরস্পরের কর্ণ বরাবর অবস্থিত, এদের মধ্যে বেশ কিছু মিল রয়েছে। এধরনের সম্পর্ককে কর্ণগত সম্পর্ক বলা হয়। আবার, প্রধান গ্রুপের মৌল ও ট্রানজিশন ধাতুগুলোর মধ্যে অথবা প্রাথমিক অ্যাক্টিনাইড ও প্রাথমিক ট্রানজিশন ধাতুগুলোর মধ্যে একই সংখ্যক যোজন ইলেকট্রন থাকলে কিছু মিল পাওয়া যায়। উদাহরণস্বরূপ, ইউরেনিয়াম কিছুটা ক্রোমিয়াম ও টাংস্টেনের মতো আচরণ করে, কারণ সবগুলোর যোজন ইলেকট্রন সংখ্যা ৬। একই যোজন ইলেকট্রন, কিন্তু ভিন্ন ধরণের যোজ্যতা কক্ষপথ বিশিষ্ট মৌলগুলোর মধ্যে যে সম্পর্ক তাকে গৌণ সম্পর্ক বলা যায়। এদের জন্য সাধারণত সর্বোচ্চ জারণ সংখ্যা একই হয়, কিন্তু সর্বনিম্ন জারণ সংখ্যা ভিন্ন হয়। যেমন, ক্লোরিন ও ম্যাঙ্গানিজ, উভয়ের সর্বোচ্চ জারণ সংখ্যা +৭, কিন্তু সর্বনিম্ন জারণ সংখ্যা যথাক্রমে -১ (HCl এ) এবং -৩ (K2[Mn(CO)4] এ)। আবার, কিছু মৌলের যোজন ইলেকট্রনের শূন্যস্থান একই, কিন্তু যোজন ইলেকট্রন সংখ্যা ভিন্ন হতে পারে। তাদের মধ্যকার সম্পর্ককে বলা হয় তৃতীয় পর্যায়ের বা সম-ইলেকট্রন গ্রাহক সম্পর্ক। এদের সর্বনিম্ন জারণ সংখ্যা সাধারণত একই কিন্তু সর্বোচ্চ জারণ সংখ্যা ভিন্ন হয়। যেমন, হাইড্রোজেনের সর্বনিম্ন জারণ সংখ্যা -১ (হাইড্রাইডে) যেটা ক্লোরিনের জন্যও একই (ক্লোরাইডে)। কিন্তু, হাইড্রোজেনের সর্বোচ্চ জারণ সংখ্যা +১, যেখানে ক্লোরিনের জন্য এটি +৭।
মৌলসমূহের গলনাংক, স্ফুটনাংক, গলনের সুপ্ততাপ, বাষ্পীভবনের সুপ্ততাপ, পরমাণুকরণ শক্তি ইত্যাদি বিভিন্ন ভৌত ধর্ম পর্যায় সূত্র অনুযায়ী পরিবর্তিত হয়। এ ধরণের আবর্তিত পরিবর্তন মৌলগুলোর যৌগের ক্ষেত্রেও লক্ষ্য করা যায়; যেমন হাইড্রাইড, অক্সাইড, সালফাইড, হ্যালাইড ইত্যাদি যৌগের তুলনা করলে তা স্পষ্ট হয়। রাসায়নিক ধর্মগুলো সংখ্যাগতভাবে প্রকাশ একটু জটিল, তারপরও এগুলো পর্যায়বৃত্তির একটা ধারা অনুসরণ করে। মৌল ও তাদের যৌগসমূহের অম্লীয় বা ক্ষারীয় ধর্ম, যৌগসমূহের স্থিতিশীলতা এমনকি মৌলগুলো আলাদাকরণ প্রক্রিয়া পর্যন্ত পর্যায়বৃত্ত ধর্মের প্রভাব স্পষ্টভাবে পরিলক্ষিত হয়। পর্যায়বৃত্তি আধুনিক রসায়নের অন্যতম ভিত্তি, অজানা মৌল বা যৌগের ধর্ম সম্পর্কে পূর্বাভাস দিতে এর গুরুত্ব অপরিসীম।
মৌলসমূহের শ্রেণিবিন্যাস
[সম্পাদনা]
| ক্ষার ধাতু মৃৎক্ষার ধাতু ল্যান্থানাইড অ্যাক্টিনাইড অবস্থান্তর ধাতু (ট্রানজিশন/পরিবর্তনশীল) | অন্যান্য ধাতু ধাতুকল্প অন্যান্য অধাতু হ্যালোজেন নিষ্ক্রিয় গ্যাস |
রাসায়নিক মৌলের অনুরূপ বৈশিষ্ট্যসম্পন্ন গ্রুপগুলোর বর্ণনায় বিভিন্ন পরিভাষা ব্যবহৃত হয়ে আসছে। 'ক্ষার ধাতু', 'মৃৎক্ষার ধাতু', 'ট্রাইয়েল', 'টেট্রেল', 'নিকটোজেন', 'চ্যালকোজেন', 'হ্যালোজেন', ও 'নোবেল গ্যাস' – এই রাসায়নিক গ্রুপগুলোকে আইইউপিএসি স্বীকৃতি দিয়েছে। অন্যান্য গ্রুপগুলোকেও সংখ্যা দিয়ে (যেমন গ্রুপ ৬ কে ক্রোমিয়াম গ্রুপ বলা হয়) অথবা প্রথম মৌলের নাম অনুসারে চিহ্নিত করা হয়। কাঠামোগতভাবে ১৩ থেকে ১৬ নম্বর গ্রুপের মৌলগুলোকে ধাতব পদার্থের বৈশিষ্ট্যের উপর ভিত্তি করে পি-ব্লকের মৌল থেকে আলাদা করা হয়। তবে রসায়নে ধাতু, অধাতু, বা উপধাতু (মেটালয়েড) – এদের কোনো নির্দিষ্ট সংজ্ঞা বা সর্বজন স্বীকৃত শ্রেণিবিন্যাস নেই। ট্রানজিশন মৌলগুলোর পরবর্তী ধাতুগুলোকে কী নামে অভিহিত করা যায়, তা নিয়েও ঐকমত্য নেই। 'পোস্ট-ট্রানজিশন মৌল' বা 'দুর্বল ধাতু' (poor metal) ইত্যাদি পরিভাষা এদের ক্ষেত্রে ব্যবহার করা হয়। কিছু গবেষক রাসায়নিক বৈশিষ্ট্যে বৈসাদৃশ্যের জন্য গ্রুপ ১২-এর মৌলসমূহকে ট্রানজিশন ধাতু থেকে বাদ দিয়ে থাকেন, তবে এটি সর্বজনীনভাবে প্রচলিত নয়। আইইউপিএসি-ও এ নিয়ে কোনো নির্দিষ্ট নীতিমালা প্রদান করেনি।
ল্যান্থানাইড বলে La-Lu পর্যন্ত মৌলগুলোকে বিবেচনা করা হয়। এদের রাসায়নিক বৈশিষ্ট্যে প্রচুর মিল রয়েছে। ঐতিহাসিকভাবে শুধু Ce থেকে Lu পর্যন্ত মৌলসমূহ ল্যান্থানাইড হিসেবে পরিচিত ছিলো। পরবর্তীতে ল্যান্থানামকেও এই গ্রুপভুক্ত করা শুরু হয়। ‘র্যার আর্থ মৌল’ বা ‘র্যার আর্থ ধাতু’ বলতে ল্যান্থানাইডদের পাশাপাশি স্ক্যান্ডিয়াম ও ইট্রিয়ামকেও বোঝানো হয়। একইভাবে, Ac থেকে Lr পর্যন্ত মৌলগুলোকে অ্যাক্টিনাইড বলা হয় (ঐতিহাসিকভাবে Th থেকে Lr পর্যন্ত)। যদিও অ্যাক্টিনাইডদের মধ্যে ল্যান্থানাইডদের তুলনায় বৈশিষ্ট্যের বৈচিত্র্য অনেক বেশী। আইইউপিএসি স্পষ্টতার জন্য 'ল্যান্থানয়েড' এবং 'অ্যাক্টিনয়েড' নামগুলো ব্যবহারের সুপারিশ করে কারণ '-আইড' প্রত্যয়টি সাধারণত ঋণাত্মক আয়ন বোঝাতে ব্যবহৃত হয়। তবে 'ল্যান্থানাইড' এবং 'অ্যাক্টিনাইড' নামগুলো বেশি প্রচলিত। লুটেশিয়াম ও লরেন্সিয়ামকে d-ব্লক মৌল হিসেবে স্বীকৃতি পাওয়ার পরে, কিছু গবেষক ল্যান্থানাইডদেরকে La থেকে Yb এবং অ্যাক্টিনাইডদেরকে Ac থেকে No পর্যন্ত হিসেবে সংজ্ঞায়িত করতে শুরু করেছেন, যা f-ব্লকের সাথে সঙ্গতিপূর্ণ। অ্যাক্টিনাইডের পরবর্তী অতি ভারী মৌলগুলো, যাদের অর্ধায়ু খুবই ক্ষণস্থায়ী, ট্রান্সঅ্যাক্টিনাইড বা সুপারহেভি এলিমেন্ট হিসেবে পরিচিত।
এছাড়া বিজ্ঞানের বিভিন্ন শাখায় মৌলসমূহকে শ্রেণীবদ্ধ করার আরো পদ্ধতি রয়েছে। যেমন, জ্যোতির্বিজ্ঞানে 'ধাতু' বলতে পারমাণবিক সংখ্যা ২-এর বেশী সম্পন্ন যেকোনো মৌলকে বোঝানো হয়। অর্থাৎ হাইড্রোজেন ও হিলিয়াম ব্যতীত সমস্ত মৌলই সেখানে ধাতু। পদার্থবিজ্ঞানে উপধাতুর সংজ্ঞা রসায়নের সংজ্ঞা থেকে আলাদা। ভৌত সংজ্ঞা অনুযায়ী বিসমাথ একটি উপধাতু কিন্তু রসায়নে একে সাধারণত ধাতু হিসেবেই বিবেচনা করা হয়। আবার 'ভারী ধাতু' (heavy metal) পরিভাষাটি ব্যাপকভাবে ব্যবহৃত হলেও এর কোনো সুনির্দিষ্ট সংজ্ঞা নেই। অনেক ক্ষেত্রে এর অর্থ এতটাই অস্পষ্ট যে সমালোচকদের মতে এটি 'অর্থহীন'।
লেখকভেদে এই পরিভাষাগুলোর প্রয়োগে ব্যাপক তারতম্য দেখা যায়। যেমন, আইইউপিএসি-এর মতে নোবেল গ্যাস বলতে সম্পূর্ণ গ্রুপটিকে বোঝায়, যার অন্তর্ভুক্ত হয় অতি তেজস্ক্রিয় সুপারহেভি মৌল, ‘ওগানেসন’। কিন্তু যারা সুপারহেভি মৌল নিয়ে গবেষণা করেন, তারা প্রায়ই এভাবে বলেন না। সেক্ষেত্রে 'নোবেল গ্যাস' বলতে মূলত কম তেজস্ক্রিয়, রাসায়নিকভাবে নিষ্ক্রিয় গ্রুপের উপাদানসমূহকে বোঝানো হয়। আণবিক অবস্থায় ওগানেসন খুব সম্ভবত অত্যন্ত তেজস্ক্রিয়। গাণিতিক মডেল থেকে পাওয়া যায় যে রিলেটিভিস্টিক এফেক্টের কারণে এটি তেমন নিষ্ক্রিয় নাও হতে পারে। এমনকি কক্ষতাপমাত্রায় এটি হয়তো গ্যাসও না। এজন্য এই পর্যায়ে ওগানেসনকে নোবেল গ্যাস হিসেবে স্বীকৃতি দেয়া নিয়ে বিতর্ক থেকেই যায়। আবার জাপানে বেরিলিয়াম ও ম্যাগনেসিয়ামকে প্রায়ই মৃৎক্ষার ধাতু হিসেবে পরিচয় দেয়া হয় না কারণ গ্রুপ ২ এর অন্যান্য ভারী মৌলের তুলনায় এদের রাসায়নিক আচরণে পার্থক্য আছে।
ইতিহাস
[সম্পাদনা]
প্রারম্ভিক ইতিহাস
[সম্পাদনা]রসায়নের উপাদানগুলিকে শ্রেণীবদ্ধ করার প্রাথমিক প্রচেষ্টা শুরু হয়েছিল ১৮১৭ সালে যখন জার্মান পদার্থবিদ জোহান উলফগ্যাং ডোবেরেইনার এ ব্যাপারে কাজ করেন। ১৮২৯ সালে, তিনি আবিষ্কার করেন যে তিনি কিছু উপাদানকে তিনটির দলে বিভক্ত করতে পারেন, যেখানে এই দলের সদস্যদের মধ্যে পারস্পরিক সম্পর্কিত বৈশিষ্ট্য রয়েছে। তিনি এই দলগুলিকে ত্রয়ী বা 'ট্রায়াড' (Triads) নামকরণ করেন। ক্লোরিন, ব্রোমিন এবং আয়োডিন একটি ট্রায়াড গঠন করে। অনুরূপভাবে ক্যালসিয়াম, স্ট্রন্টিয়াম এবং বেরিয়াম আরেকটি; লিথিয়াম, সোডিয়াম এবং পটাসিয়াম আরেকটি এবং সালফার, সেলেনিয়াম এবং টেলুরিয়াম আরেকটি ট্রায়াড গঠন করে। আজকের দিনে, এই সমস্ত ট্রায়াড আমাদের আধুনিক পর্যায় সারণির বিভিন্ন গ্রুপের অন্তর্ভুক্ত: হ্যালোজেন, ক্ষারীয় মৃৎ ধাতু, ক্ষার ধাতু এবং চ্যালকোজেন গ্রুপ। বিভিন্ন রসায়নবিদ তাঁর কাজ অব্যাহত রাখেন এবং উপাদানগুলির ছোট ছোট গ্রুপের মধ্যে ক্রমবর্ধমান সম্পর্ক চিহ্নিত করতে সক্ষম হন। তবে, তারা এমন একটি একক স্কিম তৈরি করতে পারেনি যা সেই সমস্ত সম্পর্ককে অন্তর্ভুক্ত করবে।

জন নিউল্যান্ডস ১৮৬৩ সালের ফেব্রুয়ারিতে কেমিক্যাল নিউজে একটি চিঠি প্রকাশ করেন যেখানে তিনি রাসায়নিক উপাদানগুলির মধ্যে পর্যায়ক্রমিক ধর্মের উপর আলোচনা করেন। ১৮৬৪ সালে নিউল্যান্ডস কেমিক্যাল নিউজে একটি নিবন্ধ প্রকাশ করেন যেখানে দেখানো হয়েছে যে, যদি উপাদানগুলিকে তাদের পারমাণবিক ওজনের ক্রমে সাজানো হয়, তবে পরপর সংখ্যাযুক্ত উপাদানগুলি ঘন ঘন হয় একই গ্রুপের অন্তর্ভুক্ত অথবা বিভিন্ন গ্রুপে অনুরূপ অবস্থানে থাকে। তিনি আরো উল্লেখ করেন যে প্রদত্ত একটি উপাদান থেকে শুরু করে প্রতি অষ্টম উপাদানটি এই বিন্যাসে প্রথমটির এক ধরণের পুনরাবৃত্তি, ঠিক যেমন সঙ্গীতে একটি অষ্টকের অষ্টম স্বর (অক্টেভের সূত্র)। যাইহোক, নিউল্যান্ডসের সূত্রগুলি মূল গ্রুপ উপাদানগুলির ক্ষেত্রে ভালভাবে কাজ করেছিল কিন্তু অন্যগুলির সাথে গুরুতর সমস্যায় পড়েছিল।
জার্মান রসায়নবিদ লোথার মেয়ার পর্যায়ক্রমিক বিরতিতে পুনরাবৃত্ত অনুরূপ রাসায়নিক এবং ভৌত বৈশিষ্ট্য লক্ষ্য করেন। তাঁর মতে, যদি পারমাণবিক ওজনগুলি অর্ডিনেট (অর্থাৎ উল্লম্বভাবে) এবং পারমাণবিক আয়তনগুলিকে অ্যাবসিসা (অর্থাৎ অনুভূমিকভাবে) হিসেবে প্লট করা হয়, তবে প্রাপ্ত বক্ররেখাটিতে অনেকগুলি উত্থান এবং পতনের ক্রম দেখা যাবে। এই বিন্যাসে সবচেয়ে তড়িৎধনাত্মক উপাদানগুলি তাদের পারমাণবিক ওজনের ক্রমে বক্ররেখার শীর্ষে উপস্থিত হবে। ১৮৬৪ সালে, তাঁর একটি বই প্রকাশিত হয়; এটিতে ২৮টি উপাদান সম্বলিত পর্যায় সারণির একটি প্রাথমিক সংস্করণ ছিল। তিনি প্রথমবারের মতো উপাদানগুলিকে তাদের যোজনী অনুসারে ছয়টি পরিবারে শ্রেণীবদ্ধ করেছিলেন। উপাদানগুলির পারমাণবিক ওজনের ভুল পরিমাপের কারণে সেই সময় অবধি পারমাণবিক ওজন দ্বারা উপাদানগুলিকে সংগঠিত করার কাজগুলি ব্যর্থ হয়েছিল। ১৮৬৮ সালে, তিনি তার সারণিটি সংশোধন করেন, কিন্তু এই সংশোধনীটি তাঁর মৃত্যুর পরে খসড়া হিসাবে প্রকাশিত হয়েছিল।
মেন্ডেলিভ এবং পর্যায় সারণির উৎপত্তি
[সম্পাদনা]
রুশ রসায়নবিদ দিমিত্রি মেন্ডেলিভ পর্যায় সারণির উন্নয়নে চূড়ান্ত সাফল্য অর্জন করেন। যদিও অন্যান্য রসায়নবিদরা (মেয়ারসহ) প্রায় একই সময়ে পর্যায় সারণির কিছু সংস্করণ তৈরি করেছিলেন, মেন্ডেলিভ তার সারণিকে উন্নয়ন ও এর যৌক্তিকতা প্রমাণের ক্ষেত্রে সবচেয়ে বেশি নিবেদিত ছিলেন। সে কারণেই তাঁর পদ্ধতিই বৈজ্ঞানিক সম্প্রদায়কে সবচেয়ে বেশি প্রভাবিত করেছিল। ১৮৬৯ সালের ১৭ ফেব্রুয়ারি (গ্রেগরিয়ান ক্যালেন্ডার অনুসারে ১ মার্চ ১৮৬৯), মেন্ডেলিভ মৌলসমূহকে তাদের পারমাণবিক ভর অনুসারে সাজাতে এবং তুলনা করতে শুরু করেন। তিনি প্রথমে কিছু মৌল দিয়ে শুরু করেছিলেন, এবং দিনের বেলায় তাঁর সারণিটি সম্প্রসারিত হতে থাকে যতক্ষণ না তা জানা মৌলগুলোর অধিকাংশকেই অন্তর্ভুক্ত করে। একটি সামঞ্জস্যপূর্ণ বিন্যাস খুঁজে পাওয়ার পর, তাঁর তৈরি সারণিটি ১৮৬৯ সালের মে মাসে রাশিয়ান কেমিক্যাল সোসাইটির জার্নালে প্রকাশিত হয়। যখন মনে হতো কিছু মৌল সারণিতে খাপ খাচ্ছে না, তখন তিনি সাহসিকতার সাথে ভবিষ্যদ্বাণী করেছিলেন যে হয় যোজনী বা পারমাণবিক ভর ভুলভাবে পরিমাপ করা হয়েছে, অথবা এখনও এমন কিছু মৌল আছে যেগুলো আবিষ্কৃত হয়নি। ১৮৭১ সালে, মেন্ডেলিভ একটি দীর্ঘ নিবন্ধ প্রকাশ করেন, যেখানে তাঁর সারণির একটি আপডেট সংস্করণসহ অজানা মৌল সম্পর্কে তার ভবিষ্যদ্বাণীগুলো স্পষ্টভাবে লেখা ছিল। মেন্ডেলিভ বোরন, অ্যালুমিনিয়াম এবং সিলিকন এর ভারী হোমোলগ হবে এমন তিনটি অজানা মৌলের বৈশিষ্ট্য বিস্তারিতভাবে ভবিষ্যদ্বাণী করেছিলেন এবং তাদের নাম দিয়েছিলেন একা-বোরন, একা-অ্যালুমিনিয়াম এবং একা-সিলিকন ("একা" একটি সংস্কৃত শব্দ যার অর্থ "এক")।

১৮৭৫ সালে, ফরাসি রসায়নবিদ পল-এমিল ল্যকক দ্য বোইসবউদ্রান, মেন্ডেলিভের ভবিষ্যদ্বাণীর কথা না জেনেই, স্ফ্যালেরাইট খনিজের একটি নমুনায় একটি নতুন মৌল আবিষ্কার করেন এবং এর নাম দেন গ্যালিয়াম। তিনি মৌলটিকে আলাদা করে এর বৈশিষ্ট্য নির্ধারণ করা শুরু করেন। ল্যকক দ্য বোইসবউদ্রানের প্রকাশনা পড়ে মেন্ডেলিভ একটি চিঠি পাঠান যেখানে তিনি দাবি করেন গ্যালিয়াম আসলে তাঁর ভবিষ্যৎবাণী করা একা-অ্যালুমিনিয়াম। যদিও ল্যকক দ্য বোইসবউদ্রান প্রথমে সন্দিহান ছিলেন এবং ভেবেছিলেন মেন্ডেলিভ আবিষ্কারের কৃতিত্ব নেওয়ার চেষ্টা করছেন, পরবর্তীতে তিনি স্বীকার করে নেন যে মেন্ডেলিভ সঠিক ছিলেন। ১৮৭৯ সালে, সুইডিশ রসায়নবিদ লার্স ফ্রেড্রিক নিলসন একটি নতুন মৌল আবিষ্কার করেছিলেন, যার নাম তিনি রেখেছিলেন স্ক্যান্ডিয়াম: এটি আসলে একা-বোরন বলে প্রমাণিত হয়। একা-সিলিকন ১৮৮৬ সালে জার্মান রসায়নবিদ ক্লিমেন্স উইঙ্কলার আবিষ্কার করেন এবং এর নাম দেন জার্মেনিয়াম। গ্যালিয়াম, স্ক্যান্ডিয়াম এবং জার্মেনিয়ামের বৈশিষ্ট্য মেন্ডেলিভের ভবিষ্যদ্বাণীর সাথে মিলে যায়।
এখানেই শেষ নয়! উনিশ শতকের শেষের দিকে নিষ্ক্রিয় গ্যাসগুলি আবিষ্কার মেন্ডেলিভের পর্যায় সারণিতে চমৎকারভাবে খাপ খেয়ে যায়। এই মৌলগুলো অষ্টম মূল গ্রুপ হিসেবে যুক্ত হয়, যদিও মেন্ডেলিভ এদের ভবিষ্যদ্বাণী করেননি। তবে ল্যান্থানাইডদের সারণীতে খাপ খাওয়ানো নিয়ে মেন্ডেলিভ সমস্যায় পড়েন। এই মৌলগুলো অন্যান্য মৌলের মতো যোজনীতে পর্যায়ক্রমিক পরিবর্তন দেখায় না। অনেক অনুসন্ধানের পর, চেক রসায়নবিদ বোহুস্লাভ ব্রাউনার ১৯০২ সালে পরামর্শ দেন যে ল্যান্থানাইডদের পর্যায় সারণির একটি নির্দিষ্ট গ্রুপেই একসাথে রাখা যেতে পারে। তিনি জ্যোতির্বৈজ্ঞানিক সাদৃশ্যের ভিত্তিতে এটিকে "অ্যাস্টেরয়েড হাইপোথিসিস" নাম দেন: যেভাবে মঙ্গল ও বৃহস্পতির মধ্যে একটি গ্রহাণু বলয় রয়েছে, ঠিক তেমনি ইট্রিয়ামের নিচের স্থানটিতে একটি মৌলের পরিবর্তে সমস্ত ল্যান্থানাইড থাকতে পারে।
পারমাণবিক সংখ্যা
[সম্পাদনা]
পরমাণুর অভ্যন্তরীণ গঠনের অনুসন্ধানের পর, ওলন্দাজ পদার্থবিদ অ্যান্টোনিয়াস ভ্যান ডেন ব্রুক ১৯১৩ সালে প্রস্তাব করেন যে পরমাণুর কেন্দ্রের আধান (nuclear charge) মৌলের পর্যায় সারণীতে অবস্থান নির্ধারণ করে। নিউজিল্যান্ডের পদার্থবিদ আর্নেস্ট রাদারফোর্ড এই আধানকে "পারমাণবিক সংখ্যা" হিসেবে অভিহিত করেন। ভ্যান ডেন ব্রুকের প্রকাশিত নিবন্ধে, তিনি প্রথম ইলেকট্রনিক পর্যায় সারণী স্থাপন করেন যেখানে মৌলগুলোকে তাদের ইলেকট্রনের সংখ্যা অনুসারে সাজানো হয়েছে। রাদারফোর্ড ১৯১৪ সালে তার গবেষণাপত্রে নিশ্চিত করেন যে বোর ভ্যান ডেন ব্রুকের মতামত গ্রহণ করেছিলেন।

একই বছর, ইংরেজ পদার্থবিদ হেনরি মোসলে এক্স-রে স্পেকট্রোস্কোপি ব্যবহার করে পরীক্ষামূলকভাবে ভ্যান ডেন ব্রুকের প্রস্তাবনা নিশ্চিত করেছেন। মোসলে অ্যালুমিনিয়াম থেকে স্বর্ণ পর্যন্ত প্রতিটি মৌলের নিউক্লিয়ার চার্জ নির্ধারণ করেন এবং দেখান যে মেন্ডেলিভের পর্যায় সারণী আসলে নিউক্লিয়ার আধানের ক্রম অনুসারে মৌলগুলিকে সাজিয়েছে। নিউক্লিয়ার আধান হলো প্রোটনের সংখ্যার সমান এবং প্রতিটি মৌলের পারমাণবিক সংখ্যা (Z) এর মান নির্ধারণ করে। পারমাণবিক সংখ্যা ব্যবহার করে মৌলগুলিকে একটি নির্দিষ্ট পূর্ণসংখ্যা-ভিত্তিক ক্রমে সাজানো যায়। মোসলে-র গবেষণা পারমাণবিক ভর এবং রাসায়নিক বৈশিষ্ট্যের মধ্যেকার পার্থক্যগুলিকে দ্রুত সমাধান করে দেয়; উদাহরণস্বরূপ টেলুরিয়াম এবং আয়োডিনের ক্ষেত্রে পারমাণবিক সংখ্যা বৃদ্ধি পায় কিন্তু পারমাণবিক ভর হ্রাস পায়। যদিও প্রথম বিশ্বযুদ্ধে মোসলে অল্প বয়সেই মারা গিয়েছিলেন, সুইডিশ পদার্থবিদ ম্যান সিগবান ইউরেনিয়াম পর্যন্ত কাজ চালিয়ে যান এবং নিশ্চিত করেন যে এটি তখনকার সর্বোচ্চ পারমাণবিক সংখ্যা (৯২) বিশিষ্ট মৌল। মোসলে এবং সিগবানের গবেষণার ভিত্তিতে, এটিও জানা যায় যে কোন পারমাণবিক সংখ্যাগুলো এখনও আবিষ্কৃত হয়নি (যেমন ৪৩, ৬১, ৭২, ৭৫, ৮৫, এবং ৮৭)। (জাপানি রসায়নবিদ মাসাতাকা ওগাওয়া ১৯০৮ সালে ৭৫ নম্বর মৌল আবিষ্কার করেছিলেন এবং এটিকে "নিপোনিয়াম" নাম দেন, কিন্তু ভুলক্রমে এটিকে ৭৫ এর পরিবর্তে ৪৩ হিসেবে চিহ্নিত করেছিলেন, তাই তার আবিষ্কার পরবর্তীতে যথাযথ স্বীকৃতি পায়নি। বর্তমানে স্বীকৃত ৭৫ নম্বর মৌলের আবিষ্কারটি হয় ১৯২৫ সালে যখন ওয়াল্টার নোডাক, ইডা ট্যাকে এবং অটো বার্গ এটিকে স্বাধীনভাবে আবিষ্কার করেন এবং নাম দেন রেনিয়াম।)
পারমাণবিক পদার্থবিদ্যার সূচনা আইসোটোপের অবস্থানকেও স্পষ্ট করে তোলে। তেজস্ক্রিয় মৌল থোরিয়াম ও ইউরেনিয়ামের ক্ষয় ধারায়, শীঘ্রই স্পষ্ট হয়ে ওঠে যে এখানে অনেক আপাত নতুন মৌল রয়েছে যাদের ভিন্ন পারমাণবিক ভর কিন্তু একই রাসায়নিক বৈশিষ্ট্য রয়েছে। ১৯১৩ সালে, ফ্রেডরিক সডি এই পরিস্থিতিকে ব্যাখ্যা করার জন্য "আইসোটোপ" শব্দটি প্রবর্তন করেন, এবং তিনি আইসোটোপগুলিকে মূলত একই মৌলের বিভিন্ন রূপ হিসেবে বিবেচনা করেছিলেন। এটি টেলুরিয়াম এবং আয়োডিনের পার্থক্যগুলিকে আরও স্পষ্ট করে তোলে: টেলুরিয়ামের প্রাকৃতিক আইসোটোপিক গঠন আয়োডিনের তুলনায় ভারী আইসোটোপসমৃদ্ধ, কিন্তু টেলুরিয়ামের পারমাণবিক সংখ্যা কম।
ইলেকট্রন শক্তিস্তর
[সম্পাদনা]ডেনিশ পদার্থবিজ্ঞানী নিলস বোর পরমাণুর ক্ষেত্রে ম্যাক্স প্ল্যাঙ্কের কোয়ান্টাইজেশন ধারণা প্রয়োগ করেন। তিনি এই সিদ্ধান্তে উপনীত হন যে ইলেকট্রনের শক্তিস্তরগুলি কোয়ান্টাইজড: স্থিতিশীল শক্তি অবস্থার শুধুমাত্র একটি পৃথক সেট অনুমোদিত। বোর এরপর ১৯১৩ সালে ইলেকট্রন কনফিগারেশনের মাধ্যমে পর্যায়বৃত্ততা বোঝার চেষ্টা করেন। তিনি অনুমান করেন যে, একটি মৌলের রাসায়নিক বৈশিষ্ট্যের জন্য ভিতরের ইলেকট্রনগুলোই দায়ী। ১৯১৩ সালে, তিনি একটি কোয়ান্টাম পরমাণুর উপর ভিত্তি করে প্রথম ইলেকট্রনিক পর্যায় সারণী তৈরি করেন।
বোর ১৯১৩ সালে তার ইলেকট্রন শেলগুলোকে "বলয়" (rings) হিসেবে আখ্যায়িত করেন। এই গ্রহগত মডেলের সময়ে শেলের (shell) ভেতর পারমাণবিক কক্ষপথের (atomic orbital) কোন ধারণাই ছিলনা। নিজের ১৯১৩ সালের বিখ্যাত গবেষণাপত্রের তৃতীয় পর্বে বোর উল্লেখ করেন যে একটি শেলে সর্বোচ্চ আটটি ইলেকট্রন থাকতে পারে। তিনি লিখেন, "আমরা আরও দেখতে পাই যে, যদি n<8 না হয়, তবে n সংখ্যক ইলেক্ট্রন বিশিষ্ট কোন বলয় একটি ne চার্জ বিশিষ্ট নিউক্লিয়াসের চারপাশে ঘুরতে পারবে না।" অপেক্ষাকৃত ছোট পরমাণুর জন্য ইলেকট্রন শেলগুলো নিম্নরূপে পূরণ হবে: "ইলেকট্রনের বলয়গুলো শুধু তখনই যুক্ত হবে যদি সেগুলোতে সমান সংখ্যক ইলেকট্রন থাকে; তাই অনুযায়ী ভেতরের বলয়গুলোতে ইলেকট্রনের সংখ্যা শুধুমাত্র ২, ৪, ৮ হবে।" তবে বড় পরমাণুর ক্ষেত্রে ভেতরের শেলে আটটি ইলেকট্রন থাকবে: "অন্যদিকে, মৌলসমূহের পর্যায় সারণী স্পষ্টভাবে পরামর্শ দেয় যে, ইতিমধ্যেই নিয়ন (N=10) এ আটটি ইলেকট্রন বিশিষ্ট একটি ভেতরের বলয় তৈরি হয়ে যাবে।" পরমাণুর জন্য তিনি যেই ইলেকট্রন কনফিগারেশন প্রস্তাব করেছেন (ডানদিকে দেখানো হয়েছে) তার বেশিরভাগই বর্তমানে পরিচিত কনফিগারেশনের সাথে মেলে না। পরবর্তীতে আর্নল্ড সামারফিল্ড এবং এডমন্ড স্টোনার আরও কোয়ান্টাম সংখ্যা আবিষ্কারের পর এই কনফিগারেশনগুলোর উন্নতি ঘটেছিল।
বোরের ইলেকট্রন বিন্যাস (হালকা উপাদানের জন্য)
| উপাদান | প্রতি শেলে ইলেকট্রনের সংখ্যা |
|---|---|
| 4 | 2, 2 |
| 6 | 2, 4 |
| 7 | 4, 3 |
| 8 | 4, 2, 2 |
| 9 | 4, 4, 1 |
| 10 | 8, 2 |
| 11 | 8, 2, 1 |
| 16 | 8, 4, 2, 2 |
| 18 | 8, 8, 2 |
১৯১৪ সালে ওয়ালথার কোসেল এবং ১৯১৬ সালে বোরের পারমাণবিক তত্ত্বের রাসায়নিক বিভবকে (chemical potentials) নিয়মতান্ত্রিকভাবে সম্প্রসারণ ও সংশোধন করেন। কোসেল ব্যাখ্যা করেন যে পর্যায় সারণীতে বাইরের শেলে ইলেকট্রন যুক্ত হওয়ার সাথে সাথে নতুন মৌল তৈরি হয়। কোসেল তার গবেষণাপত্রে লিখেছেন: "এটি এই উপসংহারে নিয়ে যায় যে পরবর্তীতে যুক্ত হওয়া ইলেকট্রনগুলো কেন্দ্রমুখী বলয় বা শেলে স্থাপন করা উচিত। এদের প্রতিটিতে... একটি নির্দিष्ट সংখ্যক ইলেকট্রন থাকবে, যা আমাদের ক্ষেত্রে আটটি। একটি বলয় বা শেল সম্পূর্ণ হওয়ার পরে পরবর্তী মৌলের জন্য একটি নতুন শেল শুরু করতে হবে: সহজে অ্যাক্সেসযোগ্য এবং সবচেয়ে বাইরের প্রান্তে থাকা ইলেকট্রনগুলোর সংখ্যা আবার মৌল থেকে মৌলে বৃদ্ধি পায় এবং তাই প্রতিটি নতুন শেল তৈরিতে রাসায়নিক পর্যাবৃত্ততা পুনরাবৃত্ত হয়।"
১৯১৯ সালে, আরভিং ল্যাংমুয়ার তাঁর একটি গবেষণাপত্রে 'কোষ' (cells) এর ব্যাখ্যা করেন। আমরা এখন সেই 'কোষ' গুলিকে অরবিটাল হিসেবে জানি। একটি অরবিটালে সর্বোচ্চ দুইটি ইলেকট্রন থাকতে পারে। এই অরবিটালগুলি কতগুলি 'আস্তরণে' বা শেলে সুসজ্জিত থাকে। আমরা এখন এগুলোকে ইলেকট্রন শেল হিসেবে জানি। ল্যাংমুয়ারের মতে, সর্বপ্রথম শেলে সর্বাধিক দুইটি ইলেকট্রন থাকতে পারে। ১৯২১ সালে রসায়নবিদ চার্লস রুগলে বারি বলেন যে, একটি শেলে আট বা আঠারোটি ইলেকট্রন থাকলে তা একটি স্থিতিশীল পর্যায়ে থাকে। বারি আরও বলেন, ট্রানজিশন মৌলের (যেগুলোকে ট্রানজিশন ধাতু হিসেবেও জানা যায়) ইলেকট্রন বিন্যাস ওই মৌলের বাহিরের শেলে উপস্থিত ইলেকট্রনের সংখ্যার ওপর নির্ভরশীল । তিনি এই মৌলগুলোর নাম দেন ট্রানজিশন মৌল। জর্জেস আর্বাইন নামের একজন বিজ্ঞানী দাবি করেন যে তিনি ৭২তম মৌলটি আবিষ্কার করেছেন। তিনি এর নাম রাখেন সেলটিয়াম। কিন্তু, বারি এবং নিলস বোরের ধারণা ছিলো যে ৭২তম মৌলটি একটি বিরল মৃত্তিকা ধাতু (rare earth element) হতে পারে না, বরং জিরকোনিয়ামের সমগোত্রীয় মৌল হওয়ার সম্ভাবনাই বেশি। এরপর ডার্ক কস্টার ও জর্জ ভন হেভেসি এই ৭২তম মৌলটিকে জিরকোনিয়াম আকরিকে খুঁজতে থাকেন ও আবিষ্কার করেন। বোরের জন্মস্থান কোপেনহেগেন শহরের ল্যাটিন নাম 'হাফনিয়া' অনুসারে তারা এই নতুন মৌলের নাম রাখেন হাফনিয়াম। পরে জানা যায় আর্বাইনের সেলটিয়াম আসলে বিশুদ্ধ লুটেটিয়ামের (৭১তম মৌল) একটি রূপ ছিল। এভাবে হাফনিয়াম ও রেনিয়াম শেষ স্থিতিশীল মৌল হিসেবে আবিষ্কৃত হয়।
বোরের অনুপ্রেরণায় ১৯২৩ সালে উলফগ্যাং পাউলি ইলেকট্রন বিন্যাসের ওপর কাজ শুরু করেন। পাউলি বোরের মডেলকে আরও এগিয়ে নিয়ে যান চারটি কোয়ান্টাম সংখ্যা ব্যবহার করে। পাউলির বহিঃবর্তন নীতি অনুসারে, দুইটি ইলেকট্রনের চারটি কোয়ান্টাম সংখ্যা কখনোই একই হতে পারে না। এর ফলে পর্যায় সারণীর প্রতিটি পর্যায়ের দৈর্ঘ্যের ব্যাখ্যা সহজ হয়। কোন শেলে সর্বাধিক কতগুলো ইলেকট্রন থাকতে পারে পর্যায়ের দৈর্ঘ্য তারই নির্দেশক (২, ৮, ১৮, ৩২)। ১৯২৫ সালে ফ্রিডরিখ হান্ড আধুনিক ইলেকট্রন বিন্যাস পদ্ধতির খুব কাছাকাছি একটি সূত্রে উপনীত হন। রাসায়নিকভাবে সক্রিয় বা যোজ্য ইলেকট্রনের উপর ভিত্তি করে পর্যায় সারণীর নতুন নিয়ম তৈরি হয়। ১৯২৬ সালে আরউইন ম্যাডেলুং প্রথম Aufbau নীতির পর্যবেক্ষণমূলক ব্যাখ্যা দেন। ১৯৩০ সালে ভ্লাদিমির কারাপেটফ প্রথম এটি প্রকাশ করেন।

কোয়ান্টাম তত্ত্ব স্পষ্টভাবে প্রমাণ করেছে যে ট্রানজিশন ধাতু (transition metals) এবং ল্যান্থানাইডস (lanthanides) মৌলিক গ্রুপগুলোর মধ্যে 'ব্রিজ' হিসাবে কাজ করে এবং তাদের নিজস্ব পৃথক গ্রুপ হিসেবে অবস্থান করে। যদিও এর আগেই, কিছু রসায়নবিদ পর্যায় সারণীতে এসব মৌলকে এভাবেই স্থান দিতে প্রস্তাব করেছিলেন। ইংরেজ রসায়নবিদ হেনরি ব্যাসেট ১৮৯২ সালে, ডেনিশ রসায়নবিদ জুলিয়াস থমসেন ১৮৯৫ সালে এবং সুইস রসায়নবিদ আলফ্রেড ওয়ার্নার ১৯০৫ সালে এই ধরনের প্রস্তাবনা দেন। বোর তার ১৯২২ সালের নোবেল বক্তৃতায় থমসেনের প্রস্তাবিত সারণীর ফর্ম ব্যবহার করেছিলেন। আলফ্রেড ওয়ার্নারের প্রস্তাবিত ফর্মটি বর্তমান সময়ে ব্যবহৃত ৩২-কলামের পর্যায় সারণীর সাথে অনেকটাই মিলে যায়। গুরুত্বপূর্ণভাবে, এই তত্ত্বগুলো ব্রাউনারের "অ্যাস্টেরয়েডাল হাইপোথিসিস" কে প্রতিস্থাপিত করেছিল।
ল্যান্থানাইডসমূহের সঠিক অবস্থান, এবং এর ফলে গ্রুপ ৩ এর উপাদানগুলো নিয়ে দশকের পর দশক ধরে বিতর্ক থেকে যায় কারণ তাদের ইলেকট্রন বিন্যাস প্রাথমিকভাবে ভুলভাবে নির্ধারিত হয়েছিল। রাসায়নিক কারণের উপর ভিত্তি করে ব্যাসেট, ওয়ার্নার এবং বুরি স্ক্যান্ডিয়াম এবং ইট্রিয়ামকে ল্যান্থানামের সাথে জোড়া না দিয়ে লুটেটিয়ামের সাথে গ্রুপবদ্ধ করেছিলেন (লুটেশিয়াম তখনও আবিষ্কৃত হয়নি বলে ইট্রিয়ামের নিচে একটি ফাঁকা স্থান রাখা হয়েছিল)। ১৯২৭ সালে হুন্ড ধারণা করেছিলেন যে সমস্ত ল্যান্থানাইড পরমাণুরই [Xe]4f0−145d16s2 ইলেক্ট্রন বিন্যাস রয়েছে, কারণ তারা প্রধানত ত্রিযোজী। এটি এখন জানা গেছে যে রসায়ন এবং ইলেকট্রন কনফিগারেশনের মধ্যে সম্পর্ক এর চেয়ে অনেক জটিল। প্রাথমিক স্পেকট্রোস্কোপিক তথ্য এই কনফিগারেশনের ধারণা জোরালো করেছিল, ফলে পর্যায় সারণির গঠন এমন হয়েছিল যেখানে গ্রুপ ৩ এ ছিল স্ক্যান্ডিয়াম, ইট্রিয়াম, ল্যান্থানাম এবং অ্যাক্টিনিয়াম। চৌদ্দটি f-উপাদান ল্যান্থানাম এবং হ্যাফনিয়ামের মধ্যে d ব্লককে বিভক্ত করে দিয়েছিল। কিন্তু পরে জানা যায় যে পনেরোটি ল্যান্থানাইডের মধ্যে মাত্র চারটির জন্য এটি সত্য (ল্যান্থানাম, সেরিয়াম, গ্যাডোলিনিয়াম এবং লুটেটিয়াম)। অন্যান্য ল্যান্থানাইড পরমাণুর একটিও d-ইলেকট্রন নেই। বিশেষভাবে ইটারবিয়াম 4f শেলটি সম্পূর্ণ করে, এবং সেই কারণে সোভিয়েত পদার্থবিদ লেভ ল্যান্ডাউ এবং ইয়েভজেনি লিফশিটজ ১৯৪৮ সালে লক্ষ্য করেছিলেন যে লুটেটিয়াম সঠিকভাবে একটি f-ব্লক উপাদান হিসাবে নয় বরং একটি d-ব্লক উপাদান হিসাবে বিবেচিত হবে; ১৯৬৩ সালে জন কনডো প্রথম পরামর্শ দিয়েছিলেন যে বাল্ক ল্যান্থানাম হলো একটি f-ধাতু, এর নিম্ন তাপমাত্রার অতিপরিবাহিতার ভিত্তিতে । পরমাণুর নিম্ন-স্তরের উত্তেজিত অবস্থা যা রাসায়নিক পরিবেশে ভূমিকা রাখতে পারে - সেগুলোর দিকে তাকিয়ে এই ব্যাপারটি উপলব্ধি করা যায়, ফলে উপাদানগুলোকে ব্লক দ্বারা শ্রেণীবদ্ধ করা এবং পর্যায় সারণিতে অবস্থান দেওয়া সহজতর হয়। অনেক লেখক পরবর্তীতে পদার্থবিজ্ঞান, রসায়ন এবং ইলেকট্রনিক বিষয়ের উপর ভিত্তি করে এই সংশোধনটি পুনরায় আবিষ্কার করেছিলেন এবং এটি সমস্ত প্রাসঙ্গিক উপাদানের ক্ষেত্রে প্রয়োগ করেছিলেন। ফলস্বরূপ গ্রুপ ৩ তে স্ক্যান্ডিয়াম, ইট্রিয়াম, লুটেটিয়াম এবং লরেনসিয়াম রয়েছে, এবং ল্যান্থানাম থেকে ইটারবিয়াম এবং অ্যাক্টিনিয়াম থেকে নোবেলিয়ামকে f-ব্লক সারি হিসাবে রাখা হয়েছে। এই সংশোধিত সংস্করণটি ম্যাডেলুং নীতির সাথে সামঞ্জস্যপূর্ণ এবং ব্যাসেট, ওয়ার্নার এবং বুরির প্রাথমিক রাসায়নিক স্থানকে সঠিক বলে প্রমাণ করে।
১৯৮৮ সালে, IUPAC গ্রুপ ৩ এর এই উপাদান-বিন্যাস সমর্থন করে একটি প্রতিবেদন প্রকাশ করে, একটি সিদ্ধান্ত যা ২০২১ সালে পুনরায় নিশ্চিত করা হয়েছে। গ্রুপ ৩ এর বিন্যাস নিয়ে পাঠ্যপুস্তকে এখনও বৈচিত্র্য পাওয়া যেতে পারে, এবং এই বিন্যাসটির বিরুদ্ধে কিছু যুক্তি আজও প্রকাশিত হচ্ছে। কিন্তু যে রসায়নবিদ এবং পদার্থবিজ্ঞানীরা বিষয়টি বিবেচনা করেছেন তারা সাধারণত গ্রুপ ৩ এ স্ক্যান্ডিয়াম, ইট্রিয়াম, লুটেটিয়াম এবং লরেনসিয়াম থাকার ব্যাপারে একমত হন। তারা প্রতি-যুক্তিকে অসামঞ্জস্যপূর্ণ বলে মনে করে সেগুলোকে চ্যালেঞ্জ জানান।
কৃত্রিম মৌল
[সম্পাদনা]
১৯৩৬ সালের মধ্যে, হাইড্রোজেন থেকে ইউরেনিয়াম পর্যন্ত মৌলসমূহের মধ্যে শূন্যস্থান ছিল মাত্র চারটি। ৪৩, ৬১, ৮৫, এবং ৮৭ নম্বর মৌলগুলো তখনো আবিষ্কৃত হয়নি। ৪৩ নম্বর মৌলটি সর্বপ্রথম কৃত্রিমভাবে তৈরি করা হয়। প্রকৃতিতে না পাওয়া গিয়ে এই মৌলটি পারমাণবিক বিক্রিয়ার মাধ্যমে সৃষ্টি করা হয়েছিল। এটি আবিষ্কার করেছিলেন ইতালীয় রসায়নবিদ এমিলিও সেগ্রে এবং কার্লো পেরিয়ার ১৯৩৭ সালে। তারা তাদের আবিষ্কারের নাম দেন টেকনেটিয়াম, যা 'কৃত্রিম' অর্থবোধক একটি গ্রীক শব্দ থেকে এসেছে। একইভাবে, ৬১তম (প্রমিথিয়াম) এবং ৮৫তম (অ্যাস্টাটাইন) মৌল কৃত্রিমভাবে আবিষ্কার হয়, যথাক্রমে ১৯৪৫ এবং ১৯৪০ সালে। ৮৭তম মৌল (ফ্র্যান্সিয়াম) প্রকৃতিতে আবিষ্কৃত সর্বশেষ মৌল, আবিষ্কার করেন ফরাসি রসায়নবিদ মার্গুরিট পেরে ১৯৩৯ সালে।
ইউরেনিয়ামের পরবর্তী মৌলগুলিও কৃত্রিমভাবে আবিষ্কৃত হয়েছিল। শুরুটা করেছিলেন এডউইন ম্যাকমিলান এবং ফিলিপ অ্যাবেলসন ১৯৪০ সালে নেপচুনিয়াম আবিষ্কারের মাধ্যমে (ইউরেনিয়ামকে নিউট্রন দিয়ে আঘাত করে)। গ্লেন টি. সিবার্গ এবং লরেন্স বার্কলি ন্যাশনাল ল্যাবরেটরি (LBNL)-এর গবেষক দল এই আবিষ্কারের ধারা অব্যাহত রাখেন। তারা ১৯৪১ সালে প্লুটোনিয়াম আবিষ্কারের মাধ্যমে ট্রান্সইউরেনিয়াম মৌলগুলি আবিষ্কার শুরু করেন। আবিষ্কৃত হয় যে, তৎকালীন ধারণার বিপরীতে, অ্যাক্টিনিয়ামের পরবর্তী মৌলগুলো ট্রানজিশন মৌল নয়, বরং ল্যান্থানাইডের সদস্য। বাসেট (১৮৯২), ওয়ার্নার (১৯০৫), এবং ফরাসি প্রকৌশলী চার্লস জেনেট (১৯২৮) পূর্বে এই ধারণা দিয়েছিলেন, কিন্তু তখন তা সার্বজনীনভাবে স্বীকৃতি পায়নি। সিবার্গ তাই তাদের অ্যাক্টিনাইড বলে অভিহিত করেছিলেন। ১৯৫৫ সাল পর্যন্ত ১০১ পর্যন্ত নম্বরের মৌলগুলি (মেন্ডেলিভের সম্মানে যার নাম দেওয়া হয়েছিল মেন্ডেলিভিয়াম) নিউট্রন বা আলফা-কণার তেজস্ক্রিয়তা দ্বারা তৈরি করা হয়েছিল, বা ৯৯ (আইনস্টাইনিয়াম) এবং ১০০ (ফার্মিয়াম) মৌলের ক্ষেত্রে পারমাণবিক বিস্ফোরণের মাধ্যমে সৃষ্টি করতে হয়েছিল।
১৯৬০ এবং ১৯৭০-এর দশকে ১০২ থেকে ১০৬ পর্যন্ত মৌলগুলি নিয়ে একটি উল্লেখযোগ্য বিতর্কের সৃষ্টি হয়। কারণ LBNL টিম (এবার নেতৃত্বে ছিলেন অ্যালবার্ট ঘিওরসো) এবং সোভিয়েত বিজ্ঞানীদের যৌথ পারমাণবিক গবেষণা ইনস্টিটিউট (JINR)-এর একটি দলের মধ্যে প্রতিযোগিতা শুরু হয় (যার নেতৃত্বে ছিলেন জর্জি ফ্লায়েরভ)। প্রতিটি দল আবিষ্কারের দাবি করেছিল, এবং কিছু ক্ষেত্রে প্রত্যেকে মৌলটির জন্য নিজস্ব নাম প্রস্তাব করেছিল। এর ফলে দশকব্যাপী একটি মৌলের নামকরণ নিয়ে বিতর্কের সৃষ্টি হয়েছিল। এই উপাদানগুলি লাইট আয়ন দিয়ে অ্যাক্টিনাইডগুলিকে আঘাত করে তৈরি করা হয়েছিল। IUPAC প্রথমে একটি নিরপেক্ষ অবস্থান গ্রহণ করেছিল, এটা দেখতে অপেক্ষা করতে পছন্দ করে যে কোনো ঐকমত্য আসে কিনা। কিন্তু যেহেতু তখন শীতল যুদ্ধও তুঙ্গে ছিল, তাই এটা স্পষ্ট হয়ে গেল যে ঐকমত্য আসবে না। এভাবে, IUPAC এবং ইন্টারন্যাশনাল ইউনিয়ন অফ পিওর অ্যান্ড অ্যাপ্লায়েড ফিজিক্স (IUPAP) একটি ট্রান্সফারমিয়াম ওয়ার্কিং গ্রুপ (TWG, ফার্মিয়াম হলো ১০০ নম্বর মৌল) ১৯৮৫ সালে আবিষ্কারের মানদণ্ড নির্ধারণের জন্য প্রতিষ্ঠিত হয়। এই মানদন্ড ১৯৯১ সালে প্রকাশিত হয়েছিল। কিছুটা বিতর্কের পর ১৯৯৭ সালে সর্বশেষে মৌলগুলো তাঁদের চূড়ান্ত নাম পায়, যার মধ্যে ছিল সিবার্গের সম্মানে নামকরণ করা সিবোর্গিয়াম (১০৬)।

TWG-এর নির্দিষ্ট মাপকাঠি LBNL এবং JINR-এর মতো গবেষণা প্রতিষ্ঠানের নতুন মৌল আবিষ্কারের দাবির মধ্যস্থতা করতে ব্যবহার করা হয়েছিল। এছাড়াও জার্মানি (GSI) এবং জাপানের (Riken) প্রতিষ্ঠানের দাবিগুলোর ক্ষেত্রেও এগুলো ব্যবহৃত হয়। বর্তমানে, আবিষ্কারের দাবি যাচাইয়ের কাজটি IUPAC/IUPAP যৌথ কর্মীদল দ্বারা পরিচালিত। অগ্রাধিকার দেওয়ার পরে, মৌলগুলিকে আনুষ্ঠানিকভাবে পর্যায় সারণিতে যুক্ত করা হয়েছিল, এবং আবিষ্কর্তাদের নাম প্রস্তাব করার জন্য আমন্ত্রণ জানানো হয়েছিল। ২০১৬ সালের মধ্যে, ১১৮ পর্যন্ত সমস্ত মৌলের জন্য এই প্রক্রিয়া সম্পন্ন হয়, যার ফলে পর্যায় সারণির প্রথম সাতটি সারি সম্পূর্ণ হয়। ১০৬-এর বেশি মৌলের আবিষ্কার সম্ভব হয়েছিল JINR-এ ইউরি ওগানেসিয়ান দ্বারা তৈরি কৌশলের কারণে। শীতল ফিউশন (ভারী আয়ন দিয়ে সীসা এবং বিসমাথের উপর বোমাবর্ষণ) ১৯৮১-২০০৪ সালে GSI-তে ১০৭ থেকে ১১২ পর্যন্ত মৌলের আবিষ্কারকে সম্ভব করে তোলে। এছাড়াও Riken-এ মৌল ১১৩ এর আবিষ্কার সম্ভব হয়। তিনি (আমেরিকান বিজ্ঞানীদের সাথে সহযোগিতায়) JINR দলকে ১৯৯৮-২০১০ সালে ১১৪ থেকে ১১৮ পর্যন্ত মৌল আবিষ্কারে নেতৃত্ব দেন। এতে ব্যবহৃত হয় গরম ফিউশন (ক্যালসিয়াম আয়ন দ্বারা অ্যাক্টিনাইডের উপর বোমাবর্ষণ)। সবচেয়ে ভারী পরিচিত মৌল, ওগানেসন (১১৮), ওগানেসিয়ানের সম্মানে নামকরণ করা হয়েছে। মৌল ১১৪-কে তার পূর্বসূরী এবং পরামর্শদাতা ফ্লিওরভের সম্মানে ফ্লেরোভিয়াম নামে নামকরণ করা হয়।
পর্যায় সারণির ১৫০তম বার্ষিকী উপলক্ষে, জাতিসংঘ ২০১৯ সালকে আন্তর্জাতিক পর্যায় সারণি বর্ষ হিসেবে ঘোষণা করেছে, যা "বিজ্ঞানের অন্যতম গুরুত্বপূর্ণ অর্জন" উদযাপন করে। TWG-এর তৈরি আবিষ্কারের মাপকাঠি ১৯৯১ সালে যেসব পরীক্ষামূলক এবং তাত্ত্বিক অগ্রগতির কথা কল্পনাও করা যায়নি, সেগুলোর প্রেক্ষিতে ২০২০ সালে আপডেট করা হয়েছে। আজ, পর্যায় সারণি রসায়নের অন্যতম স্বীকৃত প্রতীক। নতুন মৌলের স্বীকৃতি এবং নামকরণ, গ্রুপ নম্বর এবং সমষ্টিগত নামগুলি সুপারিশ করা, পারমাণবিক ভর আপডেট করা, এইসব কাজের সাথে আজ IUPAC জড়িত।
সপ্তম পর্যায়ের পরবর্তী সম্প্রসারণ
[সম্পাদনা]
সর্বশেষ যেসব মৌলের নামকরণ হয়েছে– নিহোনিয়াম (113), মস্কোভিয়াম (115), টেনেসিন (117), and ওগানেসন (118)– সেগুলো পর্যায় সারণীর সপ্তম সারিটি পূর্ণ করেছে। এরপরের মৌলগুলো অষ্টম সারি থেকে শুরু হবে। এই মৌলগুলোকে হয়তো তাদের পারমাণবিক সংখ্যা দিয়ে (যেমন, "মৌল 119"), অথবা 1978 সালে প্রবর্তিত IUPAC নিয়মানুসারে তৈরি নাম দিয়ে (যেমন, মৌল 119-এর নাম ununennium, যা ল্যাটিন unus "one", গ্রিক ennea "nine", এবং ধাতব মৌলের ঐতিহ্যবাহী -ium প্রত্যয় থেকে এসেছে) উল্লেখ করা হবে। এ পর্যন্ত এধরনের মৌল সংশ্লেষণের সকল প্রচেষ্টা ব্যর্থ হয়েছে। Riken গবেষণা প্রতিষ্ঠানে ২০১৮ সাল থেকে মৌল 119 তৈরির প্রচেষ্টা চলমান রয়েছে। মার্কিন যুক্তরাষ্ট্রের LBNL এবং রাশিয়ার JINR প্রতিষ্ঠানদ্বয় অষ্টম পর্যায়ের প্রথম কয়েকটি মৌল সংশ্লেষণের নিজস্ব প্রচেষ্টা চালানোর পরিকল্পনা করেছে।
অষ্টম পর্যায় যদি পূর্ববর্তী পর্যায়গুলোর ধারার অনুসরণ করে, তাহলে এতে পঞ্চাশটি মৌল থাকবে, যেগুলো ক্রমান্বয়ে 8s, 5g, 6f, 7d, এবং শেষে 8p উপকক্ষগুলো পূর্ণ করবে। কিন্তু এক্ষেত্রে আপেক্ষিকতার প্রভাবগুলো ম্যাডেলাং নীতিকে তাৎপর্যপূর্ণভাবে প্রভাবিত করবে। অষ্টম পর্যায়ের মৌলসমূহের ইলেকট্রন বিন্যাস এবং পর্যায় সারণীতে তাদের কীভাবে দেখানো হবে সে ব্যাপারে বিভিন্ন মডেল প্রস্তাব করা হয়েছে। এইসব মডেল একমত যে, পূর্ববর্তী পর্যায়গুলোর মতোই অষ্টম পর্যায় দুটি 8s মৌল (119 এবং 120) দিয়ে শুরু হবে। যাইহোক, তারপরে 5g, 6f, 7d, এবং 8p উপকক্ষগুলোর মধ্যে ব্যাপক শক্তিগত অধিক্রমণের ফলে সেগুলো একসাথে পূর্ণ হতে শুরু করবে। ফলে 5g, 6f সারিগুলোকে সুনির্দিষ্টভাবে আলাদা করা বেশ জটিল হয়ে যাবে। তাই 121 থেকে 156 পর্যন্ত মৌলগুলি পর্যায় সারণীর পূর্ববর্তী অংশে থাকা কোনও মৌলের রাসায়নিক সাদৃশ্য প্রকাশ করে না, যদিও তাদের ইলেক্ট্রন বিন্যাস প্রতিফলিত করার জন্য কখনো কখনো 5g, 6f এবং অন্যান্য সারিতে স্থাপন করা হয়। এরিক শেরি প্রশ্ন তুলেছেন – এইসব ব্যতিক্রম উপেক্ষিত হবে নাকি বিস্তৃত পর্যায় সারণী তৈরির সময় এখানে ম্যাডেলাং নীতির ব্যর্থতাকেও হিসেবে নেওয়া হবে। এই অঞ্চলে উপকক্ষের গঠনও হয়তো আনুষ্ঠানিকভাবে নির্ধারিত হবে। ধারণা করা হচ্ছে, কোনো সুনির্দিষ্ট উপকক্ষের গঠন না থাকায় ওগানেসন পরমাণুর ইলেক্ট্রন বিন্যাস বেশ অভিন্ন হবে।
১৫৭ থেকে ১৭২ পর্যন্ত মৌলের রাসায়নিক বৈশিষ্ট্য সম্ভবত পর্যায় সারণির শুরুর দিকের সারিগুলির সাথে মিল দেখাবে। এই পরিবর্তনের কারণ হলো ভারী p-শেলগুলো স্পিন-অরবিট মিথস্ক্রিয়ার দ্বারা বিভক্ত হয়ে যায়। একই ধরণের পরিবর্তন সব ধরনের শেলের জন্য ঘটলেও p-শেলগুলোর ক্ষেত্রে এটি সবচেয়ে বড় পার্থক্য তৈরি করে। ১৫৭ নম্বর মৌলের ক্ষেত্রে সম্ভবত পূর্ণ 8s এবং 8p1/2 শক্তিস্তরগুলো মূল/কোরের সাথে যুক্ত হয়ে গেছে। এরপরের কক্ষপথগুলোর শক্তি কাছাকাছি - যেমন 7d ও 9s একই রকম শক্তির, তারপর আছে 9p1/2 এবং 8p3/2, এরপর একটি বড় শক্তির ফাঁক। সুতরাং, 9s এবং 9p1/2 কক্ষপথগুলি মূলত 8s এবং 8p1/2 শক্তিস্তরের স্থান নেয়। তাই, মৌল ১৫৭-১৭২ সম্ভবত রাসায়নিকভাবে ৩ থেকে ১৮ গ্রুপের মৌলের অনুরূপ হবে। উদাহরণস্বরূপ, মৌল ১৬৪ সাধারণ নিয়মে ১৪ নম্বর গ্রুপে সীসার (lead) দুই ঘর নিচে থাকার কথা থাকলেও, হিসেব অনুযায়ী এটি ১০ নম্বর গ্রুপে প্যালাডিয়ামের খুব কাছাকাছি বৈশিষ্ট্য দেখাবে। এইভাবে, পরবর্তী নিষ্ক্রিয় গ্যাসের দেখা পেতে ১১৮ এর পরে ৫০ এর পরিবর্তে ৫৪ টি মৌলের প্রয়োজন হবে। মৌল ১৫৭ থেকে ১৭২ এর রাসায়নিক বৈশিষ্ট্য নিয়ে মডেলগুলোর মধ্যে একমত থাকলেও, পর্যায় সারণিতে রাসায়নিক সাদৃশ্যের ভিত্তিতে মৌল সাজানো উচিত, নাকি ইলেকট্রন বিন্যাসের উপর ভিত্তি করে সাজানো উচিত (যা আগের পর্যায়গুলো থেকে বেশ আলাদা) - তা নিয়ে মতবিরোধ রয়েছে। তাই পর্যায় সারণির অষ্টম সারির আসল বিন্যাস নিয়ে আলোচনা অব্যাহত রয়েছে।
মৌল ১৭২-এর পরে, 1s ইলেকট্রনের শক্তিস্তর কাল্পনিক হয়ে যায়, যা গণনাগুলোকে জটিল করে তোলে। এই অবস্থাটির একটি বাস্তব ব্যাখ্যা রয়েছে, এবং এর মানে এই না যে পর্যায় সারণি সেখানেই থেমে যাবে। তবে মৌলের হিসাব করার জন্য এই ধরণের অবস্থা সঠিকভাবে বহু-ইলেকট্রন গণনায় অন্তর্ভুক্ত করার উপায় এখনও একটি উন্মুক্ত সমস্যা। এটির সমাধান পর্যায় সারণির কাঠামো আরও বড় মৌলের জন্য নির্ণয় করতে প্রয়োজন হবে।
পরমাণুর নিউক্লিয়াসের প্রোটনের মধ্যকার বিকর্ষণ বল এবং প্রোটন ও নিউট্রনকে একসাথে আবদ্ধ রাখা শক্তিশালী নিউক্লিয় বলের ভারসাম্য - এই দুটি বিষয় নিউক্লিয়ার স্থিতিশীলতাকে প্রভাবিত করে। ইলেকট্রনের মতোই প্রোটন এবং নিউট্রনও নির্দিষ্ট শক্তিস্তরে বা শেলে অবস্থান করে। একটি পরিপূর্ণ শেল নিউক্লিয়াসের স্থিতিশীলতা উল্লেখযোগ্যভাবে বাড়াতে পারে। এমন একটি পরিপূর্ণ শেলের কারণেই সম্ভবত ১১৪-১২৬ টি প্রোটন এবং ১৮৪ টি নিউট্রন-সমৃদ্ধ সুপারহেভি নিউক্লাইডগুলোর অস্তিত্ব আছে। এই সুপারহেভি নিউক্লাইডগুলো হয়তো 'দীর্ঘায়ু দ্বীপ' বা 'island of stability' এর কাছাকাছি অবস্থান করে। এই 'আইল্যান্ড অফ স্টেবিলিটি' তে তুলনামূলক বেশি দীর্ঘজীবী সুপারহেভি নিউক্লাইডের অস্তিত্ব থাকার কথা। এই দীর্ঘজীবী নিউক্লাইডগুলোর আয়ুষ্কাল মাইক্রোসেকেন্ড থেকে কয়েক মিলিয়ন বছর পর্যন্ত হতে পারে বলে ধারণা করা হচ্ছে। তবে এখানে একটি গুরুত্বপূর্ণ বিষয় হলো – বিজ্ঞানীরা মূলত পরমাণুর কেন্দ্র বা নিউক্লিয়াস সম্পর্কিত তথ্যের অনুমানের উপর এসব তত্ত্ব দাঁড় করিয়েছেন। তাই এই অনুমানের যথার্থতা যাচাই করার প্রয়োজন আছে।
পরিপূর্ণ শেল অতিক্রম করার সাথে সাথে স্থিতিশীলতার প্রভাব কমে যেতে পারে। ফলে, ১৮৪টির বেশি নিউট্রনযুক্ত সুপারহেভি নিউক্লাইডের আয়ুষ্কাল অনেক কম হবে। এগুলো সম্ভবত ১০^-১৫ সেকেন্ডের মধ্যেই স্বতঃস্ফূর্তভাবে বিভাজিত (spontaneous fission) হয়ে যাবে। যদি তাই হয়, তবে এগুলোকে মৌল হিসেবে বিবেচনা করা যৌক্তিক হবে না। IUPAC (ইন্টারন্যাশনাল ইউনিয়ন অফ পিওর অ্যান্ড অ্যাপ্লায়েড কেমিস্ট্রি) একটি পরমাণুকে মৌল হিসেবে বিবেচনা করার জন্য এর নিউক্লিয়াসের আয়ুষ্কাল কমপক্ষে ১০^-১৪ সেকেন্ড ধরে রাখার শর্ত দিয়েছে। এই সময়ের মধ্যে নিউক্লিয়াসকে একটি ইলেকট্রন ক্লাউড বা মেঘ দ্বারা বেষ্টিত হতে হয়। তবে নিউক্লীয় আয়ুষ্কাল সম্পর্কিত তাত্ত্বিক অনুমানগুলো অনেকটাই মডেলের উপর নির্ভরশীল, যার ফলে অনুমিত আয়ুষ্কালের মধ্যে ব্যাপক পার্থক্য দেখা যায়। প্রোটনগুলোর পারস্পরিক বিকর্ষণের ফলে নিউক্লিয়াসের গঠন বুদবুদ, বলয় এবং টরাসের মতো অদ্ভুত আকার ধারণ করতে পারে বলে ধারণা করা হচ্ছে, যা আরও জটিলতা তৈরি করে। অপরদিকে অগনেসনের ইলেকট্রন শেলের মতো নিউক্লিয়ার শেলগুলোতে একটি অনিশ্চয়তা তৈরি হচ্ছে, যার ফলে পরবর্তী শেলগুলো আদৌ অস্তিত্বশীল কিনা তা নিয়েও প্রশ্ন দেখা দিচ্ছে। এছাড়া, যদি পরবর্তী শেলগুলোর অস্তিত্ব থাকেও, সেগুলোর কারণে ভারী মৌলগুলোর আয়ুষ্কাল বাড়বে কিনা তা-ও নিশ্চিত নয়। তাই, ধারণা করা হচ্ছে ১২০ নম্বরের মৌলের পরেই পর্যায় সারণি শেষ হয়ে যেতে পারে। কারণ, ১২০ এর পর মৌলগুলো তাদের অস্থিতিশীলতার কারণে পর্যবেক্ষণ করা যাবে না। খুব অল্প সময়ের মধ্যেই এগুলোর পতন ঘটবে, যার ফলে এগুলোর রসায়ন পর্যালোচনা অসম্ভব হবে। নতুন মৌল আবিষ্কারের যুগও সমাপ্তির দিকে এগিয়ে যেতে পারে। যদি ১২৬ এর বেশি প্রোটন-বিশিষ্ট কোনো পরিপূর্ণ শেলের অস্তিত্ব থাকে, তবে সম্ভবত সেটি ১৬৪ এর কাছাকাছি হবে। ফলে অস্থিতিশীল মৌলগুলো এই শেলের দুই পাশে অবস্থান করবে যেখানে পর্যায়বদ্ধতার বৈশিষ্ট্য আর কাজ করবে না।
তবে 'কোয়ার্ক ম্যাটার'-ও উচ্চ পারমাণবিক ভর-এ স্থিতিশীল হতে পারে। কোয়ার্কে মৌলের নিউক্লিয়াসে প্রোটন এবং নিউট্রন থাকার পরিবর্তে মুক্তভাবে প্রবহমান 'আপ' ও 'ডাউন' কোয়ার্ক থাকতে পারে। তাহলে 'island of stability' বা দীর্ঘায়ু দ্বীপের পরিবর্তে একটি 'continent of stability' বা 'দীর্ঘায়ু মহাদেশ' তৈরি হতে পারে। তাছাড়া আরো নানা কারণ প্রভাব ফেলতে পারে।
অষ্টম সারির মৌলের অস্তিত্ব থাকলেও সেগুলো তৈরি করা খুবই কঠিন হবে এবং পারমাণবিক সংখ্যা বাড়ার সাথে সাথে এটা আরো জটিল হয়ে যাবে। বর্তমানে আমাদের যে প্রযুক্তি আছে, তা দিয়ে ১১৯ এবং ১২০ নম্বরের মৌল পর্যন্ত তৈরি করা সম্ভব হতে পারে। এরপরের মৌলগুলো উৎপাদনে সম্ভবত সম্পূর্ণ নতুন প্রযুক্তির প্রয়োজন হবে – যদি উৎপাদনটা আদৌ সম্ভব হয়! এসব মৌলের রাসায়নিক বৈশিষ্ট্যগুলো পরীক্ষামূলকভাবে ব্যাখ্যা করাও একটি বিশাল চ্যালেঞ্জ হবে।
বিকল্প পর্যায় সারণী
[সম্পাদনা]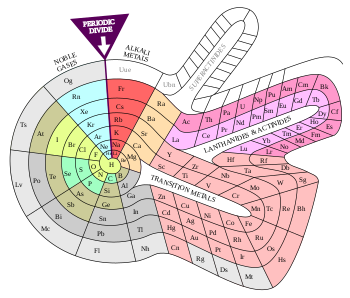
পর্যায় সূত্র অনেকভাবে প্রকাশ করা যেতে পারে, এবং প্রচলিত পর্যায় সারণী এর একটি মাত্র রূপ। ১৮৬৯ সালে মেন্ডেলিফের পর্যায় সারণীর আবির্ভাবের ১০০ বছরের মধ্যে, এডওয়ার্ড জি মাজুরস আনুমানিক ৭০০টি ভিন্ন ধরণের প্রকাশিত পর্যায় সারণী সংগ্রহ করেছিলেন। অনেকগুলি রূপই আয়তাকার কাঠামো বজায় রাখে, যার মধ্যে রয়েছে চার্লস জেনেটের বাম-ধাপের পর্যায় সারণী (নীচের ছবিতে), এবং মেন্ডেলিফের মূল ৮-স্তম্ভ বিন্যাসের আধুনিকীকরণ যা রাশিয়ায় এখনও প্রচলিত। অন্যান্য কিছু পর্যায় সারণীর আকার অনেক বেশি আকর্ষণীয়, যেমন সর্পিল (ডানদিকের ছবিতে অটো থিওডর বেনফির সারণী), বৃত্তাকার বা ত্রিভুজাকার।
মৌলিক উপাদানগুলোর রাসায়নিক বা ভৌত বৈশিষ্ট্যগুলিকে আরও পরিষ্কারভাবে উপস্থাপনের লক্ষ্যে প্রায়শই বিকল্প পর্যায় সারণী তৈরি করা হয়। বিকল্প সারণিগুলিতে রসায়ন বা পদার্থবিজ্ঞানের প্রাধান্য দেওয়া হয়। প্রচলিত রূপটি, যা সর্বাধিক জনপ্রিয়, তা মোটামুটিভাবে মাঝামাঝি অবস্থানে রয়েছে।
পর্যায় সারণীর বিভিন্ন রূপ থেকে কিছু প্রশ্নের উদ্ভব হয়েছে - সর্বোত্তম বা চূড়ান্ত পর্যায় সারণী আছে কিনা, এবং থাকলে তা কেমন হতে পারে। এইসব প্রশ্নের জন্য বর্তমানে কোনো সর্বসম্মত উত্তর নেই। পর্যায় সারণীর সর্বোত্তম বা মৌলিক রূপ হওয়ার জন্য জ্যানেটের বাম-ধাপের সারণী সম্পর্কে ক্রমবর্ধমান আলোচনা হচ্ছে। এরিচ সেরি এটির পক্ষে লিখেছেন, কারণ এটি হিলিয়ামকে একটি s-ব্লক উপাদান হিসেবে উপস্থাপন করে। এই সারণী সকল বিভাগের দৈর্ঘ্যের পুনরাবৃত্তি করে আরও নিয়মতান্ত্রিক হয়, এবং প্রতিটি বিভাগকে 'n + ℓ' এর একটি মানের সাথে সম্পর্কিত করে ম্যাডেলং-এর নিয়ম সঠিকভাবে অনুসরণ করে।
যদিও তিনি মনে করেন ক্ষারীয় মৃত্তিকা ধাতুগুলির উপরে হিলিয়ামের অবস্থানকে রাসায়নিক দৃষ্টিকোণ থেকে একটি অসুবিধা হিসাবে দেখা যেতে পারে, তবুও প্রথম-সারির ব্যতিক্রমের দিকটি উল্লেখ করে তিনি এর পাল্টা যুক্তি দেন। তিনি দেখান যে পর্যায় সারণী "মৌলিকভাবে কোয়ান্টাম বলবিজ্ঞানের ওপর নির্ভরশীল" এবং মৌলগুলোর বিমূর্ত ধর্মাবলী (আণবিক ধর্মের পরিবর্তে) বিবেচনা করে।
| f1 | f2 | f3 | f4 | f5 | f6 | f7 | f8 | f9 | f10 | f11 | f12 | f13 | f14 | d1 | d2 | d3 | d4 | d5 | d6 | d7 | d8 | d9 | d10 | p1 | p2 | p3 | p4 | p5 | p6 | s1 | s2 | |||
| 1s | H | He | ||||||||||||||||||||||||||||||||
| 2s | Li | Be | ||||||||||||||||||||||||||||||||
| 2p 3s | B | C | N | O | F | Ne | Na | Mg | ||||||||||||||||||||||||||
| 3p 4s | Al | Si | P | S | Cl | Ar | K | Ca | ||||||||||||||||||||||||||
| 3d 4p 5s | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | Rb | Sr | ||||||||||||||||
| 4d 5p 6s | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | Cs | Ba | ||||||||||||||||
| 4f 5d 6p 7s | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | Fr | Ra | ||
| 5f 6d 7p 8s | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | Uue | Ubn | ||
| f-block | d-block | p-block | s-block | |||||||||||||||||||||||||||||||
আরও দেখুন
[সম্পাদনা]তথ্যসূত্র
[সম্পাদনা]- ↑ মেইজা, জুরিস; ও অন্যান্য (২০১৬)। "Atomic weights of the elements 2013 (IUPAC Technical Report)" [মৌলের পারমাণবিক ওজন ২০১৩ (আইইউপিএসি প্রযুক্তিগত প্রতিবেদন)]। পিওর অ্যান্ড অ্যাপ্লায়েড কেমিস্ট্রি (ইংরেজি ভাষায়)। ৮৮ (৩): ২৬৫–৯১। ডিওআই:10.1515/pac-2015-0305
 ।
।
- ↑ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. (২০২২-০৫-০৪)। "Standard atomic weights of the elements 2021 (IUPAC Technical Report)"। Pure and Applied Chemistry (ইংরেজি ভাষায়)। আইএসএসএন 1365-3075। ডিওআই:10.1515/pac-2019-0603।
- ↑ An element zero (i.e. a substance composed purely of neutrons), is included in a few alternate presentations, for example, in the Chemical Galaxy. See Labarca, M. (২০১৬)। "An element of atomic number zero?"। New Journal of Chemistry। 40 (11): 9002–9006। ডিওআই:10.1039/C6NJ02076C।
- ↑ Greenwood & Earnshaw, pp. 24–27
- ↑ Conradie, Jeanet; Ghosh, Abhik (২০১৯)। "Theoretical Search for the Highest Valence States of the Coinage Metals: Roentgenium Heptafluoride May Exist"। Inorganic Chemistry। 58 (13): 8735–8738। ডিওআই:10.1021/acs.inorgchem.9b01139।
- ↑ Grochala, Wojciech; Mazej, Zoran (২০১৫)। "Chemistry of silver(II): a cornucopia of peculiarities"। Philosophical Transactions of the Royal Society A। 373। ডিওআই:10.1098/rsta.2014.0179। সংগ্রহের তারিখ ২৩ ডিসেম্বর ২০২১।
- ↑ "Electron Configurations"। www.chem.fsu.edu। Florida State University। মে ৬, ২০২০। ৬ মে ২০২২ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২০২২-০৪-১৭।
- ↑ উদ্ধৃতি ত্রুটি:
<ref>ট্যাগ বৈধ নয়;PekkaPyykkoনামের সূত্রটির জন্য কোন লেখা প্রদান করা হয়নি - ↑ Carrasco, Rigo A.; Zamarripa, Cesy M.; Zollner, Stefan; Menéndez, José; Chastang, Stephanie A.; Duan, Jinsong; Grzybowski, Gordon J.; Claflin, Bruce B.; Kiefer, Arnold M. (২০১৮)। "The direct bandgap of gray α-tin investigated by infrared ellipsometry"। Applied Physics Letters। 113 (23): 232104। এসটুসিআইডি 125130534। ডিওআই:10.1063/1.5053884। বিবকোড:2018ApPhL.113w2104C।
- ↑ "Periodic Table of Chemical Elements"। www.acs.org। American Chemical Society। ২০২১। ৩ ফেব্রুয়ারি ২০২১ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২৭ মার্চ ২০২১।
- ↑ উদ্ধৃতি ত্রুটি:
<ref>ট্যাগ বৈধ নয়;jensenlawনামের সূত্রটির জন্য কোন লেখা প্রদান করা হয়নি - ↑ উদ্ধৃতি ত্রুটি:
<ref>ট্যাগ বৈধ নয়;Thyssenনামের সূত্রটির জন্য কোন লেখা প্রদান করা হয়নি - ↑ উদ্ধৃতি ত্রুটি:
<ref>ট্যাগ বৈধ নয়;BFrickeনামের সূত্রটির জন্য কোন লেখা প্রদান করা হয়নি - ↑ উদ্ধৃতি ত্রুটি:
<ref>ট্যাগ বৈধ নয়;BFricke1977নামের সূত্রটির জন্য কোন লেখা প্রদান করা হয়নি
গ্রন্থপঞ্জি
[সম্পাদনা]- Greenwood, N. N.; Earnshaw, A. (১৯৯৭)। Chemistry of the Elements (2nd সংস্করণ)। Butterworth-Heinemann। আইএসবিএন 0080379419।
- Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (২০০২)। General chemistry: principles and modern applications
 (8th সংস্করণ)। Upper Saddle River, N.J.: Prentice Hall। আইএসবিএন 978-0-13-014329-7। এলসিসিএন 2001032331। ওসিএলসি 46872308।
(8th সংস্করণ)। Upper Saddle River, N.J.: Prentice Hall। আইএসবিএন 978-0-13-014329-7। এলসিসিএন 2001032331। ওসিএলসি 46872308। - Siekierski, S.; Burgess, J. (২০০২)। Concise Chemistry of the Elements। Horwood। আইএসবিএন 978-1-898563-71-6।
- Scerri, Eric R (2020). The Periodic Table, Its Story and Its Significance (2nd ed.). Oxford University Press, New York, আইএসবিএন ৯৭৮-০-১৯-০৯১৪৩৬-৩.
- Wulfsberg, Gary (২০০০)। Inorganic Chemistry। University Science Books। আইএসবিএন 9781891389016।
আরও পড়ুন
[সম্পাদনা]- Calvo, Miguel (২০১৯)। Construyendo la Tabla Periódica। Zaragoza, Spain: Prames। পৃষ্ঠা 407। আইএসবিএন 978-84-8321-908-9।
- Emsley, J. (২০১১)। "The Periodic Table"। Nature's Building Blocks: An A–Z Guide to the Elements (New সংস্করণ)। Oxford: Oxford University Press। পৃষ্ঠা 634–651। আইএসবিএন 978-0-19-960563-7।
- Fontani, Marco; Costa, Mariagrazia; Orna, Mary Virginia (২০০৭)। The Lost Elements: The Periodic Table's Shadow Side। Oxford: Oxford University Press। পৃষ্ঠা 508। আইএসবিএন 978-0-19-938334-4।
- Mazurs, E. G. (১৯৭৪)। Graphical Representations of the Periodic System During One Hundred Years। Alabama: University of Alabama Press। আইএসবিএন 978-0-19-960563-7।
- Rouvray, D.H.; King, R. B., সম্পাদকগণ (২০০৪)। The Periodic Table: Into the 21st Century। Proceedings of the 2nd International Conference on the Periodic Table, part 1, Kananaskis Guest Ranch, Alberta, 14–20 July 2003। Baldock, Hertfordshire: Research Studies Press। আইএসবিএন 978-0-86380-292-8।
- Rouvray, D.H.; King, R. B., সম্পাদকগণ (২০০৬)। The Mathematics of the Periodic Table। Proceedings of the 2nd International Conference on the Periodic Table, part 2, Kananaskis Guest Ranch, Alberta, 14–20 July 2003। New York: Nova Science। আইএসবিএন 978-1-59454-259-6।
- Scerri, E (n.d.)। "Books on the Elements and the Periodic Table" (পিডিএফ)। ১১ আগস্ট ২০২০ তারিখে মূল (পিডিএফ) থেকে আর্কাইভ করা। সংগ্রহের তারিখ ৯ জুলাই ২০১৮।
- Scerri, E.; Restrepo, G, সম্পাদকগণ (২০১৮)। Mendeleev to Oganesson: A Multidisciplinary Perspective on the Periodic Table। Proceedings of the 3rd International Conference on the Periodic Table, Cuzco, Peru 14–16 August 2012। Oxford: Oxford University Press। আইএসবিএন 978-0-86380-292-8।
- van Spronsen, J. W. (১৯৬৯)। The Periodic System of Chemical Elements: A History of the First Hundred Years। Amsterdam: Elsevier। আইএসবিএন 978-0-444-40776-4।
- Verde, M., সম্পাদক (১৯৭১)। Atti del convegno Mendeleeviano: Periodicità e simmetrie nella struttura elementare della materia [Proceedings of the Mendeleevian conference: Periodicity and symmetry in the elementary structure of matter]। 1st International Conference on the Periodic Table, Torino-Roma, 15–21 September 1969। Torino: Accademia delle Scienze di Torino।
বহিঃসংযোগ
[সম্পাদনা]- Periodic Table featured topic page on Science History Institute Digital Collections featuring select visual representations of the periodic table of the elements, with an emphasis on alternative layouts including circular, cylindrical, pyramidal, spiral, and triangular forms.
- IUPAC Periodic Table of the Elements
- Dynamic periodic table, with interactive layouts
- Eric Scerri, leading philosopher of science specializing in the history and philosophy of the periodic table
- The Internet Database of Periodic Tables
- Periodic table of endangered elements
- Periodic table of samples
- Periodic table of videos ওয়েব্যাক মেশিনে আর্কাইভকৃত ৩ জুলাই ২০২৩ তারিখে
- WebElements
- The Periodic Graphics of Elements





