জৈব রসায়ন

জৈব রসায়ন হলো রসায়নের একটি শাখা যা হাইড্রোকার্বন ও হাইড্রোকার্বনের জাতকসমূহের গঠন, ধর্ম, সংযুক্তি এবং প্রস্তুতি বা সংশ্লেষণ আলোচনা করে। এসব যৌগকে বলে জৈব যৌগ। জৈব যৌগ যেকোনো সংখ্যক মৌলিক পদার্থের সমন্বয়ে গঠিত হতে পারে। এসকল যৌগে সাধারণত হাইড্রোজেন, কার্বন, নাইট্রোজেন, অক্সিজেন, হ্যালোজেন, ফসফরাস, সিলিকন, সালফার ইত্যাদি থাকে।[১][২][৩] জৈব যৌগসমূহ গাঠনিক দিক থেকে কিছুটা ভিন্ন এবং এদের প্রয়োগ অত্যন্ত ব্যাপক। অসংখ্য পদার্থের (রঙ, প্লাস্টিক, খাদ্য, বিস্ফোরক, ঔষধ, জ্বালানি ইত্যাদি আরো অনেক) মূল গঠনকারী উপাদান হল জৈব যৌগ। কিছু ব্যতিক্রম বাদে প্রায় সব জৈবিক ক্রিয়ার মৌলিক অংশের গঠনকারী ও নিয়ন্ত্রণকারী উপাদান জৈব যৌগ। বিজ্ঞানের অন্য সব শাখার মতো জৈব রসায়নেও রয়েছে আবিষ্কারের স্বতন্ত্র ধারা। এইসব আবিষ্কার বা নব প্রবর্তনের মূলে রয়েছে বাস্তব, তাত্ত্বিক ও প্রায়োগিক বিভিন্ন দিক। জৈব রসায়নের ভিত্তি প্রতিষ্ঠিত হয়েছে পলিমার বিজ্ঞান, ফার্মাসিউটিক্যাল রসায়ন, বস্তুবিজ্ঞান এবং অ্যা কৃষিরসায়নের বিভিন্ন শাখায় এর ব্যাপক প্রয়োগের মাধ্যমে।
ইতিহাস[সম্পাদনা]

উনবিংশ শতাব্দীর প্রথমভাগে রসায়নবিদরা ধারণা করত যে জীব হতে প্রাপ্ত যৌগসমূহ সংশ্লেষণাত্মকভাবে তৈরি করা অত্যন্ত জটিল। প্রাণশক্তি মতবাদ অনুসারে, জৈব পদার্থসমূহ এক ধরনের প্রাণশক্তির অধিকারী। তারা এসকল যৌগের নাম দিলেন জৈব যৌগ; এবং অজৈব পদার্থের রসায়নের গবেষণায় আত্মনিয়োগ করলেন। কেননা, অজৈব রসায়ন তুলনামূলকভাবে সহজ।
১৮১৫ খ্রিষ্টাব্দে বার্জেলিয়াস প্রাণশক্তি তত্ত্বের vital force theory দ্বারা জৈব এবং অজৈব যৌগগুলি পার্থক্য করেন্ তিনি বলেন: "যৌগগুলোর উৎপত্তির জন্য উদ্ভিদ কিংবা প্রাণীদেহে উপস্থিত প্রাণশক্তির প্রয়োজন হয়।" তার মতে, এই শক্তি মানুষের করায়ত্ত নয়, তাই পরীক্ষাগারে অজৈব যৌগ থেকে জৈব যৌগগুলি প্রস্তুত করা সম্ভব নয় । উনবিংশ শতাব্দীর প্রথম অর্ধে এটা প্রমাণিত হয় যে, জৈব যৌগসমূহ গবেষণাগারে সংশ্লেষণ করা সম্ভব। ১৮১৬ সালের দিকে ফরাসি রসায়নবিদ মাইকেল শেভরিউল চর্বি ও ক্ষারের মাধ্যমে গঠিত সাবান নিয়ে গবেষণা শুরু করেন। সে উপলব্ধি করলো যে, বিভিন্ন এসিড ও ক্ষারের সমন্বয়ে সাবান তৈরি হয়। তিনি আরও কিছু যৌগ তৈরির মাধ্যমে প্রমাণ করলেন যে প্রাণশক্তির প্রভাব ছাড়াও চর্বির রাসায়নিক পরিবর্তন সাধন সম্ভব। ১৮২৮ সালে জার্মান বিজ্ঞানী ফ্রেডরিখ ভোলার মানুষের মূত্রের একটি জৈব উপাদান ইউরিয়া তৈরি করলেন অজৈব যৌগ অ্যামোনিয়াম সায়ানেট হতে। তিনি অ্যামোনিয়াম ক্লোরাইড ও লেড সায়ানেট এর বিক্রিয়া অক্সিজেন প্রভাবকের সাহায্যে উচ্চ চাপ এবং ২০০ ডিগ্রি সেলসিয়াস তাপমাত্রায় ঘটিয়ে অ্যামোনিয়াম সায়ানেট নামক লবণ এবং লেড ক্লোরাইড উৎপন্ন করেন। অ্যামোনিয়াম সায়ানেটকে তাপ দিলে এর আণবিক গঠন বিন্যাসের মাধ্যমে ইউরিয়া তৈরি হয়। এই প্রক্রিয়াকে এখন বলা হয় ভোলার সংশ্লেষণ। যদিও ভোলার এসময় এবং পরবর্তীতে প্রাণশক্তি ধ্বংসের দাবির ব্যাপারে সন্দিহান ছিলেন, তবুও ঐতিহাসিকরা এই ঘটনাকে একটি গুরুত্বপূর্ণ ব্যাপার হিসেবে দেখেন।
১৮৫৬ সালে আরেকটি গুরুত্বপূর্ণ ঘটনা ঘটে। বিজ্ঞানী উইলিয়াম হেনরি পার্কিন কুইনিন তৈরি করতে গিয়ে আকস্মিকভাবে এক ধরনের জৈব রং আবিষ্কার করেন। এর ফলে রঞ্জক শিল্পের প্রভূত উন্নতি হয় এবং সেসময়ে জৈব রসায়নের প্রতি বিজ্ঞানীদের আগ্রহ আরও বেড়ে যায়। ফ্রেডরিখ অগাস্ট কেকুল ও স্কট কুপারের যৌথ প্রচেষ্টায় উদ্ভূত যৌগের রাসায়নিক গঠন জৈব রসায়নের ক্ষেত্রে ব্যাপক সাফল্য বয়ে আনে। উভয় বিজ্ঞানী প্রস্তাব করেন যে, চতুর্যোজী কার্বন পরমাণু পরস্পরের সাথে যুক্ত হয়ে কার্বন ল্যাটিস গঠন করে। তারা আরও প্রস্তাব করেন যে, কার্বন পরমাণুর বিস্তারিত বিন্যাস যথোপযুক্ত রাসায়নিক বিক্রিয়ার মাধ্যমে নির্ণয় করা সম্ভব।পেট্রোলিয়ামের আবিষ্কার এবং এটি হতে পেট্রোলিয়ামের বিভিন্ন জাতক পৃথকীকরণ জৈব রসায়নের অগ্রগতিতে একটি উল্লেখযোগ্য ঘটনা। বিভিন্ন রাসায়নিক প্রক্রিয়ার মাধ্যমে যৌগসমূহের রূপান্তর পেট্রোকেমিক্যাল শিল্পের সূচনা করে। এর ফলে কৃত্রিম রাবার, বিভিন্ন আঠা জাতীয় পদার্থ ও প্লাস্টিক উৎপন্ন করা সম্ভব হলো।
উনিশ শতকের শেষের দশকে ঔষধ শিল্পের যাত্রা শুরু হয় যখন জার্মানিতে অক্সি-এ্যাসিটাইল-স্যালিসাইলিক এসিড (সাধারণভাবে অ্যাসপিরিন নামে পরিচিত) প্রথম উৎপাদিত হলো। এই প্রথম আর্সফেনামাইন নামের একটি ঔষধ প্রণালিবদ্ধভাবে উন্নীত হলো। জার্মান বিজ্ঞানী পল এর্লিক ও তার সহযোগীদের গবেষণায় আর্সানিলিক এসিড এবং এর বিভিন্ন জাতক কার্যকর হিসেবে প্রমাণিত হয় এবং ঔষধ তৈরির ক্ষেত্রে এগুলোর ব্যবহার শুরু হয়।
যদিও এতদিন পর্যন্ত জৈব যৌগসমূহের প্রয়োগ এবং রাসায়নিক বিক্রিয়া দৈবক্রমে শুভ ছিল, উনিশ শতকের পরবর্তী অর্ধেক সময়ে জৈব যৌগের ব্যাপক প্রণালিবদ্ধ গবেষণা সম্পন্ন হয়। বিশ শতকের শুরুর দিকে জৈব রসায়নের অগ্রগতির ফলে অনেক জটিল যৌগের সংশ্লেষণ সম্ভব হয়। ঐ সময়ে উপলব্ধি করা সম্ভব হলো যে, পলিমার ও এনজাইম হলো বিশালাকার জৈব অণু এবং পেট্রোলিয়াম জৈবিকভাবে প্রাপ্ত কোনো যৌগ। সরল উপদান হতে কোনো জটিল জৈব যৌগ পাওয়ার পদ্ধতিকে বলা হয় টোটাল সংশ্লেষণ। ইউরিয়ার মাধ্যমে জটিল যৌগসমূহের সংশ্লেষণ করা শুরু হলো, তবে জটিলতা আরও বেড়ে যায় গ্লুকোজ, তারপিনের সংশ্লেষণের ক্ষেত্রে। ১৯০৭ সালে টোটাল সংশ্লেষণ প্রথম বাণিজ্যিকীকরণ করা হয়। এর ফলে ঔষধ শিল্পের ব্যাপক উন্নতি সাধিত হয়।
প্রাণী, তাদের কাঠামো এবং মিথস্ক্রিয়া সংক্রান্ত বিজ্ঞান প্রাণরসায়নের যাত্রা বিশ শতকের প্রথমভাগে শুরু হয়। প্রাণ রসায়নের উদ্ভব জৈব রসায়নের ক্ষেত্রে এক বিশাল অধ্যায়ের উন্মোচন করেছে। প্রাণ রসায়নেও মূলত জৈব যৌগ, অর্থাৎ কার্বনের যৌগ সমূহ নিয়ে আলোচনা করে।
বৈশিষ্ট্য[সম্পাদনা]
জৈব যৌগসমূহ সাধারণত মিশ্রণ হিসেবে থাকে, আর তাই এদেরকে পৃথকীকরণ, যৌগের বিশুদ্ধতা নির্ণয় ইত্যাদি পদ্ধতি উদ্ভাবিত হয়েছে, বিশেষ করে গুরুত্বপূর্ণ ক্রোম্যাটোগ্রাফিতে এসকল যৌগের ব্যাপক প্রয়োগের জন্য। জৈব যৌগসমূহের পৃথকীকরণের ক্ষেত্রে প্রচলিত পদ্ধতির মধ্যে উল্লেখযোগ্য হল কেলাসন, পাতন, দ্রবণ নিষ্কাশন। জৈব যৌগসমূহকে পূর্বে বিভিন্ন রাসায়নিক প্রক্রিয়া যেমন সিক্ত পরীক্ষা দ্বারা পৃথক করা হত। কিন্তু বর্তমানে এসকল পরীক্ষার পরিবর্তে আরো অত্যাধুনিক পদ্ধতি যেমন বর্ণালিবীক্ষণ, কম্পিউটার নিয়ন্ত্রিত পরীক্ষা করা হয়।[৪] উপযোগিতা অনুসারে কিছু প্রধান বিশ্লেষণিক পরীক্ষা পদ্ধতি হলঃ
- নিউক্লীয় চৌম্বক অনুরণন বর্ণালিবীক্ষণঃ যৌগে কার্বন ও হাইড্রোজেনের পরমাণু সঠিকভাবে নির্ধারণের ক্ষেত্রে এই পদ্ধতিটি সবচেয়ে প্রচলিত। এছাড়া স্টেরিওরসায়ন সংক্রান্ত পরীক্ষা-নিরীক্ষাতেও এটি প্রয়োগ করা হয়।
- উপদানগত বিশ্লেষণঃ এক্ষেত্রে অণুতে উপাদানগত সংযুক্তি নির্ণয়ের জন্য একটি ধ্বংসাত্মক পদ্ধতি ব্যবহৃত হয়।
- ভর বর্ণালিবীক্ষণঃ যৌগের গঠন থেকে আণবিক ভর নির্ণয়ে এটি ব্যবহৃত হয়ে থাকে। উচ্চ রেজ্যোলুশনের ভর বুরণলিবীক্ষণের মাধ্যমে যৌগের সঠিক সংকেত নির্ণয় সম্ভব। পূর্বে ভর বর্ণালিবীক্ষণ শুধুমাত্র আধান নিরপেক্ষ অণুর ক্ষেত্রে প্রয়োগ করা হত তবে আধুনিক আয়নিকরণ পদ্ধতির মাহ্যমে নিরপেক্ষ বা আধানযুক্ত যেকোন অণুর ক্ষেত্রে প্রয়োগ করা যায়।
- ক্রিস্ট্যালোগ্রাফিঃ এটি একটি দ্ব্যর্থহীন পদ্ধতি যার মাধ্যমে অণুর জ্যামিতিক গঠন নির্ণয় করা হয়। তবে যে পদার্থের অণুর ক্ষেত্রে এটি প্রয়োগ করা সেটি অবশ্যই কেলাসাকার হতে হবে।
প্রচলিত বর্ণালিবীক্ষণ পধতির মধ্যে উল্লেখযোগ্য হলঃ ইনফ্রারেড বর্ণালিবীক্ষণ, অপটিক্যাল রোটেশন, UV/VIS বর্ণালিবীক্ষণ। এগুলো সাধারণত নির্দিষ্ট শ্রেণীর অন্তর্গত যৌগের ক্ষেত্রে প্রয়োগ করা হয়।
ধর্ম[সম্পাদনা]
জৈব যৌগের ভৌত ধর্মের মধ্যে পরিমাণগত এবং গুণগত উভয় ধর্মই অন্তর্ভুক্ত। পরিমাণগত বৈশিষ্টসমূহের মধ্যে রয়েছে গলনাঙ্ক, স্ফুটনাঙ্ক, প্রতিসরাঙ্ক। গুণগত বৈশিষ্টসমূহের মধ্যে রয়েছে গন্ধ, দ্রাব্যতা এবং বর্ণ।
গলনাঙ্ক এবং স্ফুটনাঙ্ক[সম্পাদনা]
অজৈব যৌগসমূহের তুলনায় জৈব যৌগসমূহ নিম্ন তাপমাত্রায় গলতে শুরু করে বা বাষ্পীভূত হতে শুরু করে। পূর্বে গলনাঙ্ক এবং স্ফুটনাঙ্কের মাধ্যমে জৈব যৌগসমূহের সনাক্তকরণ ও বিশুদ্ধতা নির্ণয় করা হত। জৈব যৌগের পোলারিটির সাথে গলনাঙ্ক এবং স্ফুটনাঙ্ক পরস্পর সম্পর্কযুক্ত। কিছু জৈব যৌগ, বিশেষ করে প্রতিসম যৌগসমূহ না গলেই বাষ্পীভূত হয়। এ ধরনের যৌগসমূহকে বলে উদ্বায়ী যৌগ। যেমন প্যারা ডাই-ক্লোরো বেনজিন একটি উদ্বায়ী যৌগ। ৩০০° সে. এর উপরে জৈব যৌগসমূহ সাধারণত স্থায়ী হয় না। তবে কিছু ব্যতিক্রম রয়েছে।
বর্ণ[সম্পাদনা]
জৈব যৌগসমূহ সাধারণত বর্ণহীন অথবা সাদা হয়ে থাকে। তবে যেসকল জৈব যৌগের অণুতে কয়েকটি ঘনসন্নিবিষ্ট বহুবন্ধন থাকে সেগুলোতে এর ব্যতিক্রম দেখা যায়। এই যৌগগুলো সাধারণত গাঢ় বর্ণের হয়। জৈব রঞ্জক ক্যারোটীন ও হিমি এ ধরনের যৌগ যারা ঘনসন্নিবিষ্ট অবস্থা ও বর্ণের মধ্যে সম্পর্ক প্রকাশ করে। অবিশুদ্ধ জৈব যৌগ এবং অনেক জৈব পদার্থ প্রায়ই হলুদ বা বাদামী রঙের হয়ে থাকে, কারণ এক্ষেত্রে সামান্য পরিমাণে রঙিন অবিশুদ্ধ দ্রব্য থাকে।
দ্রাব্যতা[সম্পাদনা]
নিরপেক্ষ জৈব যৌগসমূহ পানিতে সামান্য মাত্রায় দ্রবণীয় তবে জৈব দ্রাবকে এরা সম্পূর্ণ দ্রবণীয়। এর ব্যতিক্রম হল কম আণবিক ভর সম্পন্ন অ্যালকোহল, অ্যামিন ও কার্বক্সিলিক এসিড যেখানে হাইড্রোজেন বন্ধন বিদ্যমান এবং সেসব জৈব যৌগ যেগুলোতে আয়নায়নসম্পন্ন গ্রুপ থাকে। জৈব যৌগসমূহ জৈব দ্রাবকে দ্রবীভূত হওয়ার প্রবণতা দেখায়। দ্রাবক বিশুদ্ধ যেমন ইথার, ইথাইল অ্যালকোহল বা মিশ্রণ যেমন বিভিন্ন পেট্রোলিয়াম ইথার হতে পারে। এছাড়া পেট্রোলিয়াম হতে প্রাপ্ত সুগন্ধিযুক্ত দ্রাবকেও জৈব যৌগ দ্রবীভূত হয়। বিভিন্ন দ্রাবকে জৈব যৌগের দ্রাব্যতা দ্রাবক এবং যৌগে উপস্থিত কার্যকরী মূলকের উপর নির্ভর করে।
নামকরণ[সম্পাদনা]

জৈব যৌগসমূহের নামকরণ হয় বিভিন্ন নিয়মের মাধ্যমে প্রণালীবদ্ধ আর না হয় দীর্ঘদিন ধরে প্রচলিত বা উদ্ভূত নাম। প্রণালীবদ্ধ নামকরণ IUPAC কর্তৃক নির্ধারিত। প্রণালীবদ্ধ নামকরণ শুরু হয় কোন একটি মূল অণুর নামের মাধ্যমে। এই মূল অণুটির নামের পূর্বে বা পরে শব্দগুচ্ছ যোগ করে এবং পরমাণুর সংখ্যানুপাতিক পরিবর্তন ঘটিয়ে অন্য আরেকটি যৌগের নামকরণ করা হয়। যেহেতু জৈব যৌগের সংখ্যা অনেক তাই প্রণালীবদ্ধ নামকরণ অনেক ক্ষেত্রে ঝামেলাপূর্ণ হতে পারে। এজন্য IUPAC এর নির্দেশনা সাধারণত সরল যৌগের নামকরণের ক্ষেত্রে ব্যবহৃত হয়। প্রণালীবদ্ধ নামকরণের জন্যে মূল অণুটির আণবিক গঠন এবং নাম জানতে হয়।
প্রচলিত নামকরণ সহজ এবং দ্ব্যর্থহীন। এই ধরনের নাম যৌগের আণবিক গঠন প্রকাশ করে না। জটিল অণুর নামকরণের ক্ষেত্রে ব্যবহৃত হয়। কম্পিউটার প্রযুক্তির ব্যাপক প্রসারের কারণে অনেক ক্ষেত্রে বর্তমানে প্রযুক্তি নির্ভর নামকরণও ব্যবহৃত হয়।
গাঠনিক সংকেত[সম্পাদনা]
জৈব যৌগসমূহ সাধারণত গাঠনিক সংকেতের মাধ্যমে প্রকাশ করা হয়। এক্ষেত্রে বিভিন্ন রাসায়নিক চিহ্ন এবং প্রতীক ব্যবহৃত হয়। গাঠনিক সংকেতের শেষবিন্দু বা মিলনবিন্দু একটি কার্বন পরমাণুকে নির্দেশ করে। হাইড্রোজেন পরমাণু উল্লেখ করা হতেও পারে আবার নাও উল্লেখ করা হতে পারে। চিত্রের মাধ্যমে জৈব যৌগসমূহের উপস্থাপন সহজ কারণ প্রায় সব জৈব যৌগে কার্বন পরমাণুর চারটি বন্ধন, হাইড্রোজেনের একটি, অক্সিজেনের দুইটি এবং নাইট্রোজেনের তিনটি।
জৈব যৌগের শ্রেণিবিভাগ[সম্পাদনা]
কার্যকরী মূলক[সম্পাদনা]

জৈব যৌগের শ্রেণিবিভাগের ক্ষেত্রে এবং বৈশিষ্ট নির্ণয়ে কার্যকরী মূলকের ধারণা অত্যন্ত গুরুত্বপূর্ণ। কোন সমগোত্রীয় শ্রেণীর ধর্ম নিয়ন্ত্রণকারী মূলকই কার্যকরী মূলক নামে পরিচিত। জৈব যৌগসমূহের রাসায়নিক এবং ভৌত ধর্মের উপর কার্যকরী মূলকের প্রভাব বিদ্যমান। জৈব যৌগসমূহকে কার্যকরী মূলকের ভিত্তিতেই শ্রেণীবিভিগ করা হয়। যেমন, অ্যালকোহল একটি সমগোত্রীয় শ্রেণী যার কার্যকরী মূলক হল –OH । অ্যালকোহলসমূহ পানিতে সামান্য পরিমাণে দ্রবণীয়, এরা এস্টার এবং হ্যালাইড গঠন করে থাকে। অধিকাংশ কার্যকরী মূলকে কার্বন ও হাইড্রোজেন থাকে না।
অ্যালিফেটিক যৌগ[সম্পাদনা]
যে সব জৈব যৌগের অণুতে কার্বন পরমাণুসমূহের মুক্ত শিকল বিদ্যমান তাদের অ্যালিফেটিক যৌগ বলা হয়। যেমন :
CH4, CH3-CH3, CH3-CH2-OH
অ্যালিফেটিক যৌগসমূহকে তাদের সম্পৃক্ততার ভিত্তিতে তিনটি সমগোত্রীয় শ্রেণীতে বিভিক্ত করা হয়ঃ
- প্যারাফিন ঃ দ্বিবন্ধন বা ত্রিবন্ধনবিহীন অ্যালকেন
- অলেফিন বা অ্যালকিন ঃ যেগুলোতে এক বা একাধিক দ্বিবন্ধন উপস্থিত থাকে
- অ্যালকাইন ঃ যেগুলোতে এক বা একাধিক ত্রিবন্ধন থাকে।
অবশিষ্ট যৌগসমূহকে তাদের কার্যকরী মূলক অনুসারে শ্রেণিবিভাগ করা হয়। এগুলো সরল শিকল, শাখায়িত শিকল বা চাক্রিক হতে পারে। শিকলের ডিগ্রী যৌগের ধর্মকে প্রভাবিত করে। যেমন পেট্রোলিয়াম রসায়নে অক্টেন নাম্বার বা কিটোন নাম্বার যৌগের ধর্মকে প্রভাবিত করে।
অ্যারোমেটিক যৌগ[সম্পাদনা]
সমতলীয় চাক্রিক কাঠামো বিশিষ্ট যে সব জৈব যৌগে (4n+2) সংখ্যক সঞ্চারণশীল π (পাই) ইলেকট্রন থাকে তাদের অ্যারোমেটিক যৌগ বলে .
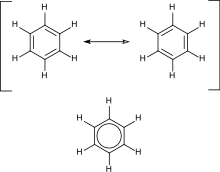
অ্যারোমেটিক হাইড্রোকার্বনে অনুবন্ধী দ্বিবন্ধন উপস্থিত থাকে। সবচেয়ে গুরুত্বপূর্ণ উদাহরণ হল বেনজিন, জার্মান রসায়নবিদ ফ্রেডরিখ অগাস্ট কেকুল কর্তৃক আবিষ্কৃত বেনজিনের ষড়ভুজীয় কাঠামোতে ইলেক্ট্রনের ডিলোকালিজেশন বা অনুরণন বিদ্যমান। প্রচলিত চাক্রিক যৌগসমূহে 4n + 2 সংখ্যক ডিলোকালাইজ্ড পাই ইলেক্ট্রন উপস্থিত থাকার কারণে অ্যারোমেটিসিটির উদ্ভব হয়। আবার 4n সংখ্যক অনুবন্ধী পাই ইলেক্ট্রন উপস্থিত থাকার কারণে যৌগের অ্যারোমেটিসিটির হ্রাস ঘটে।
হেটেরোসাইক্লিক যৌগ[সম্পাদনা]
হেটেরো-পরমাণুর উপস্থিতিতে চাক্রিক হাইড্রোকার্বনের ধর্মের পরিবর্তন ঘটে। এসব পরমাণু চাক্রিক জৈব যৌগের সাথে বহিস্থভাবে সংযুক্ত (এক্সোসাইক্লিক) থাকতে পারে আবার অভ্যন্তরেও যুক্ত (এন্ডোসাইক্লিক) থাকতে পারে। এন্ডোসাইক্লিকের ক্ষেত্রে চাক্রিক কাঠামোর অণুটিকে বলা হয় হেটেরোসাইকেল। পিরিডিন এবং ফিউরান হল অ্যারোমেটিক হেটেরোসাইক্লিকের উদাহরণ, পাইপিরিডিন এবং টেট্রাহাইড্রোফিউরান হল যথাক্রমে পিরিডিন ও ফিউরানের অ্যালিসাইক্লিক হেটেরোসাইকেল। হেটেরোসাইক্লিক অণুতে যেসকল হেটেরো-পরমাণু সাধারণত থাকে তাদের মধ্যে উল্লেখযোগ্য হল অক্সিজেন, সালফার, নাইট্রোজেন। অ্যানিলিন রঞ্জকপদার্থসমূহ হল গ্রুপ হিসেবে হেটেরোসাইক্লিকের উদাহরণ। এছাড়া প্রানরসায়নে আলোচিত অধিকাংশ যৌগই যেমন অ্যালকালয়েড, ভিটামিনের সাথে সম্পৃক্ত যৌগ, স্টেরয়েড সমূহ, নিউক্লিক এসিড এবং বিভিন্ন ঔষধ এধরনের যৌগের উদাহরণ। তুলনামূলকভাবে সরল কাঠামোর হেটেরোসাইক্লিকের উদাহরণ হল পাইরোল (৫ সদস্য বিশিষ্ট) এবং ইন্ডোল (৬ সদস্য বিশিষ্ট চাক্রিক কার্বন কাঠামো)।
একটি চাক্রিক কাঠামো অন্য আরেকটি চাক্রিক কাঠামোর অণুর সাথে যুক্ত হয়ে পলিসাইক্লিক যৌগ গঠন করতে পারে। পিউরিন নিউক্লিয়সাইড ক্ষারসমূহ পলিসাইক্লিক অ্যারোমেটিক হেটেরোসাইকেলের উল্লেখযোগ্য উদাহরণ। এধরনের অণু আরেকটি অণুর সাথে কোনাকুনিভাবে যুক্ত হতে পারে, তবে এক্ষেত্রে অবশ্যই একটি পরমাণুর (প্রায় সবক্ষেত্রেই কার্বন) দুইটি বন্ধন থাকতে হবে যার একটি চক্রের সাথে সংযুক্ত হবে এবং অন্যটি অন্যান্য পরমাণুর সাথে যুক্ত হবে। এ ধরনের যৌগকে বলে স্পাইরো, প্রাকৃতিক যৌগসমূহে প্রচুর পরিমাণে এসকল যৌগ বিদ্যমান।
পলিমার[সম্পাদনা]

কার্বনের একটি গুরুত্বপূর্ণ বৈশিষ্ট হল, কার্বন পরমাণু আরেকটি কার্বনপরমাণুর সাথে কার্বন-কার্বন বন্ধনের মাধ্যমে যুক্ত হয়ে বিশালাকার চেইন বা শিকল গঠন করে। এভাবে যুক্ত হওয়ার প্রক্রিয়াকে বলা হয় পলিমারাইজেশন আর এধরনের শিকল কাঠামোকে বলে পলিমার। মূল পরমাণু, যেটি একটির সাথে আরেকট যুক্ত হয়ে এধরনের যৌগ গঠন করে তাকে বলে মনোমার। পলিমার প্রধানত দুই প্রকারঃ একটি হল কৃত্রিমভাবে তৈরি পলিমার, এগুলোকে বলে শিল্প-পলিমার বা সংশ্লেষিত পলিমার;[৫] আরেক ধরনের পলিমার হচ্ছে প্রাকৃতিক পলিমার।
প্রথম কৃত্রিমভাবে তৈরি পলিমার হল ব্যাকেলাইট। পরবর্তিতে কৃত্রিম পলিমারের সংখ্যা আরও বৃদ্ধি পেয়েছে। সবচেয়ে পরিচিত সংশ্লেষিত জৈব পলিমারের মধ্যে উল্লেখযোগ্য হল পলিইথিলিন (পলিথিন), পলিপ্রপাইলিন, নাইলন, টেফলন (PTFE), পলিস্টাইরিন, পলিয়েস্টার, পলিমিথাইলমিথাক্রাইলেট এবং পলিভিনাইলক্লোরাইড (PVC). সিনথেটিক এবং প্রাকৃতিক রাবার উভয়ই পলিমার। এসকল পলিমার একই শ্রেণীর অন্তর্ভুক্ত। পলিমারাইজেশনের শর্তের পরিবর্তনের মাধ্যমে পলিমারসমূহের রাসায়নিক সংযুক্তির পরিবর্তন ঘটে। এক্ষেত্রে যৌগের শিকলের দৈর্ঘ্য, শাখার সংখ্যা ইত্যাদির পরিবর্তন ঘটে। একটি মনোমারের মাধ্যমে যখন যৌগ গঠিত হতে শুরু করে, তখন তাকে বলে হোমোপলিমার। ভিন্ন ভিন্ন মনোমার অংশ যুক্ত হয়ে হেটেরোপলিমার তৈরি করে। তবে ভৌত ধর্মসমূহ যেমন- কাঠিন্য, ঘনত্ব, তাপীয় রোধ, স্বচ্ছতা, বর্ণ ইত্যাদি পলিমারের সর্বশেষ সংযুক্তির উপর নির্ভরশীল।
প্রাণঅণু[সম্পাদনা]

জৈব রসায়নের অন্যতম প্রধান শাখা প্রাণরসায়ন। জীবদেহে অনেক বহুমুখী জটিল বিশালাকার অণু রয়েছে এবং এগুলো জীবের বিভিন্ন কার্যক্রমে গুরুত্বপূর্ণ ভূমিকা পালন করে। কিছু অণু বিশালাকার জৈব পলিমার, যেমন- পেপ্টাইড, DNA, RNA এবং পলিস্যাকারাইডসমূহ যেমন- প্রাণীদেহের শর্করা ও উদ্ভিদে সেলুলোজ। অন্যান্য প্রধান যৌগের মধ্যে রয়েছে অ্যামিনো এসিড (প্রোটিনের মনোমার), কার্বোহাইড্রেট, নিউক্লিক এসিড, লিপিড। এছাড়া প্রাণরসায়নের বিভিন্ন ক্ষুদ্রাকার অনূ নিয়েও আলোচনা করে যারা শক্তি উৎপাদনে সহায়তা করে এবং পরিশেষে আইসোপ্রিন তৈরি করে। প্রাণীদেহে আইসোপ্রিন গুরুত্বপূর্ণ স্টেরয়েড কাঠামো এবং স্টেরয়েড হরমোন যৌগসমূহ গঠন করে। এটি উদ্ভিদে টারপিন, টারপিনোইড, অ্যালকালয়েড এবং কিছু হাইড্রোকার্বন গথন করে, এসব হাইড্রোকার্বনকে বলে বায়োপলিমার ।
ফুলারিন[সম্পাদনা]
ফুলারিন এবং কার্বন ন্যানোটিউব হল কার্বনের বিশেষ রূপ, যাকে বলে কার্বনের বহুরূপী। এটি ৬টি কার্বন পরমাণুর প্রত্যেকটির সাথে অপর চারটির চতুস্তুলকীয় একক বন্ধন দ্বারা যুক্ত ফুটবলের ন্যায় গোলাকার অণু (C60)। Material Science বা বস্তুবিদ্যায় এ বিষয়ে আলোচনা করা হয়।
সমাণুতা এবং এর শ্রেণিবিভাগ[সম্পাদনা]
অন্যান্য[সম্পাদনা]
কার্বনের সাথে নাইট্রোজেন, অক্সিজেন এবং অন্যান্য হ্যালোজেনযুক্ত জৈব যৌগসমূহকে পৃথকভাবে শ্রেণিবিভাগ করা হয় না। এসব যৌগকে জৈব রসায়নের বড় বিভাগে অন্তর্ভুক্ত করা হয় এবং অর্গ্যানোসালফার রসায়ন, জৈবধাতব রসায়ন, অর্গ্যানোফসফরাস রসায়ন এবং অর্গ্যানোসিলিকন রসায়ন শিরোনামে আলোচনা করা হয়।
বিবধ তথ্য[সম্পাদনা]
- জৈব যৌগে দুই ধরনের সমানুতা দেখা যায় । যথা:১.গাঠনিক সমানুতা ২. স্টেরিও সমানুতা।
- অ্যারোমেটিক বেনজিন বলয়ে সব প্রতিস্থাপন বিক্রিয়াই ইলেকট্রোফিলিক।
- অর্থোপ্যারা নির্দেশক:- -OH, -NH2, -OCH3 etc
- মেটা নির্দেশক: -NO2, -CHO, -COOH, -COOR etcে
- লুইস এসিড :- AlCl3, BF3, FeCl3, ZnCl2
- লুকাস বিকারক : অনার্দ্র ZnCl2 + গাড় HCl
তথ্যসূত্র[সম্পাদনা]
- ↑ Robert T. Morrison, Robert N. Boyd, and Robert K. Boyd, Organic Chemistry, 6th edition (Benjamin Cummings, 1992, আইএসবিএন ০-১৩-৬৪৩৬৬৯-২) - this is "Morrison and Boyd", a classic textbook
- ↑ John D. Roberts, Marjorie C. Caserio, Basic Principles of Organic Chemistry,(W. A. Benjamin, Inc. ,1964) - another classic textbook
- ↑ Richard F. and Sally J. Daley, Organic Chemistry, Online organic chemistry textbook. Ochem4free.info
- ↑ "The Systematic Identification of Organic Compounds" R.L. Shriner, C.K.F. Hermann, T.C. Morrill, D.Y. Curtin, and R.C. Fuson John Wiley & Sons, 1997 0-471-59748-1
- ↑ "industrial polymers, chemistry of." এনসাইক্লোপিডিয়া ব্রিটানিকা. 2006
বহিঃসংযোগ[সম্পাদনা]
- MIT.edu ওয়েব্যাক মেশিনে আর্কাইভকৃত ২১ এপ্রিল ২০০৭ তারিখে, OpenCourseWare: Organic Chemistry I
- HaverFord.edu, Organic Chemistry Lectures, Videos and Text
- Journal of Organic Chemistry (subscription required) (Table of Contents)
- Organic Letters (Pubs.ACS.org, Table of Contents)
- Thime-Connect.com, Synlett
- Thieme-Connect.com, Synthesis
- Organic-Chemistry.org, Organic Chemistry Portal - Recent Abstracts and (Name)Reactions
- Orgsyn.org, Organic Chemistry synthesis journal
- Ochem4free.info, Home of a full, online, peer-reviewed organic chemistry text
- CEM.MSU.edu, Virtual Textbook of Organic Chemistry
- Organic Chemistry Resources WorldWide - A collection of Links
- Thinkquest.org, Organic Families and Their Functional Groups
- Organic.RogerFrost.com, Roger Frost's Organic Chemistry - multimedia for teaching and learning
- ChemHelper.com ওয়েব্যাক মেশিনে আর্কাইভকৃত ৩ ফেব্রুয়ারি ২০২০ তারিখে, Organic chemistry help
- Organic-Chemistry-Tutor.com, Organic Chemistry Tutor
- ACDlabs.com ওয়েব্যাক মেশিনে আর্কাইভকৃত ২২ জুলাই ২০১০ তারিখে, Chemical Freeware
- Chemaxon.com, Chemical Freeware from ChemAxon.
- AceOrganicChem.com,
- OrgChemInfo.8k.com, A collection of Organic chemistry Resources
- Benzylene.com, Organic Chemistry Reactions, Mechanisms, and Problems
- Beilstein-Journals.org, Beilstein Journal of Organic Chemistry (Open Access)
