ক্যালসিয়াম ক্লোরাইড

| |

| |
| নামসমূহ | |
|---|---|
| ইউপ্যাক নাম
ক্যালসিয়াম ক্লোরাইড
| |
| অন্যান্য নাম
নিরপেক্ষ ক্যালসিয়াম ক্লোরাইড; ক্যালসিয়াম(II) ক্লোরাইড, ক্যালসিয়াম ডাইক্লোরাইড (১:২), ই৫০৯
| |
| শনাক্তকারী | |
| |
ত্রিমাত্রিক মডেল (জেমল)
|
|
| সিএইচইবিআই | |
| সিএইচইএমবিএল | |
| কেমস্পাইডার | |
| ড্রাগব্যাংক | |
| ইসিএইচএ ইনফোকার্ড | ১০০.০৩০.১১৫ |
| ইসি-নম্বর |
|
| ই নম্বর | E৫০৯ (অম্লতা নিয়ন্ত্রক, ...) |
পাবকেম CID
|
|
| আরটিইসিএস নম্বর |
|
| ইউএনআইআই |
|
কম্পটক্স ড্যাশবোর্ড (EPA)
|
|
| |
| |
| বৈশিষ্ট্য | |
| CaCl2 | |
| আণবিক ভর | ১১০.৯৮ g·mol−১ |
| বর্ণ | সাদা হাইগ্রোস্কোপিক পাউডার |
| গন্ধ | গন্ধহীন |
| ঘনত্ব |
|
| গলনাঙ্ক | ৭৭২–৭৭৫ °সে (১,৪২২–১,৪২৭ °ফা; ১,০৪৫–১,০৪৮ K) অ্যানহাইড্রাস[৫] ২৬০ °সে (৫০০ °ফা; ৫৩৩ K) মোনোহাইড্রেট, পচে যায় ১৭৫ °সে (৩৪৭ °ফা; ৪৪৮ K) ডিহাইড্রেট, পচে যায় ৪৫.৫ °সে (১১৩.৯ °ফা; ৩১৮.৬ K) টেট্রাহাইড্রেট, পচে যায়[৫] ৩০ °সে (৮৬ °ফা; ৩০৩ K) হেক্সাহাইড্রেট, পচে যায়[১] |
| স্ফুটনাঙ্ক | ১,৯৩৫ °সে (৩,৫১৫ °ফা; ২,২০৮ K) অ্যানহাইড্রাস[১] |
| অ্যানহাইড্রাস: ৭৪.৫ g/১০০ mL (২০ °C)[২] হেক্সাহাইড্রেট: ৪৯.৪ g/১০০ mL (−২৫ °C) ৫৯.৫ g/১০০ mL (০ °C) ৬৫ g/১০০ mL (১০ °C) ৮১.১ g/১০০ mL (২৫ °C)[১] ১০২.২ g/১০০ mL (৩০.২ °C) α-টেট্রাহাইড্রেট: ৯০.৮ g/১০০ mL (২০ °C) ১১৪.৪ g/১০০ mL (৪০ °C) Dihydrate: ১৩৪.৫ g/১০০ mL (৬০ °C) ১৫২.৪ g/১০০ mL (১০০ °C)[৩] | |
| দ্রাব্যতা |
|
| দ্রাব্যতা in ইথানল |
|
| দ্রাব্যতা in মিথানল |
|
| দ্রাব্যতা in অ্যাসিটোন | ০.১ g/kg (২০ °C)[৪] |
| দ্রাব্যতা in পাইরিডিন | ১৬.৬ g/kg[৪] |
| অম্লতা (pKa) |
|
| −5.47·10−5 cm3/mol[১] | |
| প্রতিসরাঙ্ক (nD) | ১.৫২ |
| সান্দ্রতা |
|
| গঠন | |
| স্ফটিক গঠন |
|
| Space group |
|
| Point group |
|
| Lattice constant | |
| Coordination geometry |
অক্টাহেড্রাল at Ca2+ centres (অ্যানহাইড্রাস) |
| তাপ রসায়নবিদ্যা | |
| তাপ ধারকত্ব, C | |
| স্ট্যন্ডার্ড মোলার এন্ট্রোফি এস |
১০৮.৪ J/(mol·K)[১][৫] |
| গঠনে প্রমান এনথ্যাল্পির পরিবর্তন ΔfH |
|
গিবসের মুক্ত শক্তি (ΔfG˚)
|
−৭৪৮.৮১ kJ/mol[১][৫] |
| ঔষধসংক্রান্ত | |
| ATC code | |
| ঝুঁকি প্রবণতা | |
| প্রধান ঝুঁকিসমূহ | Irritant |
| জিএইচএস চিত্রলিপি |  [৭] [৭]
|
| জিএইচএস সাংকেতিক শব্দ | সতর্কতা |
| জিএইচএস বিপত্তি বিবৃতি | H319[৭] |
| জিএইচএস সতর্কতামূলক বিবৃতি | P305+351+338[৭] |
| এনএফপিএ ৭০৪ | |
| প্রাণঘাতী ডোজ বা একাগ্রতা (LD, LC): | |
LD৫০ (মধ্যমা ডোজ)
|
১,০০০-১,৪০০ mg/kg (rats, oral)[৮] |
| সম্পর্কিত যৌগ | |
অন্যান্য অ্যানায়নসমূহ
|
|
অন্যান্য ক্যাটায়নসমূহ
|
|
সুনির্দিষ্টভাবে উল্লেখ করা ছাড়া, পদার্থসমূহের সকল তথ্য-উপাত্তসমূহ তাদের প্রমাণ অবস্থা (২৫ °সে (৭৭ °ফা), ১০০ kPa) অনুসারে দেওয়া হয়েছে। | |
| তথ্যছক তথ্যসূত্র | |
ক্যালসিয়াম ক্লোরাইড হল একটি অজৈব যৌগ এবং লবণ, যার রাসায়নিক সূত্র CaCl2। এটি ঘরের তাপমাত্রায় একটি সাদা কঠিন স্ফটিক, এবং এটি জলে অত্যন্ত দ্রবণীয়। এটি হাইড্রোক্লোরিক অ্যাসিডকে ক্যালসিয়াম হাইড্রোক্সাইড নিরপেক্ষ করে তৈরি করা যেতে পারে।
ক্যালসিয়াম ক্লোরাইড সাধারণত হাইড্রেটেড নিরেট হিসাবে পাওয়া যায়, জেনেরিক সূত্র (CaCl2·nH2O যেখানে n = ০, ১, ২, ৪ এবং ৬) সহ। এই যৌগগুলি প্রধানত ডি-আইসিং এবং ধুলো নিয়ন্ত্রণের জন্য ব্যবহৃত হয়। যেহেতু অনহাইড্রাস লবণ হল হাইগ্রোস্কোপিক এবং ডেলিকেসেন্ট, এটি ডেসিক্যান্ট হিসাবে ব্যবহৃত হয়।[১০]
ইতিহাস[সম্পাদনা]
ক্যালসিয়াম ক্লোরাইড দৃশ্যত ১৫ শতকে আবিষ্কৃত হয়েছিল কিন্তু ১৮ শতক পর্যন্ত সঠিকভাবে অধ্যয়ন করা হয়নি।[১১] ঐতিহাসিকভাবে একে বলা হত "স্থির সাল অ্যামোনিয়াক" (লাতিন: sal ammoniacum fixum[১২]) কারণ এটি চুনের সাথে অ্যামোনিয়াম ক্লোরাইড পাতনের সময় সংশ্লেষিত হয়েছিল এবং এটি অউদ্বায়ী ছিল (যখন পূর্বেরটি সর্বশ্রেষ্ঠ দেখায়); আরো আধুনিক সময়ে (১৮-১৯শ শতক) একে বলা হত "চুনের মিউরেট" (লাতিন: murias calcis, calcaria muriatica[১২]).[১৩]
ব্যবহার[সম্পাদনা]
ডি-আইসিং এবং ফ্রিজিং পয়েন্ট ডিপ্রেশন[সম্পাদনা]

জলের ফ্রিজিং পয়েন্টকে অবনমিত করে, ক্যালসিয়াম ক্লোরাইড বরফ গঠন রোধ করতে ব্যবহৃত হয় এবং ডি-আইস ব্যবহার করা হয়। এই অ্যাপ্লিকেশনটি সর্বাধিক পরিমাণে ক্যালসিয়াম ক্লোরাইড গ্রহণ করে। ক্যালসিয়াম ক্লোরাইড গাছপালা এবং মাটির জন্য অপেক্ষাকৃত নিরীহ। ডিসিং এজেন্ট হিসাবে, এটি সোডিয়াম ক্লোরাইড এর চেয়ে কম তাপমাত্রায় অনেক বেশি কার্যকর। যখন এই ব্যবহারের জন্য বিতরণ করা হয়, তখন এটি সাধারণত কয়েক মিলিমিটার ব্যাসের ছোট, সাদা গোলকের আকার নেয়, যাকে প্রিলস বলা হয়। ক্যালসিয়াম ক্লোরাইডের দ্রবণগুলি −৫২ °সে (−৬২ °ফা) তাপমাত্রায় জমাট বাঁধা প্রতিরোধ করতে পারে, এটিকে তরল ব্যালাস্ট হিসাবে কৃষি উপকরণের টায়ারগুলি পূরণ করার জন্য আদর্শ করে তোলে, ঠান্ডা জলবায়ুতে ট্র্যাকশনে সহায়তা করে।[১৪]
এটি গার্হস্থ্য এবং শিল্প রাসায়নিক বায়ুতেও ডিহিউমিডিফায়ার হিসাবে ব্যবহৃত হয়।[১৫]
রাস্তা ঢালাই[সম্পাদনা]

ক্যালসিয়াম ক্লোরাইডের দ্বিতীয় বৃহত্তম প্রয়োগটি এর হাইগ্রোস্কোপিক প্রকৃতি এবং এর হাইড্রেটের অস্বস্তিকরতাকে কাজে লাগায়; ক্যালসিয়াম ক্লোরাইড অত্যন্ত হাইগ্রোস্কোপিক এবং এর হাইড্রেশন একটি এক্সোথার্মিক প্রক্রিয়া। একটি ঘনীভূত দ্রবণ ময়লা রাস্তা এর পৃষ্ঠে একটি তরল স্তর রাখে, যা ধুলোর গঠনকে দমন করে। এটি রাস্তার উপর সূক্ষ্ম ধূলিকণা রাখে, একটি কুশনিং স্তর প্রদান করে। যদি এগুলিকে উড়ে যেতে দেওয়া হয়, বড় সমষ্টিটি চারপাশে স্থানান্তরিত হতে শুরু করে এবং রাস্তাটি ভেঙে যায়। ক্যালসিয়াম ক্লোরাইড ব্যবহার করলে গ্রেডিং এর প্রয়োজনীয়তা ৫০% এবং ফিল-ইন উপকরণের প্রয়োজনীয়তা ৮০% কমে যায়।[১৬]
খাদ্য[সম্পাদনা]
খাদ্য সংযোজন হিসাবে ক্যালসিয়াম ক্লোরাইডের গড় গ্রহণ ১৬০-৩৪৫ মিলিগ্রাম/দিন অনুমান করা হয়েছে।[১৭] ক্যালসিয়াম ক্লোরাইড ইউরোপীয় ইউনিয়ন খাদ্য সংযোজক হিসাবে ই নম্বর ই৫০৯ এর অধিনে সিকোস্ট্যান্ট এবং ফার্মিং এজেন্ট হিসাবে ব্যবহারের জন্য অনুমোদিত। এটি মার্কিন খাদ্য ও ড্রাগ প্রশাসন দ্বারা সাধারণত নিরাপদ হিসাবে স্বীকৃত (GRAS) হিসাবে বিবেচিত হয়।[১৮] জৈব ফসল উৎপাদন-এ এর ব্যবহার সাধারণত মার্কিন জাতীয় জৈব কর্মসূচি-এর অধীনে নিষিদ্ধ।[১৯]
ফার্মিং এজেন্ট হিসাবে, ক্যালসিয়াম ক্লোরাইড টিনজাত শাকসবজিতে, সয়াবিন দইকে টোফু-এ পরিণত করতে এবং সবজি বা ফলের রস থেকে ক্যাভিয়ারের বিকল্প তৈরিতে ব্যবহৃত হয়।[২০] বোতলজাত জল সহ ক্রীড়া পানীয় এবং অন্যান্য পানীয়গুলিতে এটি সাধারণত ইলেক্ট্রোলাইট হিসাবে ব্যবহৃত হয়। ক্যালসিয়াম ক্লোরাইডের অত্যন্ত লবণাক্ত স্বাদ খাবারের সোডিয়াম বিষয়বস্তু না বাড়িয়েই আচার সুবাসিত করতে ব্যবহৃত হয়। ক্যালসিয়াম ক্লোরাইডের ফ্রিজিং-পয়েন্ট ডিপ্রেশন বৈশিষ্ট্যগুলি ক্যারামেল-ভরা চকোলেট বারগুলিতে ক্যারামেলের জমাট বাঁধার গতি কমাতে ব্যবহৃত হয়। এছাড়াও, টেক্সচার বজায় রাখার জন্য এটি প্রায়শই কাটা আপেলে যোগ করা হয়।
বিয়ার তৈরীতে, ক্যালসিয়াম ক্লোরাইড কখনও কখনও চোলাইয়ের জলে খনিজ ঘাটতি মেটাতে ব্যবহৃত হয়। এটি পানীয় প্রক্রিয়ার সময় স্বাদ এবং রাসায়নিক বিক্রিয়াকে প্রভাবিত করে এবং গাঁজন করার সময় খামিরের কার্যকারিতাকেও প্রভাবিত করতে পারে।
চিজমেকিং-এ, ক্যালসিয়াম ক্লোরাইড কখনও কখনও প্রক্রিয়াজাত (পাস্তুরাইজড/হোমোজেনাইজড) দুধে যোগ করা হয় যাতে কেসিন ক্যালসিয়াম এবং প্রোটিনের মধ্যে প্রাকৃতিক ভারসাম্য পুনরুদ্ধার করা হয়। এটি জমাট বাঁধার আগে যোগ করা হয়।
ক্যালসিয়াম ক্লোরাইড ক্রমবর্ধমান ঋতুর শেষের দিকে গাছে স্প্রে করে আপেলের উপর কর্ক স্পট এবং তিক্ত গর্ত প্রতিরোধ করতে ব্যবহৃত হয়।[২১]
পরীক্ষাগার এবং সংশ্লিষ্ট শুকানোর অপারেশন[সম্পাদনা]
শুকানোর টিউব প্রায়শই ক্যালসিয়াম ক্লোরাইড দিয়ে প্যাক করা হয়। সোডিয়াম কার্বনেট উৎপাদনে ব্যবহারের জন্য ক্যালসিয়াম ক্লোরাইড দিয়ে কেল্প শুকানো হয়। অ্যানহাইড্রাস ক্যালসিয়াম ক্লোরাইড শুষ্কতা (CPG 7117.02) নিশ্চিত করার জন্য একটি প্যাকেজিং সহায়তা হিসাবে FDA অনুমোদন করেছে।[২২]
হাইড্রেটেড লবণ পুনরায় ব্যবহারের জন্য শুকানো যেতে পারে তবে দ্রুত উত্তপ্ত হলে হাইড্রেশনের নিজস্ব জলে দ্রবীভূত হবে এবং ঠাণ্ডা হলে একটি শক্ত মিশ্রিত কঠিন পদার্থ তৈরি হবে।
অন্যান্য ব্যবহার[সম্পাদনা]
ক্যালসিয়াম ক্লোরাইড কংক্রিটের মিশ্রণে ত্বরণ প্রাথমিক সেটিং ব্যবহার করা হয়, কিন্তু ক্লোরাইড আয়ন ইস্পাত রিবার এর ক্ষয় ঘটায়, তাই এটি রিইনফোর্সড কংক্রিট এ ব্যবহার করা উচিত নয়।[২৩] ক্যালসিয়াম ক্লোরাইডের অ্যানহাইড্রাস ফর্মটিও এই উদ্দেশ্যে ব্যবহার করা যেতে পারে এবং কংক্রিটের আর্দ্রতার একটি পরিমাপ প্রদান করতে পারে।[২৪]
ক্যালসিয়াম ক্লোরাইড প্লাস্টিকের একটি সংযোজন হিসাবে এবং অগ্নি নির্বাপক, ব্লাস্ট ফার্নেস-এ স্ক্যাফোল্ডিং নিয়ন্ত্রণের জন্য একটি সংযোজন হিসাবে অন্তর্ভুক্ত করা হয় (চুল্লির চার্জকে নামতে বাধা দেয় এমন পদার্থের ক্লাম্পিং এবং আনুগত্য), এবং ফ্যাব্রিক সফটনার পাতলা হিসাবে।
ক্যালসিয়াম ক্লোরাইডের এক্সোথার্মিক দ্রবীভূতকরণ সেলফ-হিটিং ক্যান এবং হিটিং প্যাড এ ব্যবহৃত হয়। তেল শিল্পে, ক্যালসিয়াম ক্লোরাইড কঠিন পদার্থ-মুক্ত ব্রিন এর ঘনত্ব বাড়াতে ব্যবহৃত হয়। এটি ইনভার্ট ইমালসন ড্রিলিং তরলগুলির জলের পর্যায়ে ফোলা কাদামাটি প্রতিরোধের জন্যও ব্যবহৃত হয়।
CaCl2 গলিত NaCl এর ইলেক্ট্রোলাইসিস মাধ্যমে সোডিয়াম ধাতুর শিল্প উৎপাদনের জন্য ডেভি প্রক্রিয়ায় গলনাঙ্ক হ্রাস করে ফ্লাক্স উপাদান হিসাবে কাজ করে।
ক্যালসিয়াম ক্লোরাইড সক্রিয় কাঠকয়লা উৎপাদনেও ব্যবহৃত হয়।
ক্যালসিয়াম ক্লোরাইড অদ্রবণীয় CaF2 হিসাবে জল থেকে ফ্লোরাইড আয়ন বর্ষণ করতে ব্যবহার করা যেতে পারে।
ক্যালসিয়াম ক্লোরাইডও একটি উপাদান যা সিরামিক স্লিপ পরিধান এ ব্যবহৃত হয়। এটি কাদামাটির কণাকে স্থগিত করে যাতে তারা দ্রবণের মধ্যে ভাসতে পারে, এটি বিভিন্ন স্লিপ ঢালাই কৌশলে ব্যবহার করা সহজ করে তোলে।
ক্যালসিয়াম ক্লোরাইড ডাইহাইড্রেট (ওজন অনুসারে ২০ শতাংশ) ইথানল (৯৫ শতাংশ ABV) দ্রবীভূত করে পুরুষ পশুদের জন্য জীবাণুমুক্ত হিসেবে ব্যবহার করা হয়েছে। দ্রবণটি পশুর অণ্ডকোষে প্রবেশ করানো হয়। এক মাসের মধ্যে, টেস্টিকুলার টিস্যুর নেক্রোসিস নির্বীজনে পরিণত হয়।[২৫][২৬]
কলোম্বিয়ার কোকেন উৎপাদনকারীরা দ্রাবক পুনরুদ্ধার করতে টন ক্যালসিয়াম ক্লোরাইড আমদানি করে যেগুলি আইএনসিবি রেড লিস্ট এবং আরও শক্তভাবে নিয়ন্ত্রিত।[২৭]
ধাতু হ্রাস প্রবাহ[সম্পাদনা]
একইভাবে, CaCl2 একটি ফ্লাক্স এবং ইলেক্ট্রোলাইট হিসাবে এফএফসি কেমব্রিজ ইলেক্ট্রোলাইসিস প্রক্রিয়া টাইটানিয়াম উৎপাদনের জন্য ব্যবহৃত হয়, যেখানে এটি ক্যালসিয়াম এবং ইলেক্ট্রোডের মধ্যে অক্সিজেন আয়নের সঠিক বিনিময় নিশ্চিত করে। ।
চিকিৎসায় ব্যবহার[সম্পাদনা]
ক্যালসিয়াম ক্লোরাইড আধান হাইপোক্যালসেমিয়া প্রতিরোধ করার জন্য একটি শিরায় থেরাপি হিসাবে ব্যবহার করা যেতে পারে।
বিপত্তি[সম্পাদনা]
যদিও ভেজা অবস্থায় অল্প পরিমাণে অ-বিষাক্ত, তবে নন-হাইড্রেটেড লবণের দৃঢ়ভাবে হাইগ্রোস্কোপিক বৈশিষ্ট্যগুলি কিছু বিপদ ডেকে আনে। ক্যালসিয়াম ক্লোরাইড আর্দ্র ত্বকের দ্বারা রিরিট্যান্ট হিসেবে কাজ করতে পারে। কঠিন ক্যালসিয়াম ক্লোরাইড দ্রবীভূত হয় এক্সোথার্মিক প্রক্রিয়া ঘনীভূত দ্রবণ বা কঠিন দ্রব্য গ্রহণ করলে গ্যাস্ট্রোইনটেস্টাইনাল জ্বালা বা আলসারেশন হতে পারে।[২৮]
ক্যালসিয়াম ক্লোরাইড সেবন করলে হাইপারক্যালসেমিয়া হতে পারে।[২৯]
বৈশিষ্ট্য[সম্পাদনা]

ক্যালসিয়াম ক্লোরাইড পানিতে দ্রবীভূত হয়ে ক্লোরাইড এবং ধাতু অ্যাকো কমপ্লেক্স [Ca(H2O)6]2+ তৈরি করে. এইভাবে, এই সমাধানগুলি "মুক্ত" ক্যালসিয়াম এবং বিনামূল্যে ক্লোরাইড আয়নগুলির উৎস। এই বর্ণনাটি এই সত্য দ্বারা চিত্রিত করা হয়েছে যে এই দ্রবণগুলি ফসফেট উৎসগুলির সাথে প্রতিক্রিয়া করে ক্যালসিয়াম ফসফেট এর একটি কঠিন অবক্ষেপ প্রদান করে:
- 3 CaCl2 + 2 PO3−4 → Ca3(PO4)2 + 6 Cl−
ক্যালসিয়াম ক্লোরাইডের একটি খুব বেশি এনথালপি পরিবর্তনের দ্রবণ, যা জলে অ্যানহাইড্রাস লবণের দ্রবীভূত হওয়ার সাথে উল্লেখযোগ্য তাপমাত্রা বৃদ্ধি দ্বারা নির্দেশিত হয়। এই সম্পত্তি তার বৃহত্তম স্কেল আবেদনের ভিত্তি।
গলিত ক্যালসিয়াম ক্লোরাইড ইলেকট্রোলাইসড হয়ে ক্যালসিয়াম ধাতু এবং ক্লোরিন গ্যাস দিতে পারে:
- CaCl2 → Ca + Cl2
প্রস্তুতি[সম্পাদনা]
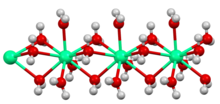
বিশ্বের বেশিরভাগ অংশে, ক্যালসিয়াম ক্লোরাইড চুনাপাথর থেকে সলভে প্রক্রিয়া-এর উপজাত হিসাবে প্রাপ্ত হয়, যা নীচের নেট প্রতিক্রিয়া অনুসরণ করে:[১০]
- 2 NaCl + CaCO3 → Na2CO3 + CaCl2
২০০২ সালে উত্তর আমেরিকার ব্যবহার ছিল ১,৫২৯,০০০ টন (৩.৩৭ বিলিয়ন পাউন্ড)।[৩০] মার্কিন যুক্তরাষ্ট্রে, বেশিরভাগ ক্যালসিয়াম ক্লোরাইড ব্রিন থেকে পরিশোধনের মাধ্যমে পাওয়া যায়। বেশিরভাগ বাল্ক পণ্য লবণ পণ্যের মতো, ক্ষারীয় ধাতু এবং ক্ষারীয় আর্থ মেটাল থেকে স্বল্প পরিমাণে অন্যান্য ক্যাটায়ন গোষ্ঠী ১ এবং ২) এবং অন্যান্য অ্যানিয়ন হ্যালোজেন (গ্রুপ ১৭) সাধারণত ঘটে।[১০]
প্রাপ্তি[সম্পাদনা]
ক্যালসিয়াম ক্লোরাইড বিরল ইভাপোরাইট খনিজ সিনজারাইট (ডাইহাইড্রেট) এবং অ্যান্টার্কটিকাইট (হেক্সাহাইড্রেট) হিসাবে ঘটে। [৩১][৩২][৩৩] আরেকটি প্রাকৃতিক হাইড্রেট পরিচিত ঘিয়ারাইতে – একটি টেট্রাহাইড্রেট।[৩৪][৩৩] সম্পর্কিত খনিজ পদার্থ ক্লোরোক্যালসাইট (পটাসিয়াম ক্যালসিয়াম ক্লোরাইড, KCaCl3) এবং ট্যাকিহাইড্রাইট (ক্যালসিয়াম ম্যাগনেসিয়াম ক্লোরাইড, CaMg2Cl6·12H2O) খুব বিরল।[৩৫][৩৬][৩৩] একই ভাবে রোরিসাইট, CaClF (ক্যালসিয়াম ক্লোরাইড ফ্লোরাইড).[৩৭][৩৩]
আরও দেখুন[সম্পাদনা]
তথ্যসূত্র[সম্পাদনা]
- ↑ ক খ গ ঘ ঙ চ ছ জ ঝ Lide, David R. (২০০৯)। Handbook of Chemistry and Physics (90 সংস্করণ)। Boca Raton, Florida: CRC Press। আইএসবিএন 978-1-4200-9084-0। অজানা প্যারামিটার
|1=উপেক্ষা করা হয়েছে (সাহায্য) - ↑ "ক্যালসিয়াম ক্লোরাইড (অ্যানহাইড্রাস)"। ICSC। International Programme on Chemical Safety and the European Commission।
- ↑ Seidell, Atherton; Linke, William F. (১৯১৯)। Solubilities of Inorganic and Organic Compounds (2nd সংস্করণ)। New York: D. Van Nostrand Company। পৃষ্ঠা 196।
- ↑ ক খ গ ঘ ঙ চ Anatolievich, Kiper Ruslan। "Properties of substance: calcium chloride"। chemister.ru। সংগ্রহের তারিখ ২০১৪-০৭-০৭।
- ↑ ক খ গ ঘ ঙ চ Pradyot, Patnaik (২০১৯)। Handbook of Inorganic Chemicals। The McGraw-Hill Companies, Inc.। পৃষ্ঠা ১৬২। আইএসবিএন 978-0-07-049439-8।
- ↑ ক খ গ ঘ Müller, Ulrich (২০০৬)। Inorganic Structural Chemistry (2nd সংস্করণ)। England: John Wiley & Sons Ltd.। পৃষ্ঠা ৩৩। আইএসবিএন 978-0-470-01864-4।
- ↑ ক খ গ Sigma-Aldrich Co.
- ↑ Donald E. Garrett (২০০৪)। Handbook of Lithium and Natural Calcium Chloride। Elsevier। পৃষ্ঠা ৩৭৯। আইএসবিএন 978-0080472904। সংগ্রহের তারিখ ২০১৮-০৮-২৯।
Its toxicity upon ingestion, is indicated by the test on rats: oral LD50 (rat) is 1.0–1.৪ g/kg (the lethal dose for half of the test animals, in this case rats...)
- ↑ "MSDS of Calcium chloride"। fishersci.ca। Fisher Scientific। সংগ্রহের তারিখ ২০১৪-০৭-০৭।
- ↑ ক খ গ Robert Kemp, Suzanne E. Keegan "Calcium Chloride" in Ullmann's Encyclopedia of Industrial Chemistry ২০০০, Wiley-VCH, Weinheim. ডিওআই:10.1002/14356007.a04_547
- ↑ Peck, Eugene L.; Hamilton, J. Hugh; Lewis, John Roberts; Hogan, Mervin B.; Kusian, Ross Northey; Cope, William J. (১৯৫৪)। Proceedings of the First Annual Heating and Air Conditioning Conference: 1953-1955 (ইংরেজি ভাষায়)। University of Utah, Department of Metallurgy।
- ↑ ক খ Hartmann, Philipp Karl (১৮১৬)। Pharmacologia Dynamica: Usui Academico Adcommodata (লাতিন ভাষায়)। Kupffer et Wimmer।
- ↑ Ottley, William Campbell (১৮২৬)। A dictionary of chemistry and of mineralogy as connected with it (ইংরেজি ভাষায়)। Murray।
- ↑ "Binary Phase diagram: The Calcium Chloride – water system"। Aqueous Solutions Aps। অক্টোবর ২০১৬। ২৬ জুন ২০১৯ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২০১৭-০৪-২০।
- ↑ "Keeping Things Dry"। humantouchofchemistry.com। ২৬ অক্টোবর ২০১৪ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২০১৪-১০-২৩।
- ↑ "Dust: Don't Eat It! Control It!"। Road Management & Engineering Journal। US Roads (TranSafety Inc.)। ১ জুন ১৯৯৮। ২৯ অক্টোবর ২০০৭ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ৯ অগাস্ট ২০০৬।
- ↑ Calcium Chloride SIDS Initial Assessment Profile, UNEP Publications, SIAM ১৫, Boston, ২২–২৫ অক্টোবর ২০০২, pp. 13–14.
- ↑ ২১ CFR § 184.1193
- ↑ ৭ CFR § 205.602
- ↑ "Apple Caviar Technique"। StarChefs Studio। StarChefs.com। এপ্রিল ২০০৪। সংগ্রহের তারিখ ৯ অগাস্ট ২০০৬।
- ↑ "Cork Spot and Bitter Pit of Apples", Richard C. Funt and Michael A. Ellis, Ohioline.osu.edu/factsheet/plpath-fru-01
- ↑ "CPG 7117.02"। FDA Compliance Articles। US Food and Drug Administration। মার্চ ১৯৯৫। সংগ্রহের তারিখ ৩ ডিসেম্বর ২০০৭।
- ↑ "Accelerating Concrete Set Time"। Federal Highway Administration। ১ জুন ১৯৯৯। ১৭ জানুয়ারি ২০০৭ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ১৬ জানুয়ারি ২০০৭।
- ↑ National Research Council (U.S.). Building Research Institute (১৯৬২)। Adhesives in Building: Selection and Field Application; Pressure-sensitive Tapes। National Academy of Science-National Research Council। পৃষ্ঠা 24–5।
- ↑ Koger, নভেম্বর ১৯৭৭, "Calcium Chloride, Practical Necrotizing Agent", Journal of the American Association of Bovine Practitioners (USA), ( নভেম্বর ১৯৭৭), v. ১২, p. ১১৮–১১৯
- ↑ Jana, K.; Samanta, P.K. (২০১১)। "Clinical evaluation of non-surgical sterilization of male cats with single intra-testicular injection of calcium chloride"। BMC Vet. Res.। 7: 39। ডিওআই:10.1186/1746-6148-7-39
 । পিএমআইডি 21774835। পিএমসি ৩১৫২৮৯৩
। পিএমআইডি 21774835। পিএমসি ৩১৫২৮৯৩ 
|pmc=এর মান পরীক্ষা করুন (সাহায্য)। - ↑ Smith, Michael; Simpson, Cam (২৬ অক্টোবর ২০২০)। "Narcos Are Waging a New Drug War Over a Texas Company's Basic Chemical"। Bloomberg। Archived from the original on ২৬ অক্টোবর ২০২০। সংগ্রহের তারিখ ২৬ অক্টোবর ২০২০।
- ↑ "Product Safety Assessment (PSA): Calcium Chloride"। Dow Chemical Company। ২ মে ২০০৬। ১৭ সেপ্টেম্বর ২০০৯ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২২ জুলাই ২০০৮।
- ↑ "Calcium Chloride Possible Side Affects"। www.drugs.com।
- ↑ Calcium Chloride SIDS Initial Assessment Profile, UNEP Publications, SIAM ১৫, Boston, 22–২৫ অক্টোবর ২০০২, page 11.
- ↑ "Sinjarite"। www.mindat.org।
- ↑ "Antarcticite"। www.mindat.org।
- ↑ ক খ গ ঘ "List of Minerals"। www.ima-mineralogy.org। ২১ মার্চ ২০১১।
- ↑ "Ghiaraite"। www.mindat.org।
- ↑ "Chlorocalcite"। www.mindat.org।
- ↑ "Tachyhydrite"। www.mindat.org।
- ↑ "Rorisite"। www.mindat.org।
- Greenwood, N. N.; Earnshaw, A. (১৯৯৭)। Chemistry of the Elements (2nd সংস্করণ)। Butterworth-Heinemann। আইএসবিএন 0080379419।
বহিঃ সংযোগ[সম্পাদনা]
- International Chemical Safety Card 1184[স্থায়ীভাবে অকার্যকর সংযোগ]
- Product and Application Information (Formerly Dow Chemical Calcium Chloride division)
- Report on steel corrosion by chloride including CaCl2 ওয়েব্যাক মেশিনে আর্কাইভকৃত ১৬ জুন ২০১১ তারিখে
- Collection of calcium chloride reports and articles
- ক্যালসিয়াম ক্লোরাইড, অ্যানহাইড্রাস MSDS
- ক্যালসিয়াম ক্লোরাইডের বিচ্ছিন্নতা
- Centers for Disease Control and Prevention, National Institutes of Occupational Safety and Health, "ক্যালসিয়াম ক্লোরাইড (অ্যানহাইড্রাস)"
টেমপ্লেট:ক্লোরাইডস টেমপ্লেট:খনিজ পরিপূরক টেমপ্লেট:ইউরোলজিক্যাল, অ্যান্টিস্পাসমোডিক্স সহ টেমপ্লেট:লবণ প্রসঙ্গ

