যোজ্যতা ইলেকট্রন

রসায়নে যোজনী ইলেকট্রন হল পরমাণুর সাথে সম্পর্কিত ইলেকট্রন যা রাসায়নিক বন্ধন গঠনে অংশগ্রহণ করে। একক সমযোজী বন্ধনে, বন্ধনে আবদ্ধ উভয় পরমাণুর একটি করে যোজনী ইলেকট্রন ভাগাভাগি করার মাধ্যমে সর্বমোট একজোড়া ইলেকট্রন ভাগাভাগি করে বন্ধন গঠন করে। বস্তুর রাসায়নিক ধর্ম এবং এটি অন্য কিছুর সাথে বন্ধন গঠন করে কিনা — তা যাচাইয়ের মাধ্যমে যোজনী ইলেকট্রন নির্ণয় করা যায়। মূল গ্রুপভুক্ত মৌলের ক্ষেত্রে সর্ববহিঃস্থ স্তরে বিদ্যমান ইলেকট্রন সংখ্যাই ঐ মৌলের যোজনী ইলেকট্রন বা যোজক ইলেকট্রন। ট্রানজিশন মৌলের ক্ষেত্রে যোজনী ইলেকট্রন নির্ণয়ে অভ্যন্তরীণ কক্ষের ক্ষেত্রেও আলোকপাত করতে হয়।
বদ্ধ শেলবিশিষ্ট একটি পরমাণুর যোজনী ইলেকট্রন (s2p6 ইলেকট্রন বিন্যাস অনুযায়ী) হয় নোবেল গ্যাসের ন্যায়। বদ্ধ শেলের জন্য এক বা দুই ততোধিক যোজনী ইলেকট্রন প্রয়োজন, কারণঃ
- এর নিম্ন শক্তি প্রয়োজন (ল্যাটিস এনথ্যালপির তুলনায়), অতিরিক্ত যোজনী ইলেকট্রন সরিয়ে ধনাত্মক আয়ন গঠন করার জন্য
- হারানো যোজনী ইলেকট্রন অর্জনের জন্য (এবং তদুপরি ঋণাত্মক আয়ন গঠনের জন্য) বা যোজনী ইলেকট্রন ভাগাভাগি করার জন্য (এবং তদুপরি সমযোজী বন্ধন গঠনের জন্য)
অভ্যন্তরীণ কক্ষের ইলেকট্রনের ন্যায় যোজনী ইলেকট্রনেরও ফোটন হিসেবে শক্তি শোষণ বা নির্গমন করতে পারে। শক্তি শোষণ একটি ইলেকট্রনকে পরবর্তী কক্ষে লাফিয়ে যেতে দেয়; একে পারমাণবিক উত্তেজনা বলা হয়। অথবা ইলেকট্রন সহযোগী পরমাণুর যোজনী শেল থেকে বের হয়েও আসতে পারে। ফলে ধনাত্মক আয়ন গঠিত হয়। যখন কোনো ইলেকট্রন শক্তি হারায় (ফলে একটি ফোটন নির্গত হয়), তখন এটি অভ্যন্তরীণ কক্ষে গমন করে।
যোজনী শক্তিস্তর [প্রধান কোয়ান্টাম সংখ্যানুযায়ী গঠিত হয় (n = ১, ২, ৩, ৪, ৫ ...) বা বর্ণানুক্রমিকভাবে [রঞ্জন রশ্মি লিপি] অনুযায়ী (K, L, M, …) হিসেবে প্রকাশ করা হয়।
যোজনী ইলেকট্রন সংখ্যা[সম্পাদনা]
কোনো মৌলে যোজনী ইলেকট্রনের সংখ্যা পর্যায় সারণীর খাড়া কলামের মাধ্যমে নির্ধারিত হয়। ব্যতিক্রম হিসেবে গ্রুপ ৩–১২ (ট্রানজিশন ধাতু) রয়েছে। গ্রুপ নম্বর একক সংখ্যাই ঐ গ্রুপভুক্ত মৌলের যোজনী ইলেকট্রন নির্ধারণ করে।
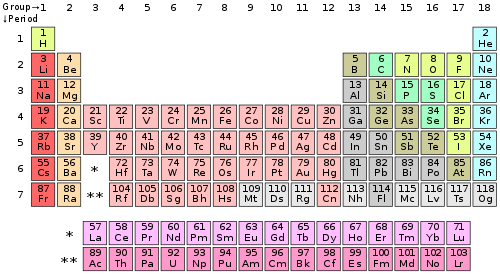
| পর্যায় সারণীর শ্রেণি | যোজনী ইলেকট্রন সংখ্যা |
|---|---|
| শ্রেণি ১ (I) (ক্ষার ধাতু) | ১ |
| শ্রেণি ২ (II) (ক্ষারীয় মৃত্তিকা মৌল) | ২ |
| শ্রেণি ৩-১২ (অবস্থান্তর ধাতু) | ৩–১২* |
| শ্রেণি ১৩ (III) (বোরন গ্রুপ) | ৩ |
| শ্রেণি ১৪ (IV) (কার্বন গ্রুপ) | ৪ |
| শ্রেণি ১৫ (V) (নিক্টোজেন বা নাইট্রোজেন গ্রুপ) | ৫ |
| শ্রেণি ১৬ (VI) (চ্যালকোজেন বা অক্সিজেন গ্রুপ) | ৬ |
| শ্রেণি ১৭ (VII) (হ্যালোজেন) | ৭ |
| শ্রেণি (VIII বা ০) (নিষ্ক্রিয় গ্যাস) | ৮** |
* ns এবং (n-1)d ইলেকট্রন নিয়ে গঠিত। এছাড়া d ইলেকট্রন গণনাও ব্যবহৃত হয়।
** হিলিয়াম ছাড়া, যার মাত্র দুটি যোজনী ইলেকট্রন রয়েছে
ইলেকট্রন বিন্যাস[সম্পাদনা]
যে ইলেকট্রনসমূহ নির্ধারণ করে যে কীভাবে একটি পরমাণু রাসায়নিকভাবে বিক্রিয়া করে, তাদের গড় দূরত্ব নিউক্লিয়াস থেকে বৃহত্তম; এবং তাদের শক্তিও সবচেয়ে বেশি।
মূল গ্রুপ মৌলের ক্ষেত্রে যোজনী ইলেকট্রন হল সেইসব ইলেকট্রন যারা উচ্চতম প্রধান কোয়ান্টাম সংখ্যা n এর ইলেকট্রনিক শেলে অবস্থান করে।[১] এভাবে যোজনী ইলেকট্রন সংখ্যা, সহজভাবে ইলেকট্রন বিন্যাসের উপর নির্ভর করে। উদাহরণস্বরূপ ফসফরাসের (P) ইলেকট্রন বিন্যাস হল 1s2 2s2 2p6 3s2 3p3, অর্থাৎ এর ৫টি যোজনী ইলেকট্রন (3s2 3p3) রয়েছে। ফলে ফসফরাসের সর্বোচ্চ যোজনী ৫, যা PF5 যৌগে দেখা যায়। এই বিন্যাস সাধারণত [Ne] 3s2 3p3 হিসেবে দেখানো হয়, যেখানে [Ne] অভ্যন্তরীণ ইলেকট্রনকে দেখায় যাদের বিন্যাস নোবেল গ্যাস নিয়নের মত। উত্তেজিত ইলেক্ট্রন বিন্যাস The rules of Excited Electron Configuration:::
১.উত্তেজিত ইলেকট্রন বিন্যাস করার আগে Normal Electron বিন্যাস করতে হবে ২.মৌলের প্রতীকের মাথায় * দিতে হবে ৩.উত্তেজিত ইলেকট্রন বিন্যাস করার সময় শুধু মাত্র যোজ্যতা স্তর নিয়ে কাজ করতে হবে ৪.যোজ্যতা স্তরের s Orbital বিভাজিত হতে পারে না। শুধু মাত্র d ও p অরবিটাল বিভাজিত হয় ৫.p অরবিটাল তিন ভাগে বিভাজিত হয়।
তবে অবস্থান্তর ধাতুর আংশিকভাবে পূর্ণ (n − 1)d শক্তি স্তর আছে, যাদের শক্তি ns স্তরের খুব কাছাকাছি।[২] ফলে মূল গ্রুপভুক্ত মৌলের সাথে বৈসাদৃশ্য হিসেবে অবস্থান্তর ধাতুর যোজনী ইলেকট্রন হল সেই ইলেকট্রন যা নোবেল গ্যাসের বাইরে থাকে।[৩] এভাবে অবস্থান্তর ধাতুর d ইলেকট্রন যোজনী ইলেকট্রন হিসেবে আচরণ করে, যদিও তারা যোজনী শেলে অবস্থান করে না। উদাহরণস্বরূপ ম্যাঙ্গানিজ (Mn) এর ইলেকট্রন বিন্যাস হল 1s2 2s2 2p6 3s2 3p6 4s2 3d5; একে সংক্ষেপে [Ar] 4s2 3d5 হিসেবে লেখা হয়। এক্ষেত্রে [Ar] অভ্যন্তরীণ ইলেকট্রনকে দেখায় যাদের বিন্যাস নোবেল গ্যাস আর্গনের মত। এ পরমাণুতে একটি 3d ইলেকট্রন আর একটি 4s ইলেকট্রনের শক্তি প্রায় একইরকম থাকে, এবং তা 3s না 3p ইলেকট্রনের চেয়ে বেশি। বস্তুত এরূপ সাতটি যোজনী ইলেকট্রন রয়েছে (4s2 3d5) আর্গনের ন্যায় অভ্যন্তরের বাইরে, এবং এটা স্থিতিশীল। ম্যাঙ্গানিজের জারণ অবস্থা +৭ হতে পারে (পারম্যাঙ্গানেট আয়নঃ MnO−
4)।
অবস্থান্তর ধাতু ধারায় যতই ডানদিকে যাওয়া যায়, ততই d সাবশেলের ইলেকট্রনের শক্তি কমে যায় এবং এ ধরনের ইলেকট্রনের যোজনী ইলেকট্রনের বৈশিষ্ট্য কমে যায়। এর ফলে, নিকেল পরমাণুর দশটি যোজনী ইলেকট্রন (4s2 3d8) রয়েছে, কিন্তু এর জারণ অবস্থা কখনই চার অতিক্রম করে না। জিঙ্কের জন্য 3d সাবশেল সম্পূর্ণ থাকে এবং অভ্যন্তরীণ ইলেকট্রনের মতই আচরণ করে।
যেহেতু রাসায়নিক বিক্রিয়ায় অংশগ্রহণকারী যোজনী ইলেকট্রনের সংখ্যা নির্ধারণ করা মুশকিল, তবুও যোজনী ইলেকট্রনের ধারণা অবস্থান্তর ধাতুর ক্ষেত্রে মূল গ্রুপভুক্ত মৌলের তুলনায় কম গুরুত্বপূর্ণ। d ইলেকট্রন সংখ্যা রসায়নে অবস্থান্তর ধাতুর ক্ষেত্রে গুরুত্বপূর্ণ নির্ধারণ প্রক্রিয়া।
রাসায়নিক বিক্রিয়া[সম্পাদনা]
পরমাণুর সর্ববহিঃস্থ স্তরে বিদ্যমান যোজনী শেল বন্ধন আচরণ ব্যাখ্যা করে। এ কারণে যে সকল পরমাণুর একই সংখ্যক যোজনী ইলেকট্রন রয়েছে তাদেরকে মৌলের পর্যায় সারণীতে একই গ্রুপে স্থান দেওয়া হয়। সাধারণ নিয়মানুযায়ী মূল গ্রুপভুক্ত মৌল (হাইড্রোজেন বা হিলিয়াম ছাড়া) বিক্রিয়ার মাধ্যমে বদ্ধ শেল গঠন করতে চায়, কারণ তখন তাদের ইলেকট্রন বিন্যাস s2p6 হয়। এ নিয়মকে অষ্টক নিয়ম বলা হয়, কারণ বন্ধনযুক্ত প্রতিটি পরমাণু ভাগাভাগির মাধ্যমে আটটি যোজনী ইলেকট্রন ধারণ করে।
সবচেয়ে বেশি তীব্র বিক্রিয়ক ধরনের ধাতব মৌল অবস্থান করে গ্রুপ ১-এ (উদাঃ সোডিয়াম বা পটাশিয়াম); এর কারণ এ প্রতিটি পরমাণুরই একটি মাত্র যোজনী ইলেকট্রন রয়েছে। আয়নিক বন্ধন গঠনের সময় এ নিম্নসংখ্যক ইলেকট্রনই প্রয়োজনীয় আয়নিকরণ শক্তি দান করে। এ একটি ইলেকট্রন সহজেই নির্গত হওয়ার মাধ্যমে ধনাত্মক আয়ন তথা ক্যাটায়ন গঠন করে, এবং বদ্ধ শেল লাভ করে। (উদাহরণস্বরূপ Na+ বা K+)। গ্রুপ ২-এর কোনো অ্যালকালাইন ভূ-ধাতু (উদাহরণস্বরূপ ম্যাগনেসিয়াম) তুলনামূলকভাবে কম সক্রিয়, কারণ প্রতিটি পরমাণুর দুটি করে যোজনী ইলেকট্রন থাকে এবং এ দুটিই ত্যাগ করে ক্যাটায়ন গঠনের মাধ্যমে বদ্ধ শেল লাভ করে (উদাহরণস্বরূপ Mg2+)।
মৌলের প্রতিটি গ্রুপেই (পর্যায় সারণীর) সক্রিয়তা বৃদ্ধি পায় সারণীর নিম্নতম সারিতে যেতে যেতে (হালকা মৌল থেকে ভারি মৌলের দিকে)। কারণ ভারি মৌলের হালকা মৌলের চেয়ে বেশি ইলেকট্রন শেল আছে, ভারি মৌলের যোজনী ইলেকট্রন উচ্চতম প্রধান কোয়ান্টাম নম্বরে অবস্থান করে। তারা পরমাণুর নিউক্লিয়াস থেকে যত দূরে যায়, তত উচ্চ স্থিতিশক্তিতে অবস্থান করে — অর্থাৎ তারা কম শক্তভাবে যুক্ত থাকে।
একটি অধাতব পরমাণু পূর্ণ যোজনী শেল গঠনের জন্য অতিরিক্ত যোজনী ইলেকট্রনকে আকর্ষণ করে। এটা দুইভাবে অর্জিত হতে পারেঃ পরমাণুটি পাশ্ববর্তী পরমাণুর সাথে ইলেকট্রন শেয়ার করতে পারে (সমযোজী বন্ধন গঠনের মাধ্যমে), কিংবা ইলেকট্রন গ্রহণ করার মাধ্যমে (আয়নিক বন্ধন গঠনের মাধ্যমে)। সবচেয়ে সক্রিয় অধাতব মৌল হচ্ছে হ্যালোজেনেরা (যেমন ফ্লোরিন (F) ক্লোরিন (Cl))। এ ধরনের পরমাণুর ইলেকট্রন বিন্যাস হলঃ s2p5; এদের মাত্র একটি যোজনী ইলেকট্রন প্রয়োজন বদ্ধ শেল গঠনের মাধ্যমে। সমযোজী বন্ধন গঠনের জন্য হ্যালোজেন পরমাণুর একটি ইলেকট্রন ও অপর একটি পরমাণুর একটি ইলেকট্রন মিলে মোট একজোড়া ইলেকট্রন শেয়ার করে (উদাহরণস্বরূপ H–F অণুতে এ লাইনটি একজোড়া যোজনী ইলেকট্রনকে নির্দেশ করে যার একটি H ও অপরটি F থেকে আসে)।
প্রতিটি অধাতব গ্রুপে হালকা মৌল থেকে ভারি মৌলের দিকে, অর্থাৎ সারণীর নিচের সারিগুলোতে সক্রিয়তা হ্রাস পায়। কারণ যোজনী ইলেকট্রন উচ্চশক্তির স্তরে থাকে এবং তুলনামূলক কম শক্তিশালীভাবে যুক্ত থাকে। প্রকৃতপক্ষে অক্সিজেন (গ্রুপ ১৬'র সবচেয়ে হালকা মৌল) ফ্লোরিনের পরেই সবচেয়ে বেশি সক্রিয় অধাতু, যদিও এটি হ্যালোজেন না। এর কারণ হল হ্যালোজেনের যোজনী শেল উচ্চতর প্রধান কোয়ান্টাম নাম্বারে অবস্থান করে।
এই ধরনের ক্ষেত্রে, যেখানে অষ্টক নিয়ম মেনে চলা হয়, পরমাণুর যোজনী গৃহীত, হারানো বা শেয়ার করা ইলেকট্রনসংখ্যার সমান; যেন স্থিতিশীল অষ্টক গঠন করা যায়। তবে এছাড়া আরো অণু আছে যারা ব্যতিক্রম, এবং তাদের যোজনী তুলনামূলক অপরিষ্কারভাবে ব্যাখ্যা করা হয়।
তড়িৎ পরিবাহিতা[সম্পাদনা]
যোজনী ইলেকট্রন মৌলের তড়িৎ পরিবাহিতার জন্যেও দায়ী। এর মাধ্যমেই কোনো একটি মৌল ধাতু, অধাতু, অর্ধপরিবাহী (বা ধাতুকল্প) হিসেবে শ্রেণিভুক্ত হয়।
ধাতু হল উচ্চ তড়িৎ পরিবাহিতা বা নমনীয়তাবিশিষ্ট মৌল যখন তারা কঠিন অবস্থায় থাকে। পর্যায় সারণির প্রত্যেক সারিতে অধাতুর বামদিকে ধাতুর অবস্থান, ফলে ধাতুর সম্ভাব্য যোজনী ইলেকট্রন সংখ্যা অধাতুর চেয়ে কম। একটি ধাতব পরমাণুর যোজনী ইলেকট্রন কম আয়নীকরণ শক্তিবিশিষ্ট এবং কঠিনাবস্থায় এ যোজনী ইলেকট্রন বিচ্যুত হতে অধাতুর চেয়ে কম শক্তিবিশিষ্ট হয়। এ "মুক্ত ইলেকট্রন" তড়িৎ ক্ষেত্রের প্রভাবে চলতে পারে এবং এর এরূপ চলাচলের ফলেই বিদ্যুৎ সৃষ্টি করে। এ ঘটনাই ধাতুর পরিবাহিতার জন্য দায়ী। তামা, অ্যালুমিনিয়াম, রূপা এবং স্বর্ণ হল তড়িৎ সুপরিবাহীর উদাহরণ।
একটি অধাতব মৌলের তড়িৎ পরিবাহকত্ব কম থাকে, এরা অন্তরক হিসেবে কাজ করে। এরূপ মৌলদের খুঁজে পাওয়া যাবে পর্যায় সারণীর ডানে, শীর্ষদিকে, এবং এর যোজনী শেল সাধারণত (বোরন ব্যতিক্রম) অর্ধপূর্ণ থাকে। এর আয়নীকরণ শক্তিও বৃহত্তর হয়; ফলে তড়িৎ ক্ষেত্রের প্রভাবে এধরনের পরমাণু থেকে সহজে ইলেকট্রনের নির্গমন ঘটে না এবং এরা খুবই সামাণ্য তড়িৎ প্রবাহ সৃষ্টি করে থাকে। এরূপ কঠিন অন্তরকের উদাহরণ হিসেবে বলা যায় হীরক (একটি কার্বনের একটি রূপভেদ এবং সালফার।
ধাতব মৌলবিশিষ্ট কঠিন যৌগও অন্তরক হতে পারে, যদি ধাতব পরমাণুর যোজনী ইলেকট্রন আয়নিক যৌগ গঠনে ব্যবহৃত হয়। উদাহরণস্বরূপ, যদিও সোডিয়াম একটি ধাতু, কঠিন সোডিয়াম ক্লোরাইড অন্তরক; কারণ সোডিয়ামের যোজনী ইলেকট্রন ক্লোরিনে গিয়ে আয়নিক বন্ধন গঠন করে, যা থেকে ইলেকট্রন সহজে নির্গত হতে পারে না।
অর্ধপরিবাহীর তড়িৎ পরিবাহকত্ব ধাতু ও অধাতুর তুলনায় মধ্যম ধরনের। ধাতুর তুলনায় অপর একটি বৈসাদৃশ্যপূর্ণ বৈশিষ্ট্য হল এই যে এদের তড়িৎ পরিবাহকত্ব তাপমাত্রার সাথে বৃদ্ধি পায়। সাধারণ অর্ধপরিবাহীর উদাহরণ হল সিলিকন ও জার্মেনিয়াম, প্রতিটির পরমাণুরই চারটি যোজনী ইলেকট্রন থাকে। ব্যান্ড তত্ত্বের মাধ্যমে সবচেয়ে ভালোভাবে অর্ধপরিবাহীর ধর্ম ব্যাখ্যা করা যায়। এ তত্ত্বমতে একটি যোজনী ব্যান্ড (যা পরম শূন্যে যোজনী ইলেকট্রন ধারণ করে) ও পরিবহণ ব্যান্ডের (তাপীয় শক্তিতে উত্তেজিত হয়ে যে স্তরে যোজনী ইলেকট্রন গমন করে) শক্তির পার্থক্যের ফলাফল হিসেবে সৃষ্টি হয়।
তথ্যসূত্র[সম্পাদনা]
- ↑ Petrucci R.H., Harwood W.S. and Herring F.G., General Chemistry (8th edn, Prentice-Hall 2002), p.339.
- ↑ "THE ORDER OF FILLING 3d AND 4s ORBITALS"।
- ↑ Miessler G.L. and Tarr, D.A., Inorganic Chemistry (2nd edn. Prentice-Hall 1999). p.48.
বহিঃসংযোগ[সম্পাদনা]
- Francis, Eden. যোজনী ইলেকট্রন.
