পেপটাইড

পেপটাইড হলো অ্যামিনো এসিডের ছোট শিকল যা পেপটাইড বন্ধন দ্বারা পরস্পরের সাথে যুক্ত থাকে।[১][২] একটি পলিপেপটাইড হলো একটি লম্বা, অবিচ্ছিন্ন, অশাখা পেপটাইড শিকল।[৩] যে পলিপেপটাইডগুলোর আণবিক ভর ১০,০০০ ডাল্টন বা তার বেশি হয় সেগুলোকে প্রোটিন বলা হয়।[৪] বিশটির কম অ্যামিনো এসিডের শিকলগুলোকে অলিগোপেপটাইড বলা হয়। এগুলোর মধ্যে রয়েছে ডাইপেপটাইড, ট্রাইপেপটাইড এবং টেট্রাপেপটাইড।
পেপটাইডগুলো জৈব পলিমার এবং অলিগোমারের বিস্তৃত রাসায়নিক শ্রেণীর অন্তর্ভুক্ত। এর পাশাপাশি নিউক্লিক এসিড, অলিগোস্যাকারাইড, পলিস্যাকারাইড ইত্যাদিও এই শ্রেণীতে পড়ে।
প্রোটিন জৈবিক ও কার্যকরীভাবে সাজানো এক বা একাধিক পলিপেপটাইড দ্বারা গঠিত হয়, যা প্রায়শই কোএনজাইম এবং কোফ্যাক্টরের মতো লিগ্যান্ড, অন্যান্য প্রোটিন, ডিএনএ বা আরএনএর মতো অন্যান্য বৃহদাণু অথবা জটিল ম্যাক্রোমলিকিউলার সমাহারের সাথে আবদ্ধ থাকে।[৫]
পেপটাইড গঠনের সময় অ্যামিনো এসিডগুলোকে অবশিষ্টাংশ (residues) বলা হয়। পেপটাইড বা অ্যামাইড বন্ধন গঠনের সময় অ্যামিনো এসিডগুলো পরস্পরের সাথে যুক্ত হয় এবং সেই যুক্ত হওয়ার সময় একটি ছোট্ট পানির অণু বেরিয়ে যায়।[৬] এই যুক্তকরণ দুই প্রান্তে দুটি বিশেষ গ্রুপ তৈরি করে, যা N-টার্মিনাল এবং C-টার্মিনাল নামে পরিচিত। সাইক্লিক পেপটাইড ছাড়া সকল পেপটাইডের শেষে একটি N-টার্মিনাল (অ্যামিন গ্রুপ) এবং একটি C-টার্মিনাল (কার্বক্সিল গ্রুপ) অবশিষ্টা থাকে (ছবির টেট্রাপেপটাইডে দেখানো হয়েছে)।
শ্রেণীবিন্যাস
[সম্পাদনা]বহু ধরনের পেপটাইড রয়েছে, যাদের উৎস এবং কাজের উপর ভিত্তি করে শ্রেণীবদ্ধ করা হয়েছে। Handbook of Biologically Active Peptides বইটি অনুযায়ী, পেপটাইডের উৎস এবং কাজের উপর ভিত্তি করে বিভিন্ন ধরনের পেপটাইড রয়েছে। এগুলোর মধ্যে কিছু উল্লেখযোগ্য গ্রুপ হলো:[৭]
- উদ্ভিদ পেপটাইড: উদ্ভিদ থেকে উৎপাদিত হয়।
- ব্যাকটেরিয়া/অ্যান্টিবায়োটিক পেপটাইড: ব্যাকটেরিয়া দ্বারা উৎপাদিত হয় এবং সাধারণত অন্যান্য ব্যাকটেরিয়ার বিরুদ্ধে কাজ করে।
- ছত্রাকীয় পেপটাইড: ছত্রাক থেকে উৎপাদিত হয়।
- অমেরুদ্বী পেপটাইড: অমেরুদন্ডী প্রাণীদের মধ্যে পাওয়া যায়।
- উভচর/ত্বক পেপটাইড: উভচর প্রাণীদের ত্বকে পাওয়া যায়।
- বিষাক্ত পেপটাইড: বিষাক্ত প্রাণীদের বিষে পাওয়া যায়।
- ক্যান্সার/ক্যান্সার-বিরোধী পেপটাইড: ক্যান্সারের বৃদ্ধি বা ক্যান্সার প্রতিরোধে ভূমিকা রাখে।
- টিকা পেপটাইড: টিকার একটি উপাদান হিসাবে ব্যবহৃত হয়।
- রোগ প্রতিরোধক/প্রদাহজনক পেপটাইড: রোগ প্রতিরোধ ব্যবস্থায় বা প্রদাহজনক প্রতিক্রিয়ায় জড়িত।
- মস্তিষ্কের পেপটাইড: মস্তিষ্কে বিভিন্ন কাজ করে।
- অন্তঃক্ষরা পেপটাইড: গ্রন্থি থেকে নিঃসৃত হরমোন হিসাবে কাজ করে।
- গ্ৰহণীয় পেপটাইড: খাদ্য গ্রহণের সময় কাজ করে।
- আন্ত্রিক পেপটাইড: আন্ত্রিক পথে বিভিন্ন কাজ করে।
- হৃদয়-সংবহনতন্ত্রের পেপটাইড: হৃদয় ও রক্তনালীতন্ত্রে কাজ করে।
- বৃক্কীয় পেপটাইড: বৃক্কে কাজ করে।
- শ্বাসযন্ত্রের পেপটাইড: শ্বাসযন্ত্রে কাজ করে।
- অপিওড পেপটাইড: মস্তিষ্কে অপিওড গ্রাহকের সাথে যুক্ত হয়ে ব্যথা উপশম করে।
- স্নায়ুপুষ্টিদায়ক পেপটাইড: স্নায়ু কোষের বৃদ্ধি ও মেরামতের কাজ করে।
- রক্ত-মস্তিষ্ক পেপটাইড: রক্ত-মস্তিষ্ক বাধার মধ্য দিয়ে মস্তিষ্কে প্রবেশ করতে পারে।
কিছু রাইবোজোমাল পেপটাইড প্রোটিওলাইসিস নামক প্রক্রিয়ার মাধ্যমে ভেঙে যায়। সাধারণত উচ্চতর জীবদেহে, এই পেপটাইডগুলো হরমোন এবং সংকেত অণু হিসাবে কাজ করে। কিছু সূক্ষ্মজীব অ্যান্টিবায়োটিক হিসাবে পেপটাইড উৎপাদন করে, যেমন মাইক্রোসিন এবং ব্যাকটেরিওসিন।[৮]
পেপটাইডগুলো প্রায়শই "পরিবর্তন-পরবর্তী পরিবর্ধন" এর মধ্য দিয়ে যায়, যেমন - ফসফোরাইলেশন, হাইড্রোক্সিলেশন, সালফোনেশন, পামিটয়েলেশন, গ্লাইকোসিলেশন এবং ডাইসালফাইড গঠন। সাধারণত পেপটাইডগুলো সরল, রৈখিক শৃঙ্খল আকারে থাকে, তবে ল্যারিয়েট গঠনও দেখা যায়।[৯] এছাড়াও কিছু অস্বাভাবিক পরিবর্তনও ঘটে থাকে, যেমন প্ল্যাটিপাসের বিষে L-অ্যামিনো অ্যাসিডগুলো D-অ্যামিনো অ্যাসিডে রেসিমিজেশন।[১০]
নন-রাইবোজোমাল পেপটাইড সাধারণ রাইবোজোমের মাধ্যমে নয়, বিশেষ এনজাইমের মাধ্যমে তৈরি হয়। এই ধরনের পেপটাইডের একটি সাধারণ উদাহরণ হলো গ্লুটাথায়োন, যা অধিকাংশ এ্যারোবিক জীবের জারণরোধক প্রতিরক্ষা ব্যবস্থার একটি গুরুত্বপূর্ণ উপাদান।[১১] অন্যান্য নন-রাইবোজোমাল পেপটাইডগুলো সাধারণত এককোষী জীব, উদ্ভিদ এবং ছত্রাক-এ পাওয়া যায় এবং মডুলার এনজাইম কমপ্লেক্স নামক এনজাইমের জটিল গঠনের মাধ্যমে সংশ্লেষিত হয়। এই এনজাইম কমপ্লেক্সকে নন-রাইবোজোমাল পেপটাইড সিন্থেটেস বলা হয়।[১২]
এই জটিল এনজাইম গঠনগুলো প্রায়শই একই রকমভাবে সাজানো থাকে এবং বিভিন্ন ধরনের মডিউল থাকতে পারে, যা তৈরি হওয়া পেপটাইডের উপর বিভিন্ন ধরনের রাসায়নিক পরিবর্তন সাধন করে।[১৩] এই পেপটাইডগুলো প্রায়শই চক্রাকার হয় এবং খুব জটিল চক্রাকার গঠন থাকতে পারে, তবে সরল, রৈখিক নন-রাইবোজোমাল পেপটাইডও সাধারণ। যেহেতু এই ব্যবস্থাটি ফ্যাটি অ্যাসিড এবং পলিশেটিড গঠনের প্রক্রিয়ার সাথে ঘনিষ্ঠভাবে সম্পর্কযুক্ত, তাই এই পদ্ধতিতে তৈরি হওয়া যৌগগুলো প্রায়শই মিশ্র প্রকৃতির হয়। যদি কোনো যৌগে অক্সাজোল বা থিয়াজোল পাওয়া যায়, তাহলে সাধারণত ধরে নেওয়া হয় সেটি এই পদ্ধতিতে তৈরি হয়েছে।[১৪]
পেপটোন হলো প্রাণিজ দুধ বা মাংসকে প্রোটিওলাইসিস নামক প্রক্রিয়ার মাধ্যমে ভেঙে তৈরি করা হয় এমন একধরনের জৈবিক পদার্থ।[১৫] ছোট পেপটাইড থাকার পাশাপাশি, এতে চর্বি, ধাতু, লবণ, ভিটামিন এবং অন্যান্য অনেক জৈবিক যৌগও থাকে।[১৬]
পেপটাইড ফ্রাগমেন্ট হলো প্রোটিনের ছোট টুকরা যা একটি নির্দিষ্ট প্রোটিনের উৎস নির্ধারণ বা তার পরিমাণ পরিমাপ করতে ব্যবহৃত হয়।[১৭] সাধারণত এগুলো গবেষণারে নিয়ন্ত্রিত পরিবেশে এনজাইমের মাধ্যমে প্রোটিন ভেঙে পাওয়া যায়। তবে প্রাকৃতিকভাবে ক্ষতিগ্রস্ত ফরেনসিক বা প্রত্নতাত্ত্বিক নমুনা থেকেও পাওয়া যেতে পারে।[১৮][১৯]
রাসায়নিক সংশ্লেষণ
[সম্পাদনা]
প্রোটিন-পেপটাইড মিথস্ক্রিয়া
[সম্পাদনা]
পেপটাইড প্রোটিন এবং অন্যান্য ম্যাক্রোমলিকিউলের সাথে মিথস্ক্রিয়া করতে পারে। এগুলো মানব কোষে বিভিন্ন গুরুত্বপূর্ণ কাজের জন্য দায়ী, যেমন কোষ সংকেত, এবং রোগ প্রতিরোধ ব্যবস্থাকে নিয়ন্ত্রণ করে।[২১] গবেষণায় দেখা গেছে, মানব কোষে প্রোটিন-প্রোটিন মিথস্ক্রিয়ার ১৫-৪০% পেপ্টাইডের মাধ্যমে পরিচালিত হয়।[২২] এছাড়াও, অনুমান করা হয় যে ঔষধ বাজারের কমপক্ষে ১০% পেপ্টাইড পণ্যের উপর ভিত্তি করে তৈরি।[২৩]
গোত্রীয় উদাহরণ
[সম্পাদনা]এই অংশে উল্লিখিত পেপটাইড গোত্রগুলো প্রধানত হরমোনের কার্যকলাপ সম্পন্ন করা রাইবোজোমাল পেপটাইড। এই সব পেপটাইডগুলো কোষে দীর্ঘ "প্রোপেপটাইড" বা "প্রোপ্রোটিন" হিসাবে সংশ্লেষিত হয় এবং কোষ থেকে বের হওয়ার আগে কাটা হয়। এরপর সেগুলো রক্তপ্রবাহে মুক্তি পায় এবং সেখানে সংকেত বহনের কাজ করে।
অ্যান্টিমাইক্রোবিয়াল পেপটাইড
[সম্পাদনা]- ম্যাগাইনিন গোত্র
- সেসক্রোপিন গোত্র
- ক্যাথেলিসিডিন গোত্র
- ডিফেনসিন গোত্র
ট্যাকিকিনিন পেপটাইড
[সম্পাদনা]উদরস্থলীয় সক্রিয় পেপটাইড
[সম্পাদনা]- ভিআইপি (ভেসোঅ্যাক্টিভ ইনটেস্টিনাল পেপটাইড; PHM27)
- পিএসিএপি পিটুইটারি অ্যাডেনাইলেট সাইক্লেজ অ্যাক্টিভেটিং পেপটাইড
- পেপটাইড পিএইচআই ২৭ (পেপটাইড হিস্টিডিন আইসোলিউসিন ২৭)
- জিএইচআরএইচ ১-২৪ (গ্রোথ হরমোন রিলিজিং হরমোন ১-২৪)
- গ্লুকাগন
- সিক্রেটিন
প্যানক্রিয়াটিক পলিপেপ্টাইড-সম্পর্কিত পেপ্টাইড
[সম্পাদনা]- এনপিওয়াই (নিউরোপেপ্টাইড Y)
- পিওয়াইওয়াই (পেপটাইড YY)
- এপিপি (পাখির অগ্ন্যাশয়ের পলিপেপটাইড)
- পিপিওয়াই (অগ্ন্যাশয় পলিপেপটাইড)
অপিওড পেপটাইড
[সম্পাদনা]- প্রো-ওপিওমেলানোকোর্টিন (POMC) ) পেপটাইড
- এনকেফালিন পেন্টাটেপ্টাইড
- প্রোডাইনোরফিন পেপটাইড
ক্যালসিটোনিন পেপটাইড
[সম্পাদনা]স্ব-একত্রিত পেপটাইড
[সম্পাদনা]- সুগন্ধযুক্ত ছোট পেপটাইড[২৪][২৫]
- জীব-অনুকরণকারী পেপটাইড[২৬]
- পেপটাইড অ্যাম্ফিফাইল[২৭][২৮][২৯][৩০]
- পেপটাইড ডেন্ড্রিমার[৩১]
অন্যান্য পেপটাইড
[সম্পাদনা]- বি-ধরনের ন্যাট্রিউরেটিক পেপ্টাইড (বিএনপি) - হৃৎপেশীতে উৎপাদিত হয় এবং এটি চিকিৎসার জন্য কার্যকর
- ল্যাকটোট্রিপেপ্টাইড - ল্যাকটোট্রিপেপ্টাইডগুলো রক্তচাপ কমাতে পারে,[৩২][৩৩][৩৪] যদিও প্রমাণ মিশ্রিত।[৩৫]
- ঐতিহ্যবাহী চীনা ঔষধ Colla Corii Asini-এর পেপটাইডিক উপাদান এবং হেমাটোপয়েসিস।[৩৬]
- জেলিন - মধুমৌমাখির রয়েল জেলি থেকে তৈরি।
পরিভাষা
[সম্পাদনা]দৈর্ঘ্য
[সম্পাদনা]পলিপেপটাইড, প্রোটিন এবং অলিগোপেপটাইড - এই তিনটি শব্দই অ্যামিনো অ্যাসিড দ্বারা গঠিত, তবে তাদের মধ্যে দৈর্ঘ্যের ভিন্নতা রয়েছে।
- পলিপেপটাইড: এটি অসংখ্য অ্যামিনো অ্যাসিডের একটি সরল শৃঙ্খল। এর কোনো নির্দিষ্ট দৈর্ঘ্যের সীমাবদ্ধতা নেই, তবে সাধারণত এটিতে ৫০ টিরও বেশি অ্যামিনো অ্যাসিড থাকে।
- প্রোটিন: এটি একটি বা একাধিক পলিপেপটাইড নিয়ে গঠিত। প্রোটিনের দৈর্ঘ্য ৫০ টিরও বেশি অ্যামিনো অ্যাসিড থেকে শুরু করে হাজার হাজার অ্যামিনো অ্যাসিড পর্যন্ত হতে পারে।
- অলিগোপেপটাইড: এটি কেবল কয়েকটি অ্যামিনো অ্যাসিড (দুই থেকে বিশ) নিয়ে গঠিত।
অ্যামিনো অ্যাসিডের সংখ্যা
[সম্পাদনা]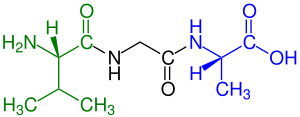
পেপটাইড এবং প্রোটিন সাধারণত তাদের শৃঙ্খলে থাকা অ্যামিনো অ্যাসিডের সংখ্যা দ্বারা বর্ণনা করা হয়। উদাহরণস্বরূপ, ১৫৮টি অ্যামিনো অ্যাসিড দীর্ঘ একটি প্রোটিনকে "১৫৮ অ্যামিনো অ্যাসিড দীর্ঘ প্রোটিন" হিসাবে বর্ণনা করা যেতে পারে। নির্দিষ্ট সংখ্যক অ্যামিনো অ্যাসিডযুক্ত পেপটাইডগুলোকে আইইউপিএসি সংখ্যাসূচক গুণক উপসর্গ ব্যবহার করে নামকরণ করা হয়:
- মনোপেপটাইড: একটি অ্যামিনো অ্যাসিড দ্বারা গঠিত।
- ডাইপেপটাইড: দুটি অ্যামিনো অ্যাসিড দ্বারা গঠিত।
- ট্রাইপেপটাইড: তিনটি অ্যামিনো অ্যাসিড দ্বারা গঠিত।
- টেট্রাপেপটাইড: চারটি অ্যামিনো অ্যাসিড দ্বারা গঠিত।
- পেন্টাপেপটাইড: পাঁচটি অ্যামিনো অ্যাসিড দ্বারা গঠিত (উদাহরণস্বরূপ, এনকেফালিন)।
- হেক্সাপেপটাইড: ছয়টি অ্যামিনো অ্যাসিড দ্বারা গঠিত (উদাহরণস্বরূপ, অ্যাঞ্জিওটেনসিন IV)।
- হেপ্টাপেপটাইড: সাতটি অ্যামিনো অ্যাসিড দ্বারা গঠিত (উদাহরণস্বরূপ, স্পিনোরফিন)।
- অক্টাপেপটাইড: আটটি অ্যামিনো অ্যাসিড দ্বারা গঠিত (উদাহরণস্বরূপ, অ্যাঞ্জিওটেনসিন II)।
- নোনাপেপটাইড: নয়টি অ্যামিনো অ্যাসিড দ্বারা গঠিত (উদাহরণস্বরূপ, অক্সিটোসিন)।
- ডিকাপেপটাইড: দশটি অ্যামিনো অ্যাসিড দ্বারা গঠিত (উদাহরণস্বরূপ, গোনাডোট্রপিন-রিলিজিং হরমোন এবং অ্যাঞ্জিওটেনসিন I)।
- উনডেকাপেপটাইড: এগারোটি অ্যামিনো অ্যাসিড দ্বারা গঠিত (উদাহরণস্বরূপ, সাবস্ট্যান্স পি)।
একই শব্দগুলো বৃহত্তর পলিপেপটাইডের (যেমন, আরজিডি মোটিফ) অবশিষ্টাংশ গ্রুপকে বর্ণনা করতেও ব্যবহৃত হয়।
কার্যক্রিয়া
[সম্পাদনা]- নিউরোপেপটাইড: এমন একটি পেপটাইড যা স্নায়ুকলার টিস্যুর সাথে সম্পর্কিত কাজ করে।
- লিপোপেপটাইড: একটি পেপটাইড যার সাথে লিপিড সংযুক্ত থাকে। পেপডুসিন হলো লিপোপেপটাইডের একটি ধরন যা জিপিসিআর-এর সাথে মিথস্ক্রিয়া করে।
- পেপটাইড হরমোন: এমন একটি পেপটাইড যা হরমোন হিসেবে কাজ করে।
- প্রোটিওজ: এটি প্রোটিনের হাইড্রোলাইসিসের ফলে উৎপাদিত পেপটাইডের মিশ্রণ। এই শব্দটি কিছুটা পুরনো ধাঁচের।
- পেপটাইডার্জিক এজেন্ট (বা ঔষধ): এমন একটি রাসায়নিক যা শরীর বা মস্তিষ্কে পেপটাইড সিস্টেমকে সরাসরি নিয়ন্ত্রণ করে। এর একটি উদাহরণ হল ওপিওইডার্জিক, যা নিউরোপেপটাইডার্জিকের একটি ধরন।
- কোষ-ভেদকারী পেপটাইড: এমন একটি পেপটাইড যা কোষের ঝিল্লি ভেদ করে প্রবেশ করতে পারে।
আরও দেখুন
[সম্পাদনা]- অ্যাসিটাইল হেক্সাপেপটাইড-৩
- গরুর মাংসের পেপটাইড
- কলজেন হাইব্রিডাইজিং পেপটাইড, একটি ক্ষুদ্র পেপটাইড যা টিস্যুতে অস্বচ্ছল কোলাজেনের সাথে আবদ্ধ হতে পারে।
- দ্বি-পেপটাইড
- সিএলই পেপটাইড
- ত্বকের বৃদ্ধি কারক
- জার্নাল অব পেপটাইড সায়েন্স
- ল্যাকটোট্রিপেপটাইড
- মাইক্রোপেপটাইড
- মাল্টিফাংশনাল পেপটাইড
- নিউরোপেপটাইড
- প্যালমিটয়েল পেন্টা-পেপ্টাইড-৪
- অগ্ন্যাশয় হরমোন
- পেপটাইড স্পেকট্রাল লাইব্রেরি
- পেপটাইড সংশ্লেষণ পেপটাইড সংশ্লেষণ
- পেপ্টিডোমাইমেটিক (যেমন পেপটয়েড এবং β-পেপটাইড) পেপটাইডের মতো, কিন্তু বিভিন্ন বৈশিষ্ট্য সহকারে।
- প্রোটিন ট্যাগ, প্রোটিন পৃথককরণ বা সনাক্তকরণ সহজ করার জন্য পেপটাইড ক্রম যোগ করার বর্ণনা।
- রেপ্লিকিন্স্
- রাইবোজোম
- অনুবাদ (জীববিজ্ঞান)
তথ্যসূত্র
[সম্পাদনা]- ↑ Hamley, I. W. (সেপ্টেম্বর ২০২০)। introduction to Peptide Science। Wiley। আইএসবিএন 978-1-119-69817-3।
- ↑ নেলসন, ডেভিড এল.; কক্স, মাইকেল এম. (২০০৫), Principles of Biochemistry (৪র্থ সংস্করণ), নিউ ইয়র্ক: ডব্লিউ. এইচ. ফ্রিম্যান, আইএসবিএন 0-7167-4339-6
- ↑ Saladin, K. (১৩ জানুয়ারি ২০১১)। Anatomy & physiology: the unity of form and function (6th সংস্করণ)। McGraw-Hill। পৃষ্ঠা 67। আইএসবিএন 978-0-07-337825-1।
- ↑ International Union of Pure and Applied Chemistry. "proteins". Compendium of Chemical Terminology Internet edition..
- ↑ Ardejani, Maziar S.; Orner, Brendan P. (২০১৩-০৫-০৩)। "Obey the Peptide Assembly Rules"। Science। 340 (6132): 561–562। আইএসএসএন 0036-8075। এসটুসিআইডি 206548864। ডিওআই:10.1126/science.1237708। পিএমআইডি 23641105। বিবকোড:2013Sci...340..561A।
- ↑ International Union of Pure and Applied Chemistry. "amino-acid residue in a polypeptide". Compendium of Chemical Terminology Internet edition..
- ↑ Abba J. Kastin, সম্পাদক (২০১৩)। Handbook of Biologically Active Peptides (2nd সংস্করণ)। Elsevier Science। আইএসবিএন 978-0-12-385095-9।
- ↑ Duquesne S, Destoumieux-Garzón D, Peduzzi J, Rebuffat S (আগস্ট ২০০৭)। "Microcins, gene-encoded antibacterial peptides from enterobacteria"। Natural Product Reports। 24 (4): 708–34। ডিওআই:10.1039/b516237h। পিএমআইডি 17653356।
- ↑ Pons M, Feliz M, Antònia Molins M, Giralt E (মে ১৯৯১)। "Conformational analysis of bacitracin A, a naturally occurring lariat"। Biopolymers। 31 (6): 605–12। এসটুসিআইডি 10924338। ডিওআই:10.1002/bip.360310604। পিএমআইডি 1932561।
- ↑ Torres AM, Menz I, Alewood PF, ও অন্যান্য (জুলাই ২০০২)। "D-Amino acid residue in the C-type natriuretic peptide from the venom of the mammal, Ornithorhynchus anatinus, the Australian platypus"। FEBS Letters। 524 (1–3): 172–6। এসটুসিআইডি 3015474। ডিওআই:10.1016/S0014-5793(02)03050-8। পিএমআইডি 12135762।
- ↑ Meister A, Anderson ME; Anderson (১৯৮৩)। "Glutathione"। Annual Review of Biochemistry। 52 (1): 711–60। ডিওআই:10.1146/annurev.bi.52.070183.003431। পিএমআইডি 6137189।
- ↑ Hahn M, Stachelhaus T; Stachelhaus (নভেম্বর ২০০৪)। "Selective interaction between nonribosomal peptide synthetases is facilitated by short communication-mediating domains"। Proceedings of the National Academy of Sciences of the United States of America। 101 (44): 15585–90। ডিওআই:10.1073/pnas.0404932101
 । পিএমআইডি 15498872। পিএমসি 524835
। পিএমআইডি 15498872। পিএমসি 524835  । বিবকোড:2004PNAS..10115585H।
। বিবকোড:2004PNAS..10115585H।
- ↑ Finking R, Marahiel MA; Marahiel (২০০৪)। "Biosynthesis of nonribosomal peptides1"। Annual Review of Microbiology। 58 (1): 453–88। ডিওআই:10.1146/annurev.micro.58.030603.123615। পিএমআইডি 15487945।
- ↑ Du L, Shen B; Shen (মার্চ ২০০১)। "Biosynthesis of hybrid peptide-polyketide natural products"। Current Opinion in Drug Discovery & Development। 4 (2): 215–28। পিএমআইডি 11378961।
- ↑ "UsvPeptides- USVPeptides is a leading pharmaceutical company in India"। USVPeptides।
- ↑ Payne, J. W.; Rose, Anthony H.; Tempest, D. W. (২৭ সেপ্টেম্বর ১৯৭৪)। "Peptides and micro-organisms"। Advances in Microbial Physiology, Volume 13। 13। Oxford, England: Elsevier Science। পৃষ্ঠা 55–160। আইএসবিএন 978-0-08-057971-9। ওসিএলসি 1049559483। ডিওআই:10.1016/S0065-2911(08)60038-7। পিএমআইডি 775944।
- ↑ Hummel J, Niemann M, Wienkoop S, Schulze W, Steinhauser D, Selbig J, Walther D, Weckwerth W (২০০৭)। "ProMEX: a mass spectral reference database for proteins and protein phosphorylation sites"। BMC Bioinformatics। 8 (1): 216। ডিওআই:10.1186/1471-2105-8-216
 । পিএমআইডি 17587460। পিএমসি 1920535
। পিএমআইডি 17587460। পিএমসি 1920535  ।
।
- ↑ Webster J, Oxley D; Oxley (২০০৫)। "Peptide Mass Fingerprinting"
 । Chemical Genomics। Methods in Molecular Biology। 310। পৃষ্ঠা 227–40। আইএসবিএন 978-1-58829-399-2। ডিওআই:10.1007/978-1-59259-948-6_16। পিএমআইডি 16350956।
। Chemical Genomics। Methods in Molecular Biology। 310। পৃষ্ঠা 227–40। আইএসবিএন 978-1-58829-399-2। ডিওআই:10.1007/978-1-59259-948-6_16। পিএমআইডি 16350956।
- ↑ Marquet P, Lachâtre G; Lachâtre (অক্টোবর ১৯৯৯)। "Liquid chromatography-mass spectrometry: potential in forensic and clinical toxicology"। Journal of Chromatography B। 733 (1–2): 93–118। ডিওআই:10.1016/S0378-4347(99)00147-4। পিএমআইডি 10572976।
- ↑ "Propedia v2.3 - Peptide-Protein Interactions Database"। bioinfo.dcc.ufmg.br। সংগ্রহের তারিখ ২০২৩-০৩-২৮।
- ↑ Martins, Pedro M.; Santos, Lucianna H.; Mariano, Diego; Queiroz, Felippe C.; Bastos, Luana L.; Gomes, Isabela de S.; Fischer, Pedro H. C.; Rocha, Rafael E. O.; Silveira, Sabrina A.; de Lima, Leonardo H. F.; de Magalhães, Mariana T. Q.; Oliveira, Maria G. A.; de Melo-Minardi, Raquel C. (ডিসেম্বর ২০২১)। "Propedia: a database for protein–peptide identification based on a hybrid clustering algorithm"। BMC Bioinformatics (ইংরেজি ভাষায়)। 22 (1): 1। আইএসএসএন 1471-2105। ডিওআই:10.1186/s12859-020-03881-z
 । পিএমআইডি 33388027
। পিএমআইডি 33388027 |pmid=এর মান পরীক্ষা করুন (সাহায্য)। পিএমসি 7776311
|pmc=এর মান পরীক্ষা করুন (সাহায্য)। - ↑ Neduva, Victor; Linding, Rune; Su-Angrand, Isabelle; Stark, Alexander; Masi, Federico de; Gibson, Toby J; Lewis, Joe; Serrano, Luis; Russell, Robert B (২০০৫-১১-১৫)। Matthews, Rowena, সম্পাদক। "Systematic Discovery of New Recognition Peptides Mediating Protein Interaction Networks"। PLOS Biology (ইংরেজি ভাষায়)। 3 (12): e405। আইএসএসএন 1545-7885। ডিওআই:10.1371/journal.pbio.0030405
 । পিএমআইডি 16279839। পিএমসি 1283537
। পিএমআইডি 16279839। পিএমসি 1283537  ।
।
- ↑ Martins, Pedro M.; Santos, Lucianna H.; Mariano, Diego; Queiroz, Felippe C.; Bastos, Luana L.; Gomes, Isabela de S.; Fischer, Pedro H. C.; Rocha, Rafael E. O.; Silveira, Sabrina A.; de Lima, Leonardo H. F.; de Magalhães, Mariana T. Q.; Oliveira, Maria G. A.; de Melo-Minardi, Raquel C. (ডিসেম্বর ২০২১)। "Propedia: a database for protein–peptide identification based on a hybrid clustering algorithm"। BMC Bioinformatics (ইংরেজি ভাষায়)। 22 (1): 1। আইএসএসএন 1471-2105। ডিওআই:10.1186/s12859-020-03881-z
 । পিএমআইডি 33388027
। পিএমআইডি 33388027 |pmid=এর মান পরীক্ষা করুন (সাহায্য)। পিএমসি 7776311
|pmc=এর মান পরীক্ষা করুন (সাহায্য)। - ↑ Tao, Kai; Makam, Pandeeswar; Aizen, Ruth; Gazit, Ehud (১৭ নভে ২০১৭)। "Self-assembling peptide semiconductors"। Science। 358 (6365): eaam9756। ডিওআই:10.1126/science.aam9756। পিএমআইডি 29146781। পিএমসি 5712217
 ।
।
- ↑ Tao, Kai; Levin, Aviad; Adler-Abramovich, Lihi; Gazit, Ehud (২৬ এপ্রিল ২০১৬)। "Fmoc-modified amino acids and short peptides: simple bio-inspired building blocks for the fabrication of functional materials"। Chem. Soc. Rev.। 45 (14): 3935–3953। ডিওআই:10.1039/C5CS00889A। পিএমআইডি 27115033।
- ↑ Tao, Kai; Wang, Jiqian; Zhou, Peng; Wang, Chengdong; Xu, Hai; Zhao, Xiubo; Lu, Jian R. (ফেব্রুয়ারি ১০, ২০১১)। "Self-Assembly of Short Aβ(16−22) Peptides: Effect of Terminal Capping and the Role of Electrostatic Interaction"। Langmuir। 27 (6): 2723–2730। ডিওআই:10.1021/la1034273। পিএমআইডি 21309606।
- ↑ Ian Hamley (২০১১)। "Self-Assembly of Amphiphilic Peptides" (পিডিএফ)। Soft Matter। 7 (9): 4122–4138। ডিওআই:10.1039/C0SM01218A। বিবকোড:2011SMat....7.4122H।
- ↑ Kai Tao; Guy Jacoby; Luba Burlaka; Roy Beck; Ehud Gazit (জুলাই ২৬, ২০১৬)। "Design of Controllable Bio-Inspired Chiroptic Self-Assemblies"। Biomacromolecules। 17 (9): 2937–2945। ডিওআই:10.1021/acs.biomac.6b00752। পিএমআইডি 27461453।
- ↑ Kai Tao; Aviad Levin; Guy Jacoby; Roy Beck; Ehud Gazit (২৩ আগস্ট ২০১৬)। "Entropic Phase Transitions with Stable Twisted Intermediates of Bio‐Inspired Self‐Assembly"। Chem. Eur. J.। 22 (43): 15237–15241। ডিওআই:10.1002/chem.201603882। পিএমআইডি 27550381।
- ↑ Donghui Jia; Kai Tao; Jiqian Wang; Chengdong Wang; Xiubo Zhao; Mohammed Yaseen; Hai Xu; Guohe Que; John R. P. Webster; Jian R. Lu (জুন ১৬, ২০১১)। "Dynamic Adsorption and Structure of Interfacial Bilayers Adsorbed from Lipopeptide Surfactants at the Hydrophilic Silicon/Water Interface: Effect of the Headgroup Length"। Langmuir। 27 (14): 8798–8809। ডিওআই:10.1021/la105129m। পিএমআইডি 21675796।
- ↑ Heitz, Marc; Javor, Sacha; Darbre, Tamis; Reymond, Jean-Louis (২০১৯-০৮-২১)। "Stereoselective pH Responsive Peptide Dendrimers for siRNA Transfection"। Bioconjugate Chemistry (ইংরেজি ভাষায়)। 30 (8): 2165–2182। আইএসএসএন 1043-1802। এসটুসিআইডি 199519310। ডিওআই:10.1021/acs.bioconjchem.9b00403। পিএমআইডি 31398014।
- ↑ Boelsma E, Kloek J; Kloek (মার্চ ২০০৯)। "Lactotripeptides and antihypertensive effects: a critical review"। The British Journal of Nutrition। 101 (6): 776–86। ডিওআই:10.1017/S0007114508137722
 । পিএমআইডি 19061526।
। পিএমআইডি 19061526।
- ↑ Xu JY, Qin LQ, Wang PY, Li W, Chang C (অক্টোবর ২০০৮)। "Effect of milk tripeptides on blood pressure: a meta-analysis of randomized controlled trials"। Nutrition। 24 (10): 933–40। ডিওআই:10.1016/j.nut.2008.04.004। পিএমআইডি 18562172।
- ↑ Pripp AH (২০০৮)। "Effect of peptides derived from food proteins on blood pressure: a meta-analysis of randomized controlled trials"। Food & Nutrition Research। 52: 10.3402/fnr.v52i0.1641। ডিওআই:10.3402/fnr.v52i0.1641। পিএমআইডি 19109662। পিএমসি 2596738
 ।
।
- ↑ Engberink MF, Schouten EG, Kok FJ, van Mierlo LA, Brouwer IA, Geleijnse JM (ফেব্রুয়ারি ২০০৮)। "Lactotripeptides show no effect on human blood pressure: results from a double-blind randomized controlled trial"। Hypertension। 51 (2): 399–405। ডিওআই:10.1161/HYPERTENSIONAHA.107.098988
 । পিএমআইডি 18086944।
। পিএমআইডি 18086944।
- ↑ Wu, Hongzhong; Ren, Chunyan; Yang, Fang; Qin, Yufeng; Zhang, Yuanxing; Liu, Jianwen (এপ্রিল ২০১৬)। "Extraction and identification of collagen-derived peptides with hematopoietic activity from Colla Corii Asini"। Journal of Ethnopharmacology। 182: 129–136। ডিওআই:10.1016/j.jep.2016.02.019। পিএমআইডি 26911525।
