রাইবোজোম
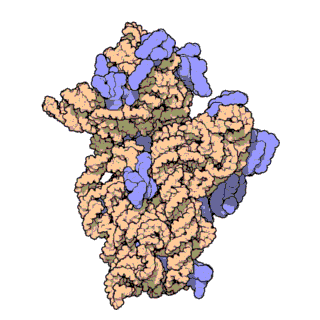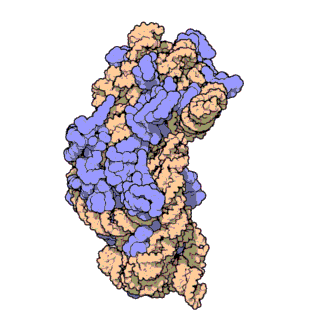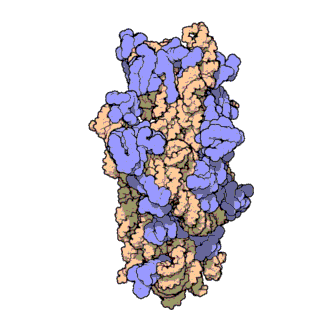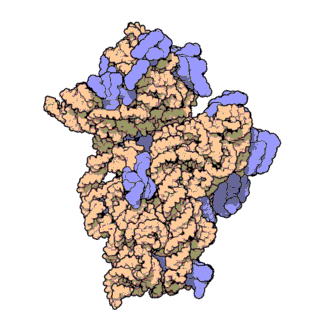
রাইবোজোম , যাকে 'প্যালাডে দানা' ও বলা হয় (আবিষ্কারক জর্জ প্যালাডের[১] নামানুসারে ও দানাদার গঠনের কারণে) এক ধরনের ম্যাক্রোমোলার অঙ্গাণু[২] যা দেহের সকল কোষেই[৩] পাওয়া যায়। এটি মূলত জৈবিক প্রোটিন সংশ্লেষণের[৪] (মেসেঞ্জার আরএনএ বা বার্তাবহ আরএনএ থেকে প্রোটিন তৈরির প্রক্রিয়া) কাজ করে থাকে।
রাইবোজোম পলিপেপটাইড শৃঙ্খল[৫] গঠন করতে বার্তাবহ আরএনএ[৬] এর কোডন[৭] অনুসারে অ্যামিনো অ্যাসিডগুলোর সংযোগ ঘটায়। রাইবোজোম দুটি প্রধান ভাগে বিভক্ত। এরা ছোট ও বড় রাইবোজোমাল সাবইউনিট নামে পরিচিত। প্রতিটি সাবইউনিট এক বা একাধিক রাইবোজোমাল আরএনএ[৮] ও রাইবোজোমাল প্রোটিন[৯] দিয়ে তৈরি।[১০][১১][১২] রাইবোজোম এবং এর সহযোগী অঙ্গাণু সমূহকে ট্রান্সলেশনাল আ্যাপারেটাস বা প্রোটিন তৈরির যন্ত্র নামেও ডাকা হয়।
একনজরে
[সম্পাদনা]ডিএনএর[১৩] ক্রম যা একটি প্রোটিনের অ্যামিনো অ্যাসিডের ক্রমকে এনকোড করে তা একটি মেসেঞ্জার আরএনএ শৃঙ্খলে প্রতিলিপি করে। রাইবোসোমগুলি মেসেঞ্জার আরএনএগুলির সাথে আবদ্ধ হয় এবং একটি প্রদত্ত প্রোটিন তৈরি করতে অ্যামিনো অ্যাসিডের সঠিক ক্রম নির্ধারণের জন্য তাদের ক্রমগুলি ব্যবহার করে। অ্যামিনো অ্যাসিডগুলো স্থানান্তরিত আরএনএ (tRNA)[১৪] অণুর মাধ্যমে নির্বাচিত হয় এবং রাইবোসোমে বাহিত হয়, যা রাইবোসোমে প্রবেশ করে এবং অ্যান্টি-কোডন[১৫] স্টেম লুপের মাধ্যমে মেসেঞ্জার আরএনএ শৃঙ্খলের সাথে আবদ্ধ হয়। মেসেঞ্জার আরএনএ-তে প্রতিটি কোডিং ট্রিপলেট (কোডন) এর জন্য, একটি অনন্য ট্রান্সফার আরএনএ রয়েছে যার অবশ্যই সঠিক অ্যান্টি-কোডন মিল থাকতে হবে এবং ক্রমবর্ধমান পলিপেপটাইড চেইনে অন্তর্ভুক্ত করার জন্য সঠিক অ্যামিনো অ্যাসিড বহন করে। প্রোটিন উত্পাদিত হলে, এটি একটি কার্যকরী ত্রিমাত্রিক গঠন তৈরি করতে ভাঁজ[১৬] করতে পারে। একটি রাইবোজোম আরএনএ[১৭] ও অনেকগুলো প্রোটিনের সমন্বয়ে গঠিত এবং এ দুটি একত্রে রাইবোনিউক্লিওপ্রোটিন যৌগ[১৮] তৈরি করে। প্রতিটি রাইবোজোম ছোট ৩০এস এবং বড় ৫০এস সাবইউনিট এ বিভক্ত। উভয়েই একে অপরের উপর নির্ভরশীল।
- ৩০এস-এর প্রধানত একটি ডিকোডিং ফাংশন রয়েছে এবং এটি এমআরএনএ এর সাথেও আবদ্ধ।
- ৫০এস-এর প্রধানত একটি অনুঘটক ফাংশন রয়েছে এবং এটি অ্যামিনোঅ্যাসিলেটেড টিআরএনএগুলির সাথেও আবদ্ধ।
তাদের বিল্ডিং ব্লক থেকে প্রোটিনগুলির সংশ্লেষণ চারটি পর্যায়ে সঞ্চালিত হয়: সূচনা, প্রসারণ, সমাপ্তি এবং পুনর্ব্যবহারযোগ্য। সমস্ত এমআরএনএ অণুতে স্টার্ট কোডনের ক্রম AUG আছে। স্টপ কোডন হল UAA, UAG, বা UGA এর মধ্যে একটি; যেহেতু এই কোডনগুলিকে চিনতে পারে এমন কোনও টিআরএনএ অণু নেই, তাই রাইবোসোম মনে করে যে সংশ্লেষণ সম্পূর্ণ হয়েছে।[১৯] যখন একটি রাইবোসোম একটি এমআরএনএ অণু পড়া শেষ করে, তখন দুটি উপইউনিট আলাদা হয়ে যায় এবং সাধারণত ভেঙে যায় তবে পুনরায় ব্যবহার করা যেতে পারে। রাইবোসোমগুলি হল রাইবোজাইম, কারণ অনুঘটক পেপটাইডিল ট্রান্সফারেজের কার্যকলাপ যা অ্যামিনো অ্যাসিডকে একত্রে সংযুক্ত করে তা রাইবোসোমাল আরএনএ দ্বারা সঞ্চালিত হয়।[২০]
রাইবোসোমগুলি প্রায়শই অন্তঃকোষীয় ঝিল্লির সাথে যুক্ত থাকে যা অমসৃণ এন্ডোপ্লাজমিক জালিকা তৈরি করে।
ব্যাকটেরিয়া, আর্কিয়া এবং তিন ডোমেইন সিস্টেমের প্রকৃত কোষের রাইবোজোমের মধ্যে লক্ষণীয় মিল দেখা যায় যা একটি সাধারণ উৎপত্তির প্রমাণ। এদের আকার, আকৃতি, ক্রম, গঠন এবং প্রোটিন ও আরএনএ এর অনুপাত ভিন্ন। গঠনের এই পার্থক্য কিছু ব্যাকটেরিয়া প্রতিরোধীকে (অ্যান্টিবায়োটিক) ব্যাকটেরিয়ার রাইবোজোমকে প্রোটিন সংশ্লেষণে বাধা দেয়ার মাধ্যমে ব্যাকটেরিয়া মারতে সাহায্য করে। যার দরুন মানুষের রাইবোজোম অক্ষুণ্ন থাকে। সকল প্রজাতিতে একের অধিক রাইবোজোম একই সময়ে একটি একক বার্তাবহ আরএনএ এর শিকল বরাবর অগ্রসর হয়। প্রতিটি "রিডিং" একটি নির্দিষ্ট অনুক্রম এবং এরা প্রোটিন অণু উৎপাদন করে।
প্রকৃত কোষের মাইটোকন্ড্রিয়ায় অবস্থিত রাইবোজোম কার্যগতভাবে ব্যাকটেরিয়ার কোষে অবস্থিত রাইবোজোমের অনেক বৈশিষ্ট্যের সাথে মিল দেখায় যা মাইটোকন্ড্রিয়ার বিবর্তনিক উৎপত্তিকেই নির্দেশ করে।[২১][২২]
আবিষ্কার
[সম্পাদনা]১৯৫৪ সালে আলবার্ট ক্লড নামক একজন বিজ্ঞানী যকৃত কোষের সাইটোপ্লাজম কে সেন্ট্রিফিউজ করে আর.এন.এ. সমৃদ্ধ বহু ক্ষুদ্রকণা পৃথক করেন এবং এর নাম দেন মাইক্রোসোম। ১৯৫০-এর দশকের মাঝামাঝি সময়ে রোমানিয়ান-আমেরিকান কোষ জীববিজ্ঞানী জর্জ এমিল প্যালাডে, একটি ইলেক্ট্রন অণুবীক্ষণ যন্ত্র ব্যবহার করে ঘন কণা বা দানা হিসেবে রাইবোসোমগুলি প্রথম দেখতে পান।[২৩] "রাইবোসোম" শব্দটি ১৯৫৮ সালের শেষের দিকে বিজ্ঞানী হাগুয়েনাউ প্রস্তাব করেছিলেন:
সিম্পোজিয়াম চলাকালীন একটি অসুবিধা স্পষ্ট হয়ে ওঠে। কিছু অংশগ্রহণকারীদের কাছে, "মাইক্রোসোম" বলতে অন্যান্য প্রোটিন এবং লিপিড উপাদান দ্বারা দূষিত মাইক্রোজোম ভগ্নাংশের রাইবোনিউক্লিওপ্রোটিন কণাকে বোঝায়; অন্যদের কাছে, মাইক্রোসোমগুলি কণা দ্বারা দূষিত প্রোটিন এবং লিপিড নিয়ে গঠিত। শব্দগুচ্ছ "মাইক্রোসোমাল কণা" পর্যাপ্ত বলে মনে হয় না এবং "মাইক্রোসোম ভগ্নাংশের রাইবোনিউক্লিওপ্রোটিন কণা" খুবই বিশ্রী। বৈঠকের সময়, "রাইবোসোম" শব্দটি প্রস্তাবিত হয়েছিল, যেটি খুব সুন্দর নাম এবং শুনতেও ভালো শোনায়। বর্তমান বিভ্রান্তি দূর হবে যদি ৩৫ থেকে ১০০এস পর্যন্ত আকারে রাইবোনিউক্লিওপ্রোটিন কণা নির্ধারণের জন্য "রাইবোসোম" নামটি গ্রহণ করা হয়।[২৪]
অ্যালবার্ট ক্লদ, ক্রিশ্চিয়ান দ্য দুবে এবং জর্জ এমিল প্যালাডে ১৯৭৪ সালে রাইবোসোম আবিষ্কারের জন্য যৌথভাবে চিকিৎসা বিজ্ঞানে নোবেল পুরস্কার লাভ করেন।[২৫] রাইবোসোমের বিশদ গঠন ও প্রক্রিয়া নির্ধারণের জন্য ২০০৯ সালে রসায়নে নোবেল পুরস্কার দেওয়া হয় ভেঙ্কটরামন রামকৃষ্ণান, টমাস এ. স্টিটজ এবং অ্যাডা ই. ইয়োনাথকে।[২৬]
গঠন
[সম্পাদনা]রাইবোসোম একটি জটিল কোষীয় অঙ্গাণু। এটি মূলত রাইবোসোমাল আরএনএ (rRNA) এবং কয়েক ডজন স্বতন্ত্র প্রোটিন দ্বারা গঠিত (সঠিক সংখ্যা প্রজাতির মধ্যে সামান্য পরিবর্তিত হয়)। রাইবোসোমাল প্রোটিন এবং আরআরএনএগুলি বিভিন্ন আকারের দুটি স্বতন্ত্র রাইবোসোমাল টুকরোতে বিন্যস্ত থাকে, যা সাধারণত রাইবোসোমের বড় এবং ছোট সাবইউনিট হিসাবে পরিচিত। রাইবোসোম দুটি সাবইউনিট নিয়ে গঠিত যা একসাথে সংযুক্ত থাকে এবং প্রোটিন সংশ্লেষণের সময় এমআরএনএ -কে একটি পলিপেপটাইড চেইনে রূপান্তর করতে কাজ করে। যেহেতু তারা অ-সমান আকারের দুটি সাবইউনিট থেকে গঠিত, তাই তারা ব্যাসের তুলনায় অক্ষে কিছুটা লম্বা।
আদিকোষী রাইবোসোম
[সম্পাদনা]আদিকোষী রাইবোসোমগুলির ব্যাস প্রায় ২০ ন্যানোমিটার (২০০ Å) এবং ৬৫% রাইবোসোমাল আরএনএ এবং ৩৫% রাইবোসোমাল প্রোটিন[২৭] দ্বারা গঠিত। প্রকৃত কোষের রাইবোসোমগুলির ব্যাস ২৫ থেকে ৩০ ন্যানোমিটার(২৫০-৩০০ Å) এর মধ্যে এবং এতে আর আরএনএ ও প্রোটিনের অনুপাত ১ এর কাছাকাছি।[২৮] ক্রিস্টালোগ্রাফি[২৯] করে দেখা গিয়েছে যে পলিপেপটাইড সংশ্লেষণের জন্য প্রতিক্রিয়া স্থানের কাছাকাছি কোনও রাইবোসোমাল প্রোটিন নেই। এ থেকে বোঝা যায় রাইবোসোমের প্রোটিন উপাদানগুলি পেপটাইড বন্ধন গঠনের অনুঘটকগুলিতে সরাসরি অংশগ্রহণ করে না, বরং এই প্রোটিনগুলি একটি ভারা হিসাবে কাজ করে যা প্রোটিন সংশ্লেষণ করার জন্য আর আরএনএ এর ক্ষমতা বাড়ায়। (দেখুন: রাইবোজাইম)।
চিত্র ৩: থার্মাস থার্মোফিলাস থেকে ৩০এস সাবইউনিটের আণবিক গঠন। প্রোটিনগুলি নীল রঙে এবং একক আরএনএ শৃঙ্খল বাদামী রঙে দেখানো হয়েছে।
আদিকোষী এবং প্রকৃত কোষী রাইবোসোমাল সাবইউনিটগুলি দেখতে বেশ একই রকম।[৩০]
রাইবোসোমাল সাবইউনিট এবং আর- আরএনএ এর খণ্ডগুলি বর্ণনা করতে ব্যবহৃত পরিমাপের একক হল ভেদবার্গ (Svedberg) একক। এর মাধ্যমে আকারের পরিবর্তে কেন্দ্রীভূতকরণে অবক্ষেপণের হারের একটি পরিমাপ করা হয়। উদাহরণস্বরূপ, ব্যাকটেরিয়ার ৭০এস রাইবোসোমগুলি ৫০এস এবং ৩০এস সাবইউনিট দিয়ে তৈরি।
আদিকোষে ৭০এস রাইবোসোম আছে, প্রতিটি একটি ছোট (৩০এস) এবং একটি বড় (৫০এস) সাবইউনিট নিয়ে গঠিত।উদাহরণস্বরূপ, ই-কোলাই , একটি ১৬এস আরএনএ সাবইউনিট (১৫৪০ নিউক্লিওটাইড সমন্বিত) যা ২১টি প্রোটিনের সাথে আবদ্ধ। বৃহৎ সাবইউনিট একটি ৫এস আরএনএ সাবইউনিট (১২০ নিউক্লিওটাইড), একটি ২৩এস আরএনএ উপইউনিট (২৯০০ নিউক্লিওটাইড) এবং ৩১টি প্রোটিন দ্বারা গঠিত।[৩০]
| রাইবোসোম | সাবইউনিট | আর আরএনএ | আর প্রোটিন |
|---|---|---|---|
| ৭০এস | ৫০এস | ২৩এস (২৯০৪ নিউক্লিওটাইড) | ৩১ |
| ৩০এস | ৫এস (১২০নিউক্লিওটাইড) | ২১ | |
| ১৬এস (১৫৪২নিউক্লিওটাইড) |
ই কোলাই রাইবোসোমে টি আরএনএ বাইন্ডিং সাইটগুলির জন্য অ্যাফিনিটি লেবেল এ এবং পি সাইট প্রোটিন সনাক্ত করার অনুমতি দেয় ।সম্ভবত পেপটাইডাইলট্রান্সফেরেজ কার্যকলাপের[৩১] সাথে যুক্ত;লেবেলযুক্ত প্রোটিনগুলি হল এল২৭, এল১৪, এল১৫, এল১৬, এল২। এল২৭ ডোনার সাইটে অবস্থিত। যেমনটি ই. কোলাটজ এবং এপি চের্নিলোফস্কি[৩২][৩৩] -এর গবেষণায় প্রমাণিত হয়েছে যে এস১ ও এস২১ প্রোটিন, ১৬এস রাইবোসোমাল আরএনএ-এর ৩′-শেষের সাথে যুক্ত অনুবাদের সূচনাতে জড়িত।[৩৪]
আর্কিয়াল রাইবোসোম
[সম্পাদনা]আর্কিয়াল রাইবোসোমগুলি ব্যাকটেরিয়াগুলির একই সাধারণ মাত্রা ভাগ করে, একটি ৭০S রাইবোসোম যা একটি ৫০এস বড় সাবইউনিট, একটি ৩০এস ছোট সাবইউনিট থেকে গঠিত এবং তিনটিআর আরএনএ শৃঙ্খল রয়েছে। যাইহোক, ক্রম স্তরে, তারা ব্যাকটেরিয়ার তুলনায় প্রকৃত কোষগুলির অনেক কাছাকাছি। ব্যাকটেরিয়ার সাথে তুলনা করা আর্কিয়ার প্রতিটি অতিরিক্ত রাইবোসোমাল প্রোটিনের একটি প্রকৃত কোষী প্রতিরূপ রয়েছে, যখন আর্কিয়া এবং ব্যাকটেরিয়ার মধ্যে এই ধরনের কোন সম্পর্ক প্রযোজ্য নয়।[৩৫][৩৬][৩৭]
প্রকৃত কোষী রাইবোসোম
[সম্পাদনা]প্রকৃত কোষের সাইটোসোলে ৮০এস রাইবোসোম থাকে, প্রতিটিতে একটি ছোট (৪০এস) এবং বড় (৬০এপ) সাবইউনিট থাকে। তাদের ৪০এস সাবইউনিটে একটি ১৮এস আরএনএ (১৯০০ নিউক্লিওটাইড) এবং ৩৩টি প্রোটিন রয়েছে।[৩৮] বৃহৎ সাবইউনিট একটি ৫এস আরএনএ (১২০টি নিউক্লিওটাইড), ২৮এস আরএনএ (৪৭০০টি নিউক্লিওটাইড), একটি ৫.৮এস আরএনএ (১৬০টি নিউক্লিওটাইড) সাবইউনিট এবং ৪৬টি প্রোটিন দ্বারা গঠিত।[৩০][৩৮][৩৯]
| রাইবোসোম | সাবইউনিট | আর আরএনএ | আর প্রোটিন |
|---|---|---|---|
| ৮০এস | ৬০এস | ২৮এস (৪৭১৮নিউক্লিওটাইড) | ৪৯ |
| ৫.৮এস (১৬০নিউক্লিওটাইড) | |||
| ৫এস (১২০ নিউক্লিওটাইড) | ৩৩ | ||
| ৪০এস | ১৮এস (১৮৭৪নিউক্লিওটাইড) |
১৯৭৭ সালে, চের্নিলোফস্কি গবেষণা প্রকাশ করেছিলেন যা ইঁদুরের যকৃতের রাইবোসোমগুলিতে টিআরএনএ-বাইন্ডিং সাইটগুলি সনাক্ত করতে অ্যাফিনিটি লেবেলিং ব্যবহার করেছিল। এল৩২/৩৩, এল৩৬, এল২১, এল২৩, এল২৮/২৯ এবং এল১৩ সহ বেশ কিছু প্রোটিন পেপটাইডিল ট্রান্সফারেজ কেন্দ্রে[৪০] বা তার কাছাকাছি হিসাবে জড়িত ছিল।
প্লাস্টোরাইবোসোম এবং মাইটোরাইবোসোম
[সম্পাদনা]প্রকৃত কোষে, রাইবোসোমগুলি মাইটোকন্ড্রিয়াতে (কখনও কখনও মাইটোরাইবোসোম বলা হয়) এবং ক্লোরোপ্লাস্টের মতো প্লাস্টিডে (যাকে প্লাস্টোরাইবোসোমও বলা হয়) উপস্থিত থাকে। তারা একটি ৭০S কণাতে প্রোটিনের সাথে একসাথে আবদ্ধ বড় এবং ছোট সাবইউনিট নিয়ে গঠিত। এই রাইবোসোমগুলি ব্যাকটেরিয়াগুলির অনুরূপ এবং এই অঙ্গাণুগুলি মিথোজীবী ব্যাকটেরিয়া[৩০] হিসাবে উদ্ভূত হয়েছে বলে মনে করা হয় । মাইটোক্রন্ড্রিয়ায় রাইবোসোমাল RNA-এর অনেকগুলি টুকরো ছোট করা হয়, এবং ৫S rRNA-এর ক্ষেত্রে, প্রাণী ও ছত্রাকের[৪১] অন্যান্য গঠন দ্বারা প্রতিস্থাপিত হয়। বিশেষ করে, লেইশম্যানিয়া ট্যারেন্টোলে মাইটোকন্ড্রিয়াল rRNA এর একটি সংক্ষিপ্ত সেট রয়েছে।[৪২] বিপরীতে, উদ্ভিদের মাইটোরিবোসোম আছে b ব্যাকটেরিয়ার তুলনায় অন্যান্য বর্ধিত rRNA এবং অতিরিক্ত প্রোটিন, বিশেষ করে, অনেক পেন্টাট্রিকোপেটাইড পুনরাবৃত্তি প্রোটিন।[৪৩]
ক্রিপ্টোমোনাড এবং ক্লোররাচনিওফাইট শৈবালের মধ্যে একটি নিউক্লিওমর্ফ থাকতে পারে যা একটি ভেস্টিজিয়াল প্রকৃত কোষী নিউক্লিয়াসের[৪৪] মতো। প্রকৃত কোষী ৮০S রাইবোসোম নিউক্লিওমর্ফ ধারণকারী বগিতে উপস্থিত থাকতে পারে।[৪৫]
পার্থক্য ব্যবহার করা
[সম্পাদনা]ব্যাকটেরিয়া এবং প্রকৃত কোষী রাইবোসোমের মধ্যে পার্থক্যগুলি ঔষধ তৈরিকারী রসায়নবিদদের দ্বারা অ্যান্টিবায়োটিক তৈরির জন্য ব্যবহার করা হয় যা সংক্রামিত ব্যক্তির কোষের ক্ষতি না করেই ব্যাকটেরিয়া সংক্রমণকে ধ্বংস করতে পারে। তাদের গঠনগত পার্থক্যের কারণে, ব্যাকটেরিয়া ৭০S রাইবোসোমগুলি এই অ্যান্টিবায়োটিকের জন্য ঝুঁকিপূর্ণ যেখানে ইউক্যারিওটিক ৮০S রাইবোসোমগুলি নয়।[৪৬] যদিও মাইটোকন্ড্রিয়াতে ব্যাকটেরিয়ার অনুরূপ রাইবোসোম থাকে, মাইটোকন্ড্রিয়া এই অ্যান্টিবায়োটিকের দ্বারা প্রভাবিত হয় না কারণ তারা একটা দ্বিস্তরী ঝিল্লি দ্বারা বেষ্টিত থাকে যা এই অ্যান্টিবায়োটিকগুলিকে সহজেই অঙ্গাণুর মধ্যে প্রবেশ করতে দেয় না। একটি উল্লেখযোগ্য উদাহরণ, তবে, অ্যান্টিনিওপ্লাস্টিক অ্যান্টিবায়োটিক ক্লোরামফেনিকল অন্তর্ভুক্ত করে, যা সফলভাবে ব্যাকটেরিয়া ৫০এস এবং প্রকৃত কোষী মাইটোকন্ড্রিয়াল ৫০এস রাইবোসোমকে বাধা দেয়। মাইটোকন্ড্রিয়ার একই ব্যাপারটি ক্লোরোপ্লাস্টের ক্ষেত্রে ঘটে না, যেখানে রাইবোসোমাল প্রোটিনে অ্যান্টিবায়োটিক প্রতিরোধের একটি বৈশিষ্ট্য যা জিন প্রকৌশলে চিহ্নিতকারী হিসাবে ব্যবহৃত হয়।[৪৭]
সাধারণ বৈশিষ্ট্য
[সম্পাদনা]বিভিন্ন রাইবোসোম একটি মূল কাঠামো ভাগ করে, যা আকারে বড় পার্থক্য থাকা সত্ত্বেও বেশ কিছু মিল আছে। আরএনএ-এর বেশিরভাগ অংশই বিভিন্ন তিন স্তরের কাঠামোগত মোটিফগুলিতে অত্যন্ত সংগঠিত, উদাহরণস্বরূপ সিউডোকনট যা সমাক্ষীয় স্ট্যাকিং প্রদর্শন করে। বৃহত্তর রাইবোসোমের অতিরিক্ত আরএনএ বেশ কিছু দীর্ঘ একটানা সন্নিবেশে থাকে,[৪৮] যাতে তারা মূল কাঠামোর বাইরে লুপ তৈরি করে তা ব্যাহত বা পরিবর্তন না করে। রাইবোসোমের সমস্ত অনুঘটক কার্যকলাপ RNA দ্বারা সঞ্চালিত হয়; প্রোটিন পৃষ্ঠের উপর থাকে এবং গঠন স্থিতিশীল বলে মনে হয়।[৩০]
উচ্চ-রেজোলিউশন কাঠামো
[সম্পাদনা]
পারমাণবিক রেজোলিউশনে রাইবোসোমের গঠন প্রদানকারী প্রথম কাগজপত্রগুলি প্রায় ২০০০ সালের শেষের দিকে প্রায় একই সাথে প্রকাশিত হয়েছিল। ৫০এস (বড় আদিকোষী) সাবইউনিটটি Haloarcula marismortui এবং ব্যাকটেরিয়া Deinococcus radiodurans এর গঠন থেকে নির্ধারণ করা হয়েছিল। ৩০এস সাবইউনিট থার্মাস থার্মোফিলাস থেকে নির্ধারিত হয়েছিল। এই কাঠামোগত গবেষণাটি ২০০৯ সালে রসায়নে নোবেল পুরস্কারে ভূষিত হয়েছিল। মে ২০০১-এ এই স্থানাঙ্কগুলি ৫.৫ Å রেজোলিউশনে সমগ্র টি থার্মোফিলাস ৭০S কণা পুনর্গঠনের জন্য ব্যবহার করা হয়েছিল। ২০০৫ সালের নভেম্বরে ইশারশিয়া কোলাই এর ৭০S রাইবোসোমের গঠন নিয়ে দুটি গবেষণাপত্র প্রকাশিত হয়েছিল। এক্স-রে ক্রিস্টালোগ্রাফি ব্যবহার করে একটি খালি রাইবোসোমের গঠন ৩.৫ Å রেজোলিউশনে নির্ধারণ করা হয়েছিল। [৪৯] তারপরে, দুই সপ্তাহ পরে, ক্রায়ো-ইলেক্ট্রন মাইক্রোস্কোপির উপর ভিত্তি করে একটি কাঠামো প্রকাশিত হয়েছিল, যা প্রোটিন-পরিবাহী চ্যানেলে একটি নতুন সংশ্লেষিত প্রোটিন স্ট্র্যান্ড পাস করার কাজে ১১-১৫ Å রেজোলিউশনে রাইবোসোমকে চিত্রিত করে। টিআরএনএ এবং এমআরএনএ অণুগুলির সাথে জটিল রাইবোসোমের প্রথম পারমাণবিক কাঠামো দুটি স্বাধীনভাবে ২.৮ Å এবং ৩.৭ Å এ এক্স-রে ক্রিস্টালোগ্রাফি ব্যবহার করে সমাধান করা হয়েছিল। এই কাঠামোগুলি একজনকে থার্মাস থার্মোফিলাস রাইবোসোমের সাথে mRNA এবং ক্লাসিক্যাল রাইবোসোমাল স্থানগুলিতে আবদ্ধ tRNA এর সাথে মিথস্ক্রিয়াগুলির বিশদ বিবরণ দেখতে দেয়। শাইন-ডালগার্নো সিকোয়েন্স ধারণকারী দীর্ঘ mRNA-এর সাথে রাইবোসোমের মিথস্ক্রিয়া ৪.৫-৫.৫ Å রেজোলিউশনে এর পরেই কল্পনা করা হয়েছিল।[৫০] ২০১১ সালে, এক ধরনের ঈস্ট Saccharomyces cerevisiae থেকে প্রকৃত কোষীদের ৮০S রাইবোসোমের প্রথম সম্পূর্ণ পারমাণবিক কাঠামো ক্রিস্টালোগ্রাফির মাধ্যমে পাওয়া গিয়েছিল। মডেলটি প্রকৃত কোষীদের -নির্দিষ্ট উপাদানগুলির গঠন এবং সর্বজনীনভাবে সংরক্ষিত মূলের সাথে তাদের মিথস্ক্রিয়া প্রকাশ করে। একই সময়ে, টেট্রাহাইমেনা থার্মোফিলায় একটি প্রকৃত কোষীদের ৪০S রাইবোসোমাল কাঠামোর সম্পূর্ণ মডেল প্রকাশিত হয়েছিল এবং ৪০S সাবইউনিটের গঠন বর্ণনা করা হয়েছিল । সেইসাথে সংশ্লেষণ শুরুর সময় eIF১ এর সাথে ৪০S সাবইউনিটের মিথস্ক্রিয়া সম্পর্কে অনেক কিছু বলা হয়েছিল।একইভাবে, প্রকৃত কোষী ৬০S সাবইউনিট গঠনটিও টেট্রাহাইমেনা থার্মোফিলা থেকে eIF৬[৫১] এর সাথে কমপ্লেক্সে নির্ধারিত হয়েছিল।
কার্যাবলী
[সম্পাদনা]রাইবোসোম হল ক্ষুদ্র ক্ষুদ্র কণা যার মধ্যে আরএনএ এবং সংশ্লিষ্ট প্রোটিন রয়েছে যা প্রোটিন সংশ্লেষণের জন্য কাজ করে। প্রোটিন কোষস্থ বিভিন্ন কার্যাবলী যেমন ক্ষতি মেরামত বা রাসায়নিক প্রক্রিয়া নির্দেশ করার জন্য প্রয়োজন হয়। রাইবোসোমগুলি সাইটোপ্লাজমের মধ্যে ভাসমান বা এন্ডোপ্লাজমিক রেটিকুলামের সাথে সংযুক্ত পাওয়া যায়। তাদের প্রধান কাজ হল জেনেটিক কোডকে অ্যামিনো অ্যাসিড সিকোয়েন্সে রূপান্তর করা এবং অ্যামিনো অ্যাসিডের মনোমার থেকে প্রোটিন পলিমার তৈরি করা।
রাইবোসোম দুটি অত্যন্ত গুরুত্বপূর্ণ জৈবিক প্রক্রিয়ায় অনুঘটক হিসেবে কাজ করে যার নাম পেপটাইডিল স্থানান্তর এবং পেপটাইডিল পানি বিশ্লেষণ। "PT কেন্দ্র প্রোটিন প্রসারণের সময় প্রোটিন বন্ধন তৈরির জন্য দায়ী"।[৫২]
সংক্ষেপে, রাইবোসোমের দুটি প্রধান কাজ রয়েছে: বার্তা পাঠোদ্ধার করা এবং পেপটাইড বন্ধন গঠন করা। এই দুটি ফাংশন রাইবোসোমাল সাবইউনিটে থাকে। প্রতিটি সাবইউনিট এক বা একাধিক রাইবোসোমাল আরএনএ এবং অনেকগুলি আর -প্রোটিন দিয়ে তৈরি। ছোট সাবইউনিট (ব্যাকটেরিয়া এবং আর্কিয়াতে ৩০এস, প্রকৃত কোষে ৪০S) ডিকোডিং ফাংশন রয়েছে, যেখানে বড় সাবইউনিট (ব্যাকটেরিয়া এবং আর্কিয়াতে ৫০এস, প্রকৃত কোষে ৬০S) পেপটাইড বন্ধন গঠনকে প্রভাবিত করে, যাকে পেপটাইডিল-ট্রান্সফারেজ কার্যকলাপ বলা হয়। ব্যাকটেরিয়া (এবং আর্কিয়াল) ছোট সাবইউনিটে ১৬S আর আরএনএ এবং ২১ আর-প্রোটিন (Escherichia coli) থাকে, যেখানে প্রকৃত কোষের ছোট সাবইউনিটে ১৮S আর আরএনএ এবং ৩২ আর-প্রোটিন থাকে (স্যাকারোমাইসেস সেরিভিসিয়া; যদিও প্রজাতির মধ্যে সংখ্যার ভিন্নতা দেখা যায়)। ব্যাকটেরিয়াল বৃহৎ সাবইউনিটে ৫S এবং ২৩S আর আরএনএ এবং ৩৪টি আর-প্রোটিন (E. coli), প্রকৃত কোষের বৃহৎ সাবইউনিটে রয়েছে ৫S, ৫.৮S এবং ২৫S/২৮S আর আরএনএ এবং ৪৬টি আর-প্রোটিন (উদাহরণ S. cerevisiae; এক্ষেত্রেও সঠিক সংখ্যা প্রজাতির মধ্যে পরিবর্তিত হয়)।[৫৩]
সংশ্লেষণ
[সম্পাদনা]রাইবোসোম হল প্রোটিন জৈব সংশ্লেষণের কারখানা, যেখানে এমআরএনএকে প্রোটিনে রূপান্তরিত করা হয়। এম আরএনএ-তে কোডনগুলির একটি সিরিজ রয়েছে যা প্রোটিন তৈরি করার জন্য রাইবোসোম দ্বারা ডিকোড করা হয়। একটি টেমপ্লেট হিসাবে এম আরএনএ কে ব্যবহার করে, রাইবোসোম এম আরএনএ এর প্রতিটি কোডন (৩ নিউক্লিওটাইড) অতিক্রম করে, এটিকে একটি অ্যামিনোঅ্যাসিল-টি আরএনএ দ্বারা প্রদত্ত উপযুক্ত অ্যামিনো অ্যাসিডের সাথে যুক্ত করে। অ্যামিনোঅ্যাসাইল টি আরএনএ এর এক প্রান্তে একটি পরিপূরক অ্যান্টিকোডন এবং অন্য প্রান্তে উপযুক্ত অ্যামিনো অ্যাসিড থাকে। উপযুক্ তটি আরএনএ -এর দ্রুত এবং সঠিক স্বীকৃতির জন্য, রাইবোসোম বৃহৎ গঠনমূলক পরিবর্তন (কনফরমেশনাল প্রুফরিডিং) ব্যবহার করে।[৫৪]
ছোট রাইবোসোমাল সাবইউনিট, সাধারণত প্রথম অ্যামিনো অ্যাসিড মেথিওনিন ধারণকারী একটি অ্যামিনোঅ্যাসিল-টিআরএনএ-তে আবদ্ধ, এমআরএনএ-তে একটি AUG কোডনের সাথে আবদ্ধ হয় এবং বড় রাইবোসোমাল সাবইউনিট নিয়োগ করে। রাইবোসোমে তিনটি আরএনএ বাইন্ডিং সাইট রয়েছে, মনোনীত A, P এবং E। A-সাইটটি একটি অ্যামিনো অ্যাসিল-টি আরএনএ বা পরিসমাপ্তি রিলিজ ফ্যাক্টরকে আবদ্ধ করে; পলি-পেপটাইড চেইন); এবং ই-সাইট একটি মুক্ত টিআরএনএ আবদ্ধ করে। [৫৫] প্রোটিন সংশ্লেষণ এম আরএনএ এর ৫' প্রান্তের কাছে একটি স্টার্ট কোডন AUG থেকে শুরু হয়। এম আরএনএ প্রথমে রাইবোসোমের P সাইটে আবদ্ধ হয়। রাইবোসোম আদিকোষে এমআরএনএর শাইন-ডালগারনো ক্রম এবং প্রকৃত কোষে কোজাক বক্স ব্যবহার করে স্টার্ট কোডনকে চিনতে পারে।
যদিও পেপটাইড বন্ধনের অনুঘটক একটি প্রোটন শাটল পদ্ধতিতে আরএনএ-এর P-সাইট অ্যাডিনোসিনের C২ হাইড্রক্সিলকে জড়িত করে, প্রোটিন সংশ্লেষণের অন্যান্য ধাপগুলি (যেমন ট্রান্সলোকেশন) প্রোটিন গঠনের পরিবর্তনের কারণে ঘটে। যেহেতু তাদের অনুঘটক কোর আরএনএ দিয়ে তৈরি, তাই রাইবোসোমগুলিকে "রাইবোজাইম" হিসাবে শ্রেণীবদ্ধ করা হয়,[৫৬] এবং ধারণা করা হয় যে তারা আরএনএ জগতের অবশিষ্টাংশ হতে পারে।[৫৭]
কোট্রান্সলেশনাল ভাঁজ
[সম্পাদনা]রাইবোসোম সক্রিয়ভাবে প্রোটিন ভাঁজ করায় অংশ নেয়।[৫৮] এইভাবে প্রাপ্ত গঠনগুলি সাধারণত প্রোটিনের রাসায়নিক পুনঃভাঁজের সময় প্রাপ্ত গঠনের সাথে অভিন্ন। তবে, সর্বশেষ উৎপাদিত পদার্থের গমন পথ ভিন্ন হতে পারে ।কিছু ক্ষেত্রে, রাইবোসোম কার্যকরী প্রোটিনের রূপ প্রাপ্তির জন্য অত্যন্ত গুরুত্বপূর্ণ। উদাহরণস্বরূপ, জটিলভাবে গিঁটযুক্ত প্রোটিনগুলির ভাঁজ করার সম্ভাব্য প্রক্রিয়াগুলির মধ্যে একটি রাইবোসোমের উপর নির্ভর করে যা সংযুক্ত লুপের মাধ্যমে চেইনকে ঠেলে দেয়।[৫৯]
সংশ্লেষণকারী-স্বাধীন অ্যামিনো অ্যাসিডের সংযোজন
[সম্পাদনা]একটি রাইবোসোমের মান নিয়ন্ত্রণ প্রোটিন Rqc২ উপস্থিতি এম আরএনএ -স্বাধীন প্রোটিন প্রসারণের সাথে যুক্ত। এই প্রসারণটি ক্যাট লেজের রাইবোসোমাল সংযোজনের (Rqc২ দ্বারা আনা tRNA এর মাধ্যমে) ফল: রাইবোসোমগুলি অ্যালানিন এবং থ্রোনিনের এলোমেলো, অনুবাদ-স্বাধীন ক্রম সহ একটি স্থবির প্রোটিনের সি-টার্মিনাসকে প্রসারিত করে।[৬০]
রাইবোসোমের অবস্থান
[সম্পাদনা]রাইবোসোমগুলিকে "মুক্ত" বা "ঝিল্লিবদ্ধ" হিসাবে শ্রেণীবদ্ধ করা হয়।
মুক্ত এবং ঝিল্লিবদ্ধ রাইবোসোমগুলির মধ্যে পার্থক্য শুধুমাত্র তাদের স্থানিক বন্টনের মধ্যে ; তাদের গঠন অভিন্ন । রাইবোসোম একটি মুক্ত বা ঝিল্লি-বাউন্ড অবস্থায় বিদ্যমান কিনা তা প্রোটিন সংশ্লেষিত হওয়ার উপর একটি ER- টার্গেটিং সিগন্যাল সিকোয়েন্সের উপস্থিতির উপর নির্ভর করে, তাই একটি পৃথক রাইবোসোম একটি প্রোটিন তৈরি করার সময় ঝিল্লিতে আবদ্ধ হতে পারে, কিন্তু আরেকটা প্রোটিন তৈরি করার সময় এটি কোষরসে মুক্ত অবস্থায় থাকে।
রাইবোসোমগুলিকে কখনও কখনও অঙ্গাণু হিসাবে উল্লেখ করা হয়, তবে অঙ্গাণু শব্দটির ব্যবহার প্রায়শই একটি ফসফোলিপিড ঝিল্লির অন্তর্ভুক্ত সাব-সেলুলার উপাদানগুলিকে বর্ণনা করার জন্য সীমাবদ্ধ থাকে, কিন্তু রাইবোসোমগুলি সেভাবে থাকে না। এই কারণে, রাইবোসোমগুলিকে কখনও কখনও "ঝিল্লি বিহীন অঙ্গাণু " হিসাবে বর্ণনা করা যেতে পারে।
মুক্ত রাইবোসোম
[সম্পাদনা]মুক্ত রাইবোসোমগুলি কোষরসের যে কোনও জায়গায় ঘুরতে পারে, তবে কোষের নিউক্লিয়াস এবং অন্যান্য অঙ্গাণুর বাইরে থাকে। মুক্ত রাইবোসোম থেকে গঠিত প্রোটিন কোর্সে মুক্তি পায় এবং কোষের ভেতরেই ব্যবহৃত হয়। যেহেতু সাইটোসল গ্লুটাথিয়নের উচ্চ ঘনত্ব ধারণ করে সেহেতু এটি একটি হ্রাসকারী পরিবেশ, ডাইসালফাইড বন্ধন ধারণকারী প্রোটিন, যা অক্সিডাইজড সিস্টাইন অবশিষ্টাংশ থেকে গঠিত হয়, এর মধ্যে উৎপাদিত হতে পারে না।
ঝিল্লিবদ্ধ রাইবোসোম
[সম্পাদনা]যখন একটি রাইবোসোম কিছু অঙ্গাণুতে প্রয়োজনীয় প্রোটিন সংশ্লেষণ করতে শুরু করে, তখন এই প্রোটিন তৈরি করা রাইবোসোম "ঝিল্লিবদ্ধ" হয়ে যেতে পারে। প্রকৃত কোষে এটি এন্ডোপ্লাজমিক জালিকার (ER) একটি অঞ্চলে ঘটে যাকে "অমসৃণ এন্ডোপ্লাজমিক জালিকা" বলা হয়। নতুন উৎপাদিত পলিপেপটাইড চেইনগুলি রাইবোসোমের মাধ্যমে আন্ডারটেকিং ভেক্টরিয়াল সংশ্লেষণ দ্বারা সরাসরি এন্ডোপ্লাজমিক জালিকাতে ঢোকানো হয় এবং তারপর নিঃসৃত পথের মাধ্যমে তাদের গন্তব্যে স্থানান্তরিত হয়। আবদ্ধ রাইবোসোমগুলি সাধারণত প্রোটিন তৈরি করে যা কোষ ঝিল্লির মধ্যে ব্যবহৃত হয় বা এক্সোসাইটোসিসের মাধ্যমে কোষ থেকে বেরিয়ে যায়।[৩০]
বায়োজেনেসিস
[সম্পাদনা]ব্যাকটেরিয়া কোষে, একাধিক রাইবোসোমাল জিন অপেরনের ট্রান্সক্রিপশনের মাধ্যমে রাইবোসোমগুলি সাইটোপ্লাজমে সংশ্লেষিত হয়। প্রকৃত কোষে প্রক্রিয়াটি কোষের সাইটোপ্লাজম এবং নিউক্লিওলাস (নিউক্লিয়াসের মধ্যে একটি অঞ্চল)উভয় স্থানেই ঘটে।এ সমাবেশ প্রক্রিয়ায় চারটি রাইবোসোমাল আরএনএ এর সংশ্লেষণ এবং প্রক্রিয়াকরণে ২০০ টিরও বেশি প্রোটিনের সমন্বিত ফাংশন জড়িত থাকে, সেইসাথে রাইবোসোমাল প্রোটিনের সাথে সেই আর আরএনএ গুলিকে যুক্ত করে।
উৎপত্তি
[সম্পাদনা]রাইবোসোম প্রথম একটি আরএনএ এর জগতে উদ্ভূত হতে পারে। এটি একটি স্ব-প্রতিলিপিকারী কমপ্লেক্স হিসাবে আবির্ভূত হয় যা পরবর্তীতে অ্যামিনো অ্যাসিড উপস্থিত হতে শুরু করলে এর মধ্যে প্রোটিন সংশ্লেষণ করার ক্ষমতা বিকশিত হয়।[৬১] গবেষণায় দেখা গেছে যে শুধুমাত্র আর আরএনএ দ্বারা নির্মিত প্রাচীন রাইবোসোমগুলি পেপটাইড বন্ধন সংশ্লেষণ করার ক্ষমতা তৈরি করতে পারে।[৬২][৬৩] উপরন্তু, প্রমাণগুলি দৃঢ়ভাবে প্রাচীন রাইবোসোমকে স্ব-প্রতিলিপিকারী কমপ্লেক্স হিসাবে নির্দেশ করে[৬৪], যেখানে রাইবোসোমের আর আরএনএ -এর তথ্যগত, কাঠামোগত এবং প্রভাবকীয় উদ্দেশ্য ছিল । কারণ এটি রাইবোসোমাল স্ব-প্রতিলিপির জন্য প্রয়োজনীয় টি আরএনএ এবং প্রোটিনের জন্য কোড করতে সক্ষম। ডিএনএ ছাড়া স্ব-প্রতিলিপিকারী আরএনএ জীবকে রাইবোসাইট (বা রাইবোসেল) বলা হয়।
যেহেতু অ্যামিনো অ্যাসিডগুলি ধীরে ধীরে প্রিবায়োটিক অবস্থার অধীনে আরএনএ বিশ্বে আবির্ভূত হয়, অনুঘটক আরএনএর সাথে তাদের মিথস্ক্রিয়া অনুঘটক আরএনএ অণুর কাজের পরিসর এবং কার্যকারিতা উভয়ই বাড়িয়ে তোলে।[৬৫][৬৬] এভাবে বিবর্তনের জন্য রাইবোসোমের চালিকাশক্তি একটি প্রাচীন স্ব-প্রতিলিপনকারী মেশিন থেকে বর্তমানের একটি প্রোটিন সংশ্লেষণ মূলক যন্ত্রে পরিণত করেছে। নির্বাচনী চাপ রাইবোসোমের স্ব-প্রতিলিপন প্রক্রিয়ায় প্রোটিনগুলিকে যেমন অন্তর্ভুক্ত করে, তেমনি তার প্রতিলিপনের সক্ষমতা বাড়িয়ে দেয়।[৬৭][৬৮]
বিভিন্ন রাইবোসোম
[সম্পাদনা]রাইবোসোমগুলি গঠনগত দিক থেকে প্রজাতির মধ্যে এমনকি একই কোষের মধ্যেও ভিন্ন ভিন্ন। যেমনটি একই প্রকৃত কোষের মধ্যকার সাইটোপ্লাজমিক এবং মাইটোকন্ড্রিয়া রাইবোসোমের ভেতর পার্থক্য দেখা যায় । কিছু গবেষক মনে করেন স্তন্যপায়ী প্রাণীদের মধ্যে রাইবোসোমাল প্রোটিনের গঠনের ভিন্নতা জিন নিয়ন্ত্রণের জন্য গুরুত্বপূর্ণ।(স্পেশালাইজড রাইবোসোম হাইপোথিসিস)। [৬৯][৭০] তবে এই অনুকল্প নিয়ে যথেষ্ট বিতর্ক রয়েছে এবং এ বিষয়টি নিয়ে গবেষণা চলছে।[৭১][৭২] রাইবোসোমের গঠনের ভিন্নতা প্রোটিন সংশ্লেষণ নিয়ন্ত্রণে জড়িত থাকে এমনটি প্রথম প্রস্তাব করেন বিজ্ঞানী ভিন্স মাউরো এবং জেরাল্ড এডেলম্যান।[৭৩] তারা রাইবোসোমের নিয়ন্ত্রণ কার্যাবলী ব্যাখ্যা করার জন্য রাইবোসোম ফিল্টার হাইপোথিসিস প্রস্তাব করেছিলেন। প্রমাণসমূহ দেখাচ্ছে বিভিন্ন কোষ জনসংখ্যার জন্য নির্দিষ্ট বিশেষ রাইবোসোম জিনের ট্রান্সলেশনে কীভাবে প্রভাব রাখে ।[৭০] কিছু রাইবোসোমাল প্রোটিন সাইটোসোলিক কপির[৭৪] সম্মিলিত কমপ্লেক্স থেকে বিনিময় করে যা নির্দেশ করে ইন ভিভো রাইবোসোমের গঠন সম্পূর্ণ নতুন রাইবোসোম সংশ্লেষ না করেই পরিবর্তন করা যেতে পারে।কিছু রাইবোসোমাল প্রোটিন সেলুলার জীবনের জন্য অত্যাবশ্যকীয় , কিছু ততটা গুরুত্বপূর্ণ নয়। [৭৫] উদীয়মান খামিরে, ১৪/৭৮ রাইবোসোমাল প্রোটিনগুলি বৃদ্ধির জন্য অপ্রয়োজনীয়, যেখানে মানুষের মধ্যে এটি কোষের উপর নির্ভর করে। ভিন্নধর্মীতার অন্যান্য রূপের মধ্যে রয়েছে রাইবোসোমাল প্রোটিনের সংশ্লেষণ-পরবর্তী পরিবর্তন যেমন অ্যাসিটাইলেশন, মিথিলেশন এবং ফসফোরাইলেশন।[৭৬] অ্যারাবিডোপসিস[৭৭][৭৮][৭৯][৮০] ভাইরাসের অভ্যন্তরীণ রাইবোসোম এন্ট্রি সাইট (IRESs) গঠনগতভাবে স্বতন্ত্র রাইবোসোম দ্বারা সংশ্লেষণের মধ্যস্থতা করতে পারে। উদাহরণস্বরূপ, খামির এবং স্তন্যপায়ীদের কোষে eS২৫ ছাড়া ৪০S রাইবোসোমাল ইউনিট CrPV IGR IRES গ্রহণ করতে অক্ষম।[৮১]
রাইবোসোমাল আরএনএ এর বিভিন্নতা কাঠামোগত ভারসাম্যে এবং কার্যাবলিতে গুরুত্বপূর্ণ ভূমিকা পালন করে এবং বেশিরভাগ mRNA এর পরিবর্তনগুলি অত্যন্ত সংরক্ষিত অঞ্চলে পাওয়া যায়।[৮২][৮৩] সবচেয়ে সাধারণ আর আরএনএর পরিবর্তনগুলি হল সিউডোরিডিলেশন এবং রাইবোজের ২’-O মিথিলেশন।[৮৪]
তথ্যসূত্র
[সম্পাদনা]- ↑ "George Emil Palade"। Wikipedia (ইংরেজি ভাষায়)। ২০২২-০২-১১।
- ↑ "Molecular machine"। Wikipedia (ইংরেজি ভাষায়)। ২০২১-১২-০৯।
- ↑ "Cell (biology)"। Wikipedia (ইংরেজি ভাষায়)। ২০২২-০৩-২৬।
- ↑ "Translation (biology)"। Wikipedia (ইংরেজি ভাষায়)। ২০২২-০৩-১৪।
- ↑ "Peptide"। Wikipedia (ইংরেজি ভাষায়)। ২০২২-০২-২১।
- ↑ "Messenger RNA"। Wikipedia (ইংরেজি ভাষায়)। ২০২২-০২-০৬।
- ↑ "Genetic code"। Wikipedia (ইংরেজি ভাষায়)। ২০২২-০৩-২৫।
- ↑ "Ribosomal RNA"। Wikipedia (ইংরেজি ভাষায়)। ২০২২-০৩-১৩।
- ↑ "Ribosomal protein"। Wikipedia (ইংরেজি ভাষায়)। ২০২২-০১-১৫।
- ↑ Nover, Lutz; Weiler, Elmar W. (২০০৮-০৪-০৯)। Allgemeine und molekulare Botanik (জার্মান ভাষায়)। Georg Thieme Verlag। আইএসবিএন 978-3-13-152791-2।
- ↑ ""Dynamic Remodeling Events Drive the Removal of the ITS2 Spacer Sequenc" by Salini Konikkat"। web.archive.org। ২০১৭-০৮-০৩। Archived from the original on ২০১৭-০৮-০৩। সংগ্রহের তারিখ ২০২২-০৩-২৭।
- ↑ de la Cruz, Jesus; Karbstein, Katrin; Woolford, John L. (২০১৫)। "Functions of Ribosomal Proteins in Assembly of Eukaryotic Ribosomes In Vivo"। Annual review of biochemistry। 84: 93–129। আইএসএসএন 0066-4154। ডিওআই:10.1146/annurev-biochem-060614-033917। পিএমআইডি 25706898। পিএমসি 4772166
 ।
।
- ↑ "DNA"। Wikipedia (ইংরেজি ভাষায়)। ২০২২-০৩-১৪।
- ↑ compiler., Miura, Kin'ichirō, 1931-2009, (১৯৭২)। Transfer RNA.। University Park Press। ওসিএলসি 682061515।
- ↑ "Transfer RNA"। Wikipedia (ইংরেজি ভাষায়)। ২০২২-০৩-১৯।
- ↑ "Protein folding"। Wikipedia (ইংরেজি ভাষায়)। ২০২২-০৩-০৭।
- ↑ "Macromolecular assembly"। Wikipedia (ইংরেজি ভাষায়)। ২০২২-০৩-১৭।
- ↑ "Ribonucleoprotein particle"। Wikipedia (ইংরেজি ভাষায়)। ২০২১-০৫-২৮।
- ↑ "translation / RNA translation | Learn Science at Scitable"। www.nature.com (ইংরেজি ভাষায়)। সংগ্রহের তারিখ ২০২২-০৩-৩০।
- ↑ Tirumalai, Madhan R.; Rivas, Mario; Tran, Quyen; Fox, George E. (২০২১-১২-১৫)। "The Peptidyl Transferase Center: a Window to the Past"। Microbiology and Molecular Biology Reviews। 85 (4)। আইএসএসএন 1092-2172। ডিওআই:10.1128/mmbr.00104-21। পিএমআইডি 34756086
|pmid=এর মান পরীক্ষা করুন (সাহায্য)। পিএমসি PMC8579967
|pmc=এর মান পরীক্ষা করুন (সাহায্য)। ২০২২-০৪-০৩ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২০২২-০৩-৩০। - ↑ Benne, Rob; Sloof, Paul (১৯৮৭-০১-০১)। "Evolution of the mitochondrial protein synthetic machinery"। Biosystems (ইংরেজি ভাষায়)। 21 (1): 51–68। আইএসএসএন 0303-2647। ডিওআই:10.1016/0303-2647(87)90006-2।
- ↑ "Ribosomes"। web.archive.org। ২০০৯-০৩-২০। Archived from the original on ২০০৯-০৩-২০। সংগ্রহের তারিখ ২০২২-০৩-৩০।
- ↑ Palade, George E. (১৯৫৫-০১-২৫)। "A SMALL PARTICULATE COMPONENT OF THE CYTOPLASM"। The Journal of Biophysical and Biochemical Cytology। 1 (1): 59–68। আইএসএসএন 0095-9901। পিএমআইডি 14381428। পিএমসি 2223592
 ।
।
- ↑ Biophysical Society. Symposium (1st : 1958 : Cambridge, Mass ); Roberts, Richard B. (Richard Brooke) (১৯৫৮)। Microsomal particles and protein synthesis; papers presented at the First Symposium of the Biophysical Society, at the Massachusetts Institute of Technology, Cambridge, February 5, 6, and 8, 1958। MBLWHOI Library। New York, Published on behalf of the Washington Academy of Sciences, Washington, D.C., by Pergamon Press।
- ↑ "The Nobel Prize in Physiology or Medicine 1974"। NobelPrize.org (ইংরেজি ভাষায়)। সংগ্রহের তারিখ ২০২২-০৩-৩০।
- ↑ "The Nobel Prize in Chemistry 2009"। NobelPrize.org (ইংরেজি ভাষায়)। সংগ্রহের তারিখ ২০২২-০৩-৩০।
- ↑ "Charles Kurland"। Wikipedia (ইংরেজি ভাষায়)। ২০২২-০৩-১০।
- ↑ Wilson, Daniel N.; Doudna Cate, Jamie H. (2012-5)। "The Structure and Function of the Eukaryotic Ribosome"। Cold Spring Harbor Perspectives in Biology। 4 (5): a011536। আইএসএসএন 1943-0264। ডিওআই:10.1101/cshperspect.a011536। পিএমআইডি 22550233। পিএমসি 3331703
 । এখানে তারিখের মান পরীক্ষা করুন:
। এখানে তারিখের মান পরীক্ষা করুন: |তারিখ=(সাহায্য) - ↑ "Wayback Machine" (পিডিএফ)। web.archive.org। Archived from the original on ২০২০-১১-৩০। সংগ্রহের তারিখ ২০২২-০৩-৩০।
- ↑ ক খ গ ঘ ঙ চ Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (২০০২)। "The Endoplasmic Reticulum"। Molecular Biology of the Cell. 4th edition (ইংরেজি ভাষায়)।
- ↑ Tirumalai, Madhan R.; Rivas, Mario; Tran, Quyen; Fox, George E. (২০২১-১২-১৫)। "The Peptidyl Transferase Center: a Window to the Past"। Microbiology and Molecular Biology Reviews। 85 (4)। আইএসএসএন 1092-2172। ডিওআই:10.1128/mmbr.00104-21। পিএমআইডি 34756086
|pmid=এর মান পরীক্ষা করুন (সাহায্য)। পিএমসি PMC8579967
|pmc=এর মান পরীক্ষা করুন (সাহায্য)। - ↑ Collatz, E.; Küchler, E.; Stöffler, G.; Czernilofsky, P. (১৯৭৬-০৪-০১)। "The site of reaction on ribosomal protein L27 with an affinity label derivative of tRNAmetf"। FEBS Letters। 63 (2): 283–286। আইএসএসএন 0014-5793। ডিওআই:10.1016/0014-5793(76)80112-3।
- ↑ Czernilofsky, Armin P.; Collatz, Ekkehard E.; Stöffler, Georg; Kuechler, Ernst (1974-01)। "Proteins at the tRNA Binding Sites of Escherichia coli Ribosomes"। Proceedings of the National Academy of Sciences of the United States of America। 71 (1): 230–234। আইএসএসএন 0027-8424। পিএমআইডি 4589893। এখানে তারিখের মান পরীক্ষা করুন:
|তারিখ=(সাহায্য) - ↑ Czernilofsky, A.P.; Kurland, C.G.; Stöffler, G. (১৯৭৫-১০-১৫)। "৩০এস Ribosomal proteins associated with the 3′-terminus of 16S RNA"। FEBS Letters। 58 (1-2): 281–284। আইএসএসএন 0014-5793। ডিওআই:10.1016/0014-5793(75)80279-1।
- ↑ Londei, Paola (২০২০-০৬-৩০)। "Archaeal Ribosomes"। eLS: 1–5। ডিওআই:10.1002/9780470015902.a0000293.pub3।
- ↑ Tirumalai, Madhan R.; Anane-Bediakoh, Daniela; Rajesh, Sidharth; Fox, George E.। "Net Charges of the Ribosomal Proteins of the S10 and spc Clusters of Halophiles Are Inversely Related to the Degree of Halotolerance"। Microbiology Spectrum। 9 (3): e01782–21। আইএসএসএন 2165-0497। ডিওআই:10.1128/spectrum.01782-21। পিএমআইডি 34908470
|pmid=এর মান পরীক্ষা করুন (সাহায্য)। পিএমসি 8672879
|pmc=এর মান পরীক্ষা করুন (সাহায্য)। - ↑ WANG, JIACHEN; DASGUPTA, INDRANI; FOX, GEORGE E. (২০০৯-০৪-২৮)। "Many nonuniversal archaeal ribosomal proteins are found in conserved gene clusters"। Archaea। 2 (4): 241–251। আইএসএসএন 1472-3646। পিএমআইডি 19478915। পিএমসি 2686390
 ।
।
- ↑ ক খ Ben-Shem, Adam; Garreau de Loubresse, Nicolas; Melnikov, Sergey; Jenner, Lasse; Yusupova, Gulnara; Yusupov, Marat (২০১১-১২-১৬)। "The Structure of the Eukaryotic Ribosome at 3.0 Å Resolution"। Science। 334 (6062): 1524–1529। আইএসএসএন 0036-8075। ডিওআই:10.1126/science.1212642।
- ↑ Klinge, Sebastian; Voigts-Hoffmann, Felix; Leibundgut, Marc; Arpagaus, Sofia; Ban, Nenad (২০১১-১১-১৮)। "Crystal Structure of the Eukaryotic 60S Ribosomal Subunit in Complex with Initiation Factor 6"। Science। 334 (6058): 941–948। আইএসএসএন 0036-8075। ডিওআই:10.1126/science.1211204।
- ↑ Czernilofsky, A. Peter; Collatz, Ekkehard; Gressner, Axel M.; Wool, Ira G.; Küchler, Ernst (১৯৭৭-০১-০১)। "Identification of the tRNA-binding sites on rat liver ribosomes by affinity labeling"। Molecular and General Genetics MGG (ইংরেজি ভাষায়)। 153 (3): 231–235। আইএসএসএন 1432-1874। ডিওআই:10.1007/BF00431588।
- ↑ Agrawal, Rajendra K.; Sharma, Manjuli R. (2012-12)। "Structural aspects of mitochondrial translational apparatus"। Current opinion in structural biology। 22 (6): 797–803। আইএসএসএন 0959-440X। ডিওআই:10.1016/j.sbi.2012.08.003। পিএমআইডি 22959417। পিএমসি 3513651
 । এখানে তারিখের মান পরীক্ষা করুন:
। এখানে তারিখের মান পরীক্ষা করুন: |তারিখ=(সাহায্য) - ↑ Sharma, Manjuli R.; Booth, Timothy M.; Simpson, Larry; Maslov, Dmitri A.; Agrawal, Rajendra K. (২০০৯-০৬-১৬)। "Structure of a mitochondrial ribosome with minimal RNA"। Proceedings of the National Academy of Sciences of the United States of America। 106 (24): 9637–9642। আইএসএসএন 0027-8424। ডিওআই:10.1073/pnas.0901631106। পিএমআইডি 19497863। পিএমসি 2700991
 ।
।
- ↑ Waltz, Florent; Nguyen, Tan-Trung; Arrivé, Mathilde; Bochler, Anthony; Chicher, Johana; Hammann, Philippe; Kuhn, Lauriane; Quadrado, Martine; Mireau, Hakim (2019-01)। "Small is big in Arabidopsis mitochondrial ribosome"। Nature Plants (ইংরেজি ভাষায়)। 5 (1): 106–117। আইএসএসএন 2055-0278। ডিওআই:10.1038/s41477-018-0339-y। এখানে তারিখের মান পরীক্ষা করুন:
|তারিখ=(সাহায্য) - ↑ Archibald, John M.; Lane, Christopher E. (২০০৯-০৯-০১)। "Going, Going, Not Quite Gone: Nucleomorphs as a Case Study in Nuclear Genome Reduction"। Journal of Heredity। 100 (5): 582–590। আইএসএসএন 0022-1503। ডিওআই:10.1093/jhered/esp055।
- ↑ "Specialized Internal Structures of Prokaryotes | Boundless Microbiology"। courses.lumenlearning.com। সংগ্রহের তারিখ ২০২২-০৩-৩০।
- ↑ Recht, M I; Douthwaite, S; Puglisi, J D (১৯৯৯-০৬-০১)। "Basis for prokaryotic specificity of action of aminoglycoside antibiotics."। The EMBO Journal। 18 (11): 3133–3138। আইএসএসএন 0261-4189। ডিওআই:10.1093/emboj/18.11.3133। পিএমআইডি 10357824। পিএমসি 1171394
 ।
।
- ↑ Newman, S. M.; Boynton, J. E.; Gillham, N. W.; Randolph-Anderson, B. L.; Johnson, A. M.; Harris, E. H. (1990-12)। "Transformation of Chloroplast Ribosomal RNA Genes in Chlamydomonas: Molecular and Genetic Characterization of Integration Events"। Genetics। 126 (4): 875–888। আইএসএসএন 0016-6731। পিএমআইডি 1981764। পিএমসি 1204285
 । এখানে তারিখের মান পরীক্ষা করুন:
। এখানে তারিখের মান পরীক্ষা করুন: |তারিখ=(সাহায্য) - ↑ Penev, Petar I; Fakhretaha-Aval, Sara; Patel, Vaishnavi J; Cannone, Jamie J; Gutell, Robin R; Petrov, Anton S; Williams, Loren Dean; Glass, Jennifer B (২০২০-০৮-১২)। "Supersized Ribosomal RNA Expansion Segments in Asgard Archaea"। Genome Biology and Evolution। 12 (10): 1694–1710। আইএসএসএন 1759-6653। ডিওআই:10.1093/gbe/evaa170। পিএমআইডি 32785681
|pmid=এর মান পরীক্ষা করুন (সাহায্য)। পিএমসি 7594248
|pmc=এর মান পরীক্ষা করুন (সাহায্য)। - ↑ Korostelev, Andrei; Trakhanov, Sergei; Laurberg, Martin; Noller, Harry F. (২০০৬-০৯-২২)। "Crystal Structure of a 70S Ribosome-tRNA Complex Reveals Functional Interactions and Rearrangements"। Cell (English ভাষায়)। 126 (6): 1065–1077। আইএসএসএন 0092-8674। ডিওআই:10.1016/j.cell.2006.08.032। পিএমআইডি 16962654।
- ↑ Yusupova, Gulnara; Jenner, Lasse; Rees, Bernard; Moras, Dino; Yusupov, Marat (২০০৬-১১-০১)। "Structural basis for messenger RNA movement on the ribosome"। Nature। 444: 391–394। আইএসএসএন 0028-0836। ডিওআই:10.1038/nature05281।
- ↑ Klinge, Sebastian; Voigts-Hoffmann, Felix; Leibundgut, Marc; Arpagaus, Sofia; Ban, Nenad (২০১১-১১-০১)। "Crystal Structure of the Eukaryotic 60S Ribosomal Subunit in Complex with Initiation Factor 6"। Science। 334: 941। আইএসএসএন 0036-8075। ডিওআই:10.1126/science.1211204।
- ↑ "Specialized Internal Structures of Prokaryotes | Boundless Microbiology"। courses.lumenlearning.com। সংগ্রহের তারিখ ২০২২-০৩-৩১।
- ↑ Lafontaine, Denis L. J.; Tollervey, David (2001-07)। "The function and synthesis of ribosomes"। Nature Reviews Molecular Cell Biology (ইংরেজি ভাষায়)। 2 (7): 514–520। আইএসএসএন 1471-0080। ডিওআই:10.1038/35080045। এখানে তারিখের মান পরীক্ষা করুন:
|তারিখ=(সাহায্য) - ↑ Savir, Yonatan; Tlusty, Tsvi (২০১৩-০৪-১১)। "The Ribosome as an Optimal Decoder: A Lesson in Molecular Recognition"। Cell (English ভাষায়)। 153 (2): 471–479। আইএসএসএন 0092-8674। ডিওআই:10.1016/j.cell.2013.03.032। পিএমআইডি 23582332।
- ↑ Korkmaz, Gürkan; Sanyal, Suparna (২০১৭-০৯-০৮)। "R213I mutation in release factor 2 (RF2) is one step forward for engineering an omnipotent release factor in bacteria Escherichia coli"। The Journal of Biological Chemistry। 292 (36): 15134–15142। আইএসএসএন 0021-9258। ডিওআই:10.1074/jbc.M117.785238। পিএমআইডি 28743745। পিএমসি 5592688
 ।
।
- ↑ Rodnina, Marina V.; Beringer, Malte; Wintermeyer, Wolfgang (২০০৭-০১-০১)। "How ribosomes make peptide bonds"। Trends in Biochemical Sciences (English ভাষায়)। 32 (1): 20–26। আইএসএসএন 0968-0004। ডিওআই:10.1016/j.tibs.2006.11.007। পিএমআইডি 17157507।
- ↑ Cech, Thomas R. (২০০০-০৮-১১)। "The Ribosome Is a Ribozyme"। Science। 289 (5481): 878–879। আইএসএসএন 0036-8075। ডিওআই:10.1126/science.289.5481.878।
- ↑ Banerjee, Debapriya; Sanyal, Suparna (২০১৪-১০-২৩)। "Protein Folding Activity of the Ribosome (PFAR) –– A Target for Antiprion Compounds"। Viruses। 6 (10): 3907–3924। আইএসএসএন 1999-4915। ডিওআই:10.3390/v6103907। পিএমআইডি 25341659। পিএমসি 4213570
 ।
।
- ↑ Dabrowski-Tumanski, Pawel; Piejko, Maciej; Niewieczerzal, Szymon; Stasiak, Andrzej; Sulkowska, Joanna I. (২০১৮-১২-১৩)। "Protein Knotting by Active Threading of Nascent Polypeptide Chain Exiting from the Ribosome Exit Channel"। The Journal of Physical Chemistry B। 122 (49): 11616–11625। আইএসএসএন 1520-6106। ডিওআই:10.1021/acs.jpcb.8b07634।
- ↑ Shen, Peter S.; Park, Joseph; Qin, Yidan; Li, Xueming; Parsawar, Krishna; Larson, Matthew H.; Cox, James; Cheng, Yifan; Lambowitz, Alan M. (২০১৫-০১-০২)। "Rqc2p and 60S ribosomal subunits mediate mRNA-independent elongation of nascent chains"। Science (New York, N.Y.)। 347 (6217): 75–78। আইএসএসএন 0036-8075। ডিওআই:10.1126/science.1259724। পিএমআইডি 25554787। পিএমসি 4451101
 ।
।
- ↑ Noller, Harry F. (2012-4)। "Evolution of Protein Synthesis from an RNA World"। Cold Spring Harbor Perspectives in Biology। 4 (4): a003681। আইএসএসএন 1943-0264। ডিওআই:10.1101/cshperspect.a003681। পিএমআইডি 20610545। পিএমসি 3312679
 । এখানে তারিখের মান পরীক্ষা করুন:
। এখানে তারিখের মান পরীক্ষা করুন: |তারিখ=(সাহায্য) - ↑ Noller, Harry F.; Hoffarth, Vernita; Zimniak, Ludwika (১৯৯২-০৬-০১)। "Unusual Resistance of Peptidyl Transferase to Protein Extraction Procedures"। Science। 256: 1416–1419। আইএসএসএন 0036-8075। ডিওআই:10.1126/science.1604315।
- ↑ Nomura, M.; Mizushima, S.; Ozaki, M.; Traub, P.; Lowry, C. V. (১৯৬৯-০১-০১)। "Structure and Function of Ribosomes and Their Molecular Components"। Cold Spring Harbor Symposia on Quantitative Biology (ইংরেজি ভাষায়)। 34: 49–61। আইএসএসএন 0091-7451। ডিওআই:10.1101/SQB.1969.034.01.009। পিএমআইডি 4909519।
- ↑ Root-Bernstein, Meredith; Root-Bernstein, Robert (২০১৫-০২-২১)। "The ribosome as a missing link in the evolution of life"। Journal of Theoretical Biology (ইংরেজি ভাষায়)। 367: 130–158। আইএসএসএন 0022-5193। ডিওআই:10.1016/j.jtbi.2014.11.025।
- ↑ "Digital object identifier"। Wikipedia (ইংরেজি ভাষায়)। ২০২২-০৩-২৯।
- ↑ Saladino, Raffaele; Botta, Giorgia; Pino, Samanta; Costanzo, Giovanna; Mauro, Ernesto Di (২০১২-০৭-২৩)। "Genetics first or metabolism first? The formamide clue"। Chemical Society Reviews (ইংরেজি ভাষায়)। 41 (16): 5526–5565। আইএসএসএন 1460-4744। ডিওআই:10.1039/C2CS35066A।
- ↑ Fox, George E. (2010-9)। "Origin and Evolution of the Ribosome"। Cold Spring Harbor Perspectives in Biology। 2 (9): a003483। আইএসএসএন 1943-0264। ডিওআই:10.1101/cshperspect.a003483। পিএমআইডি 20534711। পিএমসি 2926754
 । এখানে তারিখের মান পরীক্ষা করুন:
। এখানে তারিখের মান পরীক্ষা করুন: |তারিখ=(সাহায্য) - ↑ Hernández, Greco; Jagus, Rosemary, সম্পাদকগণ (২০১৬)। "Evolution of the Protein Synthesis Machinery and Its Regulation" (ইংরেজি ভাষায়)। ডিওআই:10.1007/978-3-319-39468-8।
- ↑ Shi, Zhen; Fujii, Kotaro; Kovary, Kyle M.; Genuth, Naomi R.; Röst, Hannes L.; Teruel, Mary N.; Barna, Maria (২০১৭-০৭-০৬)। "Heterogeneous ribosomes preferentially translate distinct subpools of mRNAs genome-wide"। Molecular cell। 67 (1): 71–83.e7। আইএসএসএন 1097-2765। ডিওআই:10.1016/j.molcel.2017.05.021। পিএমআইডি 28625553। পিএমসি 5548184
 । line feed character in
। line feed character in |শিরোনাম=at position 70 (সাহায্য) - ↑ ক খ Xue, Shifeng; Barna, Maria (২০১২-০৫-২৩)। "Specialized ribosomes: a new frontier in gene regulation and organismal biology"। Nature reviews. Molecular cell biology। 13 (6): 355–369। আইএসএসএন 1471-0072। ডিওআই:10.1038/nrm3359। পিএমআইডি 22617470। পিএমসি 4039366
 ।
।
- ↑ Ferretti, Max B.; Karbstein, Katrin (2019-5)। "Does functional specialization of ribosomes really exist?"। RNA। 25 (5): 521–538। আইএসএসএন 1355-8382। ডিওআই:10.1261/rna.069823.118। পিএমআইডি 30733326। পিএমসি 6467006
 । এখানে তারিখের মান পরীক্ষা করুন:
। এখানে তারিখের মান পরীক্ষা করুন: |তারিখ=(সাহায্য) - ↑ Farley-Barnes, Katherine I; Ogawa, Lisa M; Baserga, Susan J (2019-10)। "Ribosomopathies: old concepts, new controversies"। Trends in genetics : TIG। 35 (10): 754–767। আইএসএসএন 0168-9525। ডিওআই:10.1016/j.tig.2019.07.004। পিএমআইডি 31376929। পিএমসি 6852887
 । এখানে তারিখের মান পরীক্ষা করুন:
। এখানে তারিখের মান পরীক্ষা করুন: |তারিখ=(সাহায্য) - ↑ Mauro, Vincent P.; Edelman, Gerald M. (২০০২-০৯-১৭)। "The ribosome filter hypothesis"। Proceedings of the National Academy of Sciences of the United States of America। 99 (19): 12031–12036। আইএসএসএন 0027-8424। ডিওআই:10.1073/pnas.192442499। পিএমআইডি 12221294।
- ↑ Mathis, Andrew D.; Naylor, Bradley C.; Carson, Richard H.; Evans, Eric; Harwell, Justin; Knecht, Jared; Hexem, Eric; Peelor, Fredrick F.; Miller, Benjamin F. (2017-2)। "Mechanisms of In Vivo Ribosome Maintenance Change in Response to Nutrient Signals"। Molecular & Cellular Proteomics : MCP। 16 (2): 243–254। আইএসএসএন 1535-9476। ডিওআই:10.1074/mcp.M116.063255। পিএমআইডি 27932527। পিএমসি 5294211
 । এখানে তারিখের মান পরীক্ষা করুন:
। এখানে তারিখের মান পরীক্ষা করুন: |তারিখ=(সাহায্য) - ↑ Steffen, Kristan K.; McCormick, Mark A.; Pham, Kim M.; MacKay, Vivian L.; Delaney, Joe R.; Murakami, Christopher J.; Kaeberlein, Matt; Kennedy, Brian K. (2012-5)। "Ribosome Deficiency Protects Against ER Stress in Saccharomyces cerevisiae"। Genetics। 191 (1): 107–118। আইএসএসএন 0016-6731। ডিওআই:10.1534/genetics.111.136549। পিএমআইডি 22377630। পিএমসি 3338253
 । এখানে তারিখের মান পরীক্ষা করুন:
। এখানে তারিখের মান পরীক্ষা করুন: |তারিখ=(সাহায্য) - ↑ Lee, Sang-Won; Berger, Scott J.; Martinović, Suzana; Paša-Tolić, Ljiljana; Anderson, Gordon A.; Shen, Yufeng; Zhao, Rui; Smith, Richard D. (২০০২-০৪-৩০)। "Direct mass spectrometric analysis of intact proteins of the yeast large ribosomal subunit using capillary LC/FTICR"। Proceedings of the National Academy of Sciences of the United States of America। 99 (9): 5942–5947। আইএসএসএন 0027-8424। ডিওআই:10.1073/pnas.082119899। পিএমআইডি 11983894।
- ↑ Carroll, Adam J.; Heazlewood, Joshua L.; Ito, Jun; Millar, A. Harvey (২০০৮-০২-০১)। "Analysis of the Arabidopsis Cytosolic Ribosome Proteome Provides Detailed Insights into Its Components and Their Post-translational Modification *"। Molecular & Cellular Proteomics (English ভাষায়)। 7 (2): 347–369। আইএসএসএন 1535-9476। ডিওআই:10.1074/mcp.M700052-MCP200। পিএমআইডি 17934214।
- ↑ Odintsova, Tatyana I.; Müller, Eva-Christina; Ivanov, Anton V.; Egorov, Tsezi A.; Bienert, Ralf; Vladimirov, Serguei N.; Kostka, Susanne; Otto, Albrecht; Wittmann-Liebold, Brigitte (২০০৩-০৪-০১)। "Characterization and Analysis of Posttranslational Modifications of the Human Large Cytoplasmic Ribosomal Subunit Proteins by Mass Spectrometry and Edman Sequencing"। Journal of Protein Chemistry (ইংরেজি ভাষায়)। 22 (3): 249–258। আইএসএসএন 1573-4943। ডিওআই:10.1023/A:1025068419698।
- ↑ Yu, Yonghao; Ji, Hong; Doudna, Jennifer A.; Leary, Julie A. (2005-6)। "Mass spectrometric analysis of the human 40S ribosomal subunit: Native and HCV IRES-bound complexes"। Protein Science : A Publication of the Protein Society। 14 (6): 1438–1446। আইএসএসএন 0961-8368। ডিওআই:10.1110/ps.041293005। পিএমআইডি 15883184। পিএমসি 2253395
 । এখানে তারিখের মান পরীক্ষা করুন:
। এখানে তারিখের মান পরীক্ষা করুন: |তারিখ=(সাহায্য) - ↑ Zeidan, Quira; Wang, Zihao; De Maio, Antonio; Hart, Gerald W. (২০১০-০৬-১৫)। "O-GlcNAc Cycling Enzymes Associate with the Translational Machinery and Modify Core Ribosomal Proteins"। Molecular Biology of the Cell। 21 (12): 1922–1936। আইএসএসএন 1059-1524। ডিওআই:10.1091/mbc.E09-11-0941। পিএমআইডি 20410138। পিএমসি 2883937
 ।
।
- ↑ Landry, Dori M.; Hertz, Marla I.; Thompson, Sunnie R. (২০০৯-১২-০১)। "RPS25 is essential for translation initiation by the Dicistroviridae and hepatitis C viral IRESs"। Genes & Development। 23 (23): 2753–2764। আইএসএসএন 0890-9369। ডিওআই:10.1101/gad.1832209। পিএমআইডি 19952110। পিএমসি 2788332
 ।
।
- ↑ Decatur, Wayne A.; Fournier, Maurille J. (২০০২-০৭-০১)। "rRNA modifications and ribosome function"। Trends in Biochemical Sciences (English ভাষায়)। 27 (7): 344–351। আইএসএসএন 0968-0004। ডিওআই:10.1016/S0968-0004(02)02109-6। পিএমআইডি 12114023।
- ↑ Natchiar, S. Kundhavai; Myasnikov, Alexander G.; Kratzat, Hanna; Hazemann, Isabelle; Klaholz, Bruno P. (২০১৭-১১-০১)। "Visualization of chemical modifications in the human 80S ribosome structure"। Nature। 551: 472–477। আইএসএসএন 0028-0836। ডিওআই:10.1038/nature24482।
- ↑ Guo, Huili (২০১৮-০৭-০৯)। "Specialized ribosomes and the control of translation"। Biochemical Society Transactions। 46 (4): 855–869। আইএসএসএন 0300-5127। ডিওআই:10.1042/BST20160426।
