ভ্যানাডিয়াম টেট্রাক্লোরাইড
| |||
| নামসমূহ | |||
|---|---|---|---|
| ইউপ্যাক নামs
Vanadium tetrachloride
Vanadium(IV) chloride | |||
| শনাক্তকারী | |||
ত্রিমাত্রিক মডেল (জেমল)
|
|||
| কেমস্পাইডার | |||
| ইসিএইচএ ইনফোকার্ড | ১০০.০২৮.৬৯২ | ||
| ইসি-নম্বর |
| ||
পাবকেম CID
|
|||
| আরটিইসিএস নম্বর |
| ||
| ইউএনআইআই | |||
কম্পটক্স ড্যাশবোর্ড (EPA)
|
|||
| |||
| |||
| বৈশিষ্ট্য | |||
| VCl4 | |||
| আণবিক ভর | 192.75 g/mol | ||
| বর্ণ | bright red liquid, moisture sensitive | ||
| গন্ধ | pungent | ||
| ঘনত্ব | 1.816 g/cm3, liquid | ||
| গলনাঙ্ক | −২৪.৫ °সে (−১২.১ °ফা; ২৪৮.৭ K) | ||
| স্ফুটনাঙ্ক | ১৪৮ °সে (২৯৮ °ফা; ৪২১ K) | ||
| decomposes | |||
| দ্রাব্যতা | soluble in CH2Cl2 | ||
| বাষ্প চাপ | 7.9 Pa | ||
| +1130.0·10−6 cm3/mol | |||
| গঠন | |||
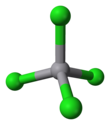
| Coordination geometry |
tetrahedral | ||
| ডায়াপল মুহূর্ত | 0 D | ||
| ঝুঁকি প্রবণতা | |||
| প্রধান ঝুঁকিসমূহ | toxic; oxidizer; hydrolyzes to release HCl | ||
| এনএফপিএ ৭০৪ | |||
| প্রাণঘাতী ডোজ বা একাগ্রতা (LD, LC): | |||
LD৫০ (মধ্যমা ডোজ)
|
160 mg/kg (rat, oral) | ||
| সম্পর্কিত যৌগ | |||
অন্যান্য অ্যানায়নসমূহ
|
ভ্যানাডিয়াম টেট্রাফ্লুরাইড, ভ্যানাডিয়াম ডাইসালফাইড, vanadium tetrabromide | ||
অন্যান্য ক্যাটায়নসমূহ
|
titanium tetrachloride, chromium tetrachloride, niobium tetrachloride, tantalum tetrachloride | ||
সম্পর্কিত যৌগ
|
vanadium trichloride | ||
সুনির্দিষ্টভাবে উল্লেখ করা ছাড়া, পদার্থসমূহের সকল তথ্য-উপাত্তসমূহ তাদের প্রমাণ অবস্থা (২৫ °সে (৭৭ °ফা), ১০০ kPa) অনুসারে দেওয়া হয়েছে। | |||
| তথ্যছক তথ্যসূত্র | |||
ভ্যানাডিয়াম টেট্রাক্লোরাইড হল অজৈব যৌগ যার সঙ্কেত VCl4। এই লালচে-বাদামী তরলটি অন্যান্য ভ্যানাডিয়াম যৌগ তৈরির জন্য একটি দরকারী বিকারক হিসাবে কাজ করে।
সংশ্লেষণ, বন্ধন, মৌলিক বৈশিষ্ট্য[সম্পাদনা]
ডায়ম্যাগনেটিক TiCl4 এর চেয়ে আরও একটি যোজ্যতা ইলেকট্রন সহ, VCl4 হল একটি প্যারাম্যাগনেটিক তরল। এটি কয়েকটি প্যারাম্যাগনেটিক যৌগের মধ্যে একটি যা কক্ষ তাপমাত্রায় তরল থাকে।
VCl4 ভ্যানাডিয়াম ধাতুর ক্লোরিনেশন দ্বারা প্রস্তুত করা হয়। এই বিক্রিয়ায় VCl5 গঠন করে না; VCl 4 আক্রমণ করার জন্য Cl2 এর অক্সিডাইজিং শক্তির অভাব রয়েছে। তবে VF5 থেকে −৭৮ °সে এ পরোক্ষভাবে VCl5 প্রস্তুত করা যেতে পারে. [১]
বিক্রিয়া[সম্পাদনা]
এর উচ্চ অক্সিডাইজিং শক্তির সাথে সামঞ্জস্যপূর্ণ, HBr-এর সাথে VCl4 -৫০°C এ বিক্রিয়া করে VBr3 তৈরি করে। বিক্রিয়াটি VBr এর মাধ্যমে এগিয়ে যায়, যা কক্ষ তাপমাত্রায় উষ্ণ হওয়ার সময় Br2 ত্যাগ করে। [২]
- 2VCl4 + 8HBr → 2VBr3 + 8HCl + Br2
VCl4 অনেক দাতা লিগ্যান্ডের সাথে যোগ করে, উদাহরণস্বরূপ, VCl4 (THF)2।
এটি ভ্যানাডোসিন ডাইক্লোরাইডের অগ্রদূত।
জৈব রসায়ন[সম্পাদনা]
জৈব সংশ্লেষণে, ফেনল এর অক্সিডেটিভ সংযোগের জন্য VCl4 ব্যবহৃত হয়। উদাহরণস্বরূপ, এটি ফেনলকে 4,4'-, 2,4'-, এবং 2,2'- বাইফেনলের মিশ্রণে রূপান্তরিত করে: [৩]
- 2C6H5OH + 2VCl4 → HOC6H4 –C6H4OH + 2VCl3 + 2HCl
ব্যবহার[সম্পাদনা]
VCl4 অ্যালকিনের পলিমারাইজেশনের জন্য একটি অনুঘটক, বিশেষ করে রাবার শিল্পে দরকারী। অন্তর্নিহিত প্রযুক্তিটি জিগলার-নাট্টা ক্যাটালাইসিসের সাথে সম্পর্কিত, যা ভ্যানাডিয়াম অ্যালকাইলের মধ্যস্থতায় জড়িত।
নিরাপত্তা বিবেচনা[সম্পাদনা]
VCl4 হল একটি উদ্বায়ী, আক্রমনাত্মক অক্সিডেন্ট যা HCl নির্গত করে সহজেই হাইড্রোলাইজ হয়।
তথ্যসূত্র[সম্পাদনা]
- ↑ Tamadon, Farhad; Seppelt, Konrad (২০১৩)। "The Elusive Halides VCl5, MoCl6, and ReCl6": 767–769। ডিওআই:10.1002/anie.201207552। পিএমআইডি 23172658।
- ↑ Calderazzo, F.; Maichle-Mössmer, C. (১৯৯৩)। "Low-temperature Syntheses of Vanadium(III) and Molybdenum(IV) Bromides by Halide Exchange": 655–8। ডিওআই:10.1039/DT9930000655।
- ↑ Encyclopedia of Reagents for Organic Synthesis।