সিজিয়াম সালফাইড
অবয়ব
| |
| নামসমূহ | |
|---|---|
| ইউপ্যাক নাম
সিজিয়াম সালফাইড
| |
| শনাক্তকারী | |
ত্রিমাত্রিক মডেল (জেমল)
|
|
| কেমস্পাইডার | |
| ইসি-নম্বর | |
পাবকেম CID
|
|
কম্পটক্স ড্যাশবোর্ড (EPA)
|
|
| |
| |
| বৈশিষ্ট্য | |
| Cs2S | |
| আণবিক ভর | ২৯৭.৮৭৬ |
| বর্ণ | সাদা স্ফটিক |
| ঘনত্ব | ৪.১৯ গ্রাম·সেমি−3[১] |
| গলনাঙ্ক | ৪৮০°সে[২] |
| আর্দ্রবিশ্লেষিত হয়ে সিজিয়াম বাইসালফাইড গঠন করে[৩] | |
| দ্রাব্যতা in ethanol and glycerol | দ্রবণীয় |
| গঠন | |
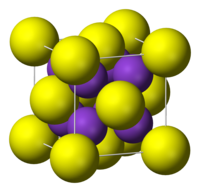
| স্ফটিক গঠন | ঘনাকার স্ফটিক, অ্যান্টি-ফ্লোরাইট |
| ঝুঁকি প্রবণতা | |
| প্রধান ঝুঁকিসমূহ | বিষাক্ত |
| জিএইচএস চিত্রলিপি |  
|
| জিএইচএস সাংকেতিক শব্দ | বিপদ |
| জিএইচএস বিপত্তি বিবৃতি | H314, H400 |
| জিএইচএস সতর্কতামূলক বিবৃতি | P260, P264, P273, P280, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P321, P363, P391, P405, P501 |
| সম্পর্কিত যৌগ | |
অন্যান্য অ্যানায়নসমূহ
|
সিজিয়াম অক্সিইড সিজিয়াম সেলেনাইড সিজিয়াম টেলুরাইড সিজিয়াম পোলনাইড |
অন্যান্য ক্যাটায়নসমূহ
|
লিথিয়াম সালফাইড সোডিয়াম সালফাইড পটাশিয়াম সালফাইড রুবিডিয়াম সালফাইড ফ্র্যান্সিয়াম সালফাইড |
সুনির্দিষ্টভাবে উল্লেখ করা ছাড়া, পদার্থসমূহের সকল তথ্য-উপাত্তসমূহ তাদের প্রমাণ অবস্থা (২৫ °সে (৭৭ °ফা), ১০০ kPa) অনুসারে দেওয়া হয়েছে। | |
| তথ্যছক তথ্যসূত্র | |
সিজিয়াম সালফাইড একটি অজৈব যৌগ যার রাসায়নিক সংকেত Cs2 S। এটি জলীয় দ্রবণে একটি শক্তিশালী ক্ষার। হাইড্রোজেন সালফাইডের মতো সিজিয়াম সালফাইডের বাষ্প বাতাসে থাকলে পচা ডিমের মতো গন্ধ পাওয়া যায়।
উৎপাদন
[সম্পাদনা]সোডিয়াম সালফাইডের মতো টেট্রাহাইড্রোফিউরান ইথার দ্রাবকের উপস্থিতিতে ধাতব সিজিয়াম এবং সালফার বিক্রিয়া করে অনার্দ্র সিজিয়াম সালফাইড তৈরি করা যেতে পারে। এইবিক্রিয়ায় অ্যামোনিয়া বা ন্যাপথলিনের প্রয়োজন হয়।[৪]
- 2Cs + S → Cs2S
অন্য একটি পদ্ধতিতে হাইড্রোজেন সালফাইডকে সিজিয়াম হাইড্রোক্সাইড দ্রবণে দ্রবীভূত করলে সিজিয়াম বাইসালফাইড তৈরি হয়। এরপর এটি সিজিয়াম সালফাইড তৈরি করে।[৫][৬]।
- CsOH + H2S → CsHS + H2O
- CsHS + CsOH → Cs2S + H2O
তথ্যসূত্র
[সম্পাদনা]- ↑ Sommer, Helmut; Hoppe, Rudolf. The crystal structure of cesium sulfide and a remark about cesium selenide, cesium telluride, rubidium selenide, and rubidium telluride (জার্মান ভাষায়). Zeitschrift für Anorganische und Allgemeine Chemie, 1977. 429: 118-30. আইএসএসএন 0044-2313
- ↑ Dale L. Perry, Sidney L. Phillips: Handbook of inorganic compounds. CRC Press, 1995, আইএসবিএন ৯৭৮-০-৮৪৯৩-৮৬৭১-৮, S. 336 (গুগল বইয়ে [১], পৃ. 336,).
- ↑ Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, আইএসবিএন ৯৭৮-৩-৫৪০৬-০০৩৫-০, S. 692 (গুগল বইয়ে [২], পৃ. 692,).
- ↑ J.-H. So and P. Boudjouk (১৯৯২)। "Hexamethyldisilathiane": 30–32। আইএসবিএন 9780470132609। ডিওআই:10.1002/9780470132609.ch11।
- ↑ Wilhelm Blitz, Ernst Wilke-Dörfurt: "Über Sulfide des Rubidiums und Cäsiums" in Zeitschr.
- ↑ R. Abegg, F. Auerbach: 'Handbuch der anorganischen Chemie'.
