লিথিয়াম সালফাইড

| |

| |
 | |
| নামসমূহ | |
|---|---|
| ইউপ্যাক নাম
লিথিয়াম হাইড্রোসালফাইড
| |
| পছন্দসই ইউপ্যাক নাম
লিথিয়াম সালফাইড | |
| শনাক্তকারী | |
ত্রিমাত্রিক মডেল (জেমল)
|
|
| কেমস্পাইডার | |
| ইসিএইচএ ইনফোকার্ড | ১০০.০৩২.০১৩ |
| ইসি-নম্বর |
|
পাবকেম CID
|
|
| আরটিইসিএস নম্বর |
|
| ইউএনআইআই | |
কম্পটক্স ড্যাশবোর্ড (EPA)
|
|
| |
| |
| বৈশিষ্ট্য | |
| Li2S | |
| আণবিক ভর | ৪৫.৯৫ গ্রাম/মোল |
| বর্ণ | সাদা কঠিন পদার্থ |
| ঘনত্ব | ১.৬৭ গ্রাম/সেমি৩ |
| গলনাঙ্ক | ৯৩৮ °সে (১,৭২০ °ফা; ১,২১১ K) |
| স্ফুটনাঙ্ক | ১,৩৭২ °সে (২,৫০২ °ফা; ১,৬৪৫ K) |
| খুব দ্রবণীয়, আর্দ্র বিশ্লেষিত হয়ে LiOH ও H2S | |
| দ্রাব্যতা | ইথানলে খুব দ্রবণীয় |
| গঠন | |
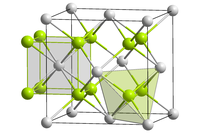
| স্ফটিক গঠন | Antifluorite (cubic), cF12 |
| Space group | Fm3m, No. 225 |
| Coordination geometry |
Tetrahedral (Li+); cubic (S2−) |
| তাপ রসায়নবিদ্যা | |
| স্ট্যন্ডার্ড মোলার এন্ট্রোফি এস |
৬৩ জুল/মোল কেলভিন |
| গঠনে প্রমান এনথ্যাল্পির পরিবর্তন ΔfH |
-৯.৪০১ কিলোজুল/গ্রাম অথবা -৪৭৭ kJ/mol |
| ঝুঁকি প্রবণতা | |
| নিরাপত্তা তথ্য শীট | External MSDS |
| এনএফপিএ ৭০৪ | |
| প্রাণঘাতী ডোজ বা একাগ্রতা (LD, LC): | |
LD৫০ (মধ্যমা ডোজ)
|
২৪০ মিলিগ্রাম/কেজি (oral, rat)[১] |
| সম্পর্কিত যৌগ | |
অন্যান্য অ্যানায়নসমূহ
|
লিথিয়াম অক্সাইড লিথিয়াম সেলেনাইড লিথিয়াম টেলুরাইড লিথিয়াম পোলোনাইড |
অন্যান্য ক্যাটায়নসমূহ
|
সোডিয়াম সালফাইড পটাশিয়াম সালফাইড রুবিডিয়াম সালফাইড সিজিয়াম সালফাইড |
সম্পর্কিত যৌগ
|
লিথিয়াম হাইড্রোসালফাইড |
সুনির্দিষ্টভাবে উল্লেখ করা ছাড়া, পদার্থসমূহের সকল তথ্য-উপাত্তসমূহ তাদের প্রমাণ অবস্থা (২৫ °সে (৭৭ °ফা), ১০০ kPa) অনুসারে দেওয়া হয়েছে। | |
| তথ্যছক তথ্যসূত্র | |
লিথিয়াম সালফাইড একটি অজৈব যৌগ যার রাসায়নিক সংকেত Li2S। এটি একটি কঠিন হলুদ-সাদা রঙের জলগ্রাহী গুঁড়ো পদার্থ। বাতাসের সংস্পর্শে এটি সহজেই আর্দ্র বিশ্লেষিত হয়ে পচা ডিমের গন্ধযুক্ত হাইড্রোজেন সালফাইড গ্যাস মুক্ত করে। [২]
প্রস্তুতি[সম্পাদনা]
লিথিয়াম সঙ্গে সালফার অর্থাৎ গন্ধকের বিক্রিয়া করে লিথিয়াম সালফাইড প্রস্তুত করা হয়। তবে এই বিক্রিয়াটি জলবিহীন অ্যামোনিয়া অর্থাৎ অ্যানহাইড্রাস অ্যামোনিয়ায় করা সুবিধাজনক। [৩]
- 2 Li + S → Li2S
লিথিয়াম ট্রাইইথাইলবোরোহাইড্রাইডকে গন্ধক দিয়ে বিজারিত করে লিথিয়াম সালফাইড তৈরি করা যেতে পারে।[৪]
ব্যবহার[সম্পাদনা]
লিথিয়াম-সালফার ব্যাটারিতে লিথিয়াম সালফাইড ব্যবহার করা হয়।[৫]
তথ্যসূত্র[সম্পাদনা]
- ↑ http://chem.sis.nlm.nih.gov/chemidplus/rn/12136-58-2[অকার্যকর সংযোগ]
- ↑ Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. আইএসবিএন ০-৭৫০৬-৩৩৬৫-৪.
- ↑ Rankin, D. W. H. (১৯৭৪)। "Digermanyl Sulfide": 182–84। আইএসবিএন 978-0-470-13246-3। ডিওআই:10.1002/9780470132463.ch40।
- ↑ Gladysz, J. A.; Wong, V. K. (১৯৭৯)। "New Methodology for the Introduction of Sulfur into Organic Molecules. Synthesis of Anhydrous Dilithium Dulfide, Dilithium Disulfide and Lithium Thiolates by Lithium Triethylborohydride Reduction of Elemental Sulfur and Disulfides": 2329–2335। ডিওআই:10.1016/S0040-4020(01)93746-9।
- ↑ "Battery claims greater capacity than lithium ion"। Electronics Weekly। ১২ জুলাই ২০০৫। সংগ্রহের তারিখ ২০০৫-০৯-১৬।

