পারমাণবিক তত্ত্ব

পারমাণবিক তত্ত্ব বা পরমাণুবাদ হচ্ছে পদার্থের ধর্ম সম্পর্কিত একটি বৈজ্ঞানিক ধারণা। রসায়নশাস্ত্র ও পদার্থবিজ্ঞানের পরিভাষায়, মহাবিশ্বের প্রতিটি বস্তুই অতি ক্ষুদ্র কণা দ্বারা গঠিত। এই ক্ষুদ্র কণাকে পরমাণু নামকরণ করা। পরমাণু অর্থ পরম বা অতি ক্ষুদ্র অণু। পরমাণুবাদের ধারণা প্রাচীন গ্রীসে দার্শনিক মতবাদ হিসেবে আবির্ভূত হয়। পরবর্তীতে উনিশ শতকের প্রথমভাগে এই ধারণা বিজ্ঞানের মূল ধারায় প্রবেশ করে। বৈজ্ঞানিকগণ এই ধারণাকে পূর্ণতা দানে সক্ষম হন। পরমাণুর ইংরেজি প্রতিশব্দ “এটম” প্রাচীন গ্রিক বিশেষণ “এটমস” থেকে এসেছে যার অর্থ অবিভাজ্য, যাকে আর ভাগ করা যায় না।[১] ঊনবিংশ শতকের রসায়ণবিদগন পদার্থের এই অবিভাজ্য অংশকে Atom বা অবিভাজ্য নামে ডাকলেও পরবর্তীকালে বিংশ শতকে তড়িৎচুম্বকীয় পদ্ধতি, তেজস্ক্রিয় পদ্ধতি ইত্যাদির সাহায্যে প্রমাণিত হয় যে পরমাণুকে আরো ক্ষুদ্র ক্ষুদ্র অংশে বিভাজন করা যায়। নতুন এই ক্ষুদ্রাতিক্ষুদ্র অংশ ইলেকট্রন, প্রোটন, নিউট্রন নামে পরিচিতি লাভ করে। পরমাণুকে প্রাথমিকভাবে মৌলক পদার্থ বলা হয়। অন্যদিকে দুই বা ততোধিক পরমাণু পরস্পর সংযুক্ত হয়ে গঠিত যৌগকে যৌগিক পদার্থ বলা হয়।
ইতিহাস[সম্পাদনা]
দার্শনিক পরমাণুবাদ[সম্পাদনা]
মহাবিশ্ব অতি ক্ষুদ্র কণার সমন্বয়ে গঠিত। এটা অনেক পুরাতন ধারণা। গ্রীস এবং ভারতবর্ষের বিভিন্ন শাস্ত্রে এই ক্ষুদ্র বস্তুর কথা বলা হয়েছে। কিন্তু এই তত্ত্বের পিছনে দার্শনিক এবং তাত্ত্বিক ধারণাই প্রবল ছিলো, কোন প্রকার প্রমাণ বা পরীক্ষণ ছিলো না। তাই পরমাণুর গঠন এবং বৈশিষ্ট্য সম্পর্কে তাদের ধারণা ভুল ছিলো। সবাই এই তত্ত্ব বুঝতে সক্ষম হয় নাই। তবে পদার্থের প্রকৃতি বর্ণনা করার জন্য পরমাণুবাদই একমাত্র তত্ত্ব ছিলো। যা ১৯ শতকের প্রথম ভাগে বিজ্ঞানীরা গ্রহণ করে পরিমার্জন করেন।
প্রথম দৃষ্টান্তকেন্দ্রিক তত্ত্ব[সম্পাদনা]
উপপারমাণবিক কণার আবিষ্কার[সম্পাদনা]
নিউক্লিয়াস আবিষ্কার[সম্পাদনা]
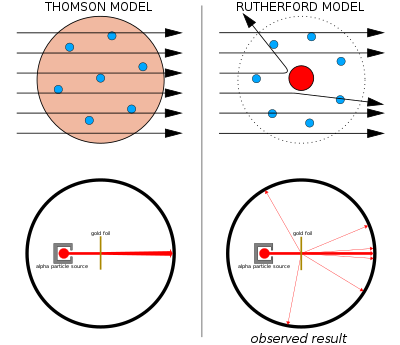
বামে: প্রত্যাশিত ফলাফল: পরমাণুর তরমুজ মডেলের মধ্য দিয়ে আলফা কণা নগণ্য বিচ্যুতিসহ প্রবাহিত হচ্ছে।
ডানে: পর্যবেক্ষণ ফলাফল: নিউক্লিয়াসের কেন্দ্রে ধনাত্বক আধানের কারণে কণাসমূহের একটি ছোট অংশের বিচ্যুতি ঘটছে।
১৯০৯ সালে থমসনের তরমুজ মডেলকে ভুল প্রমাণিত করেন তার সাবেক ছাত্র আর্নেস্ট রাদারফোর্ড। পরমাণুর কেন্দ্রস্থলে একটি ধনাত্মক আধানবিশিষ্ট ভারী বস্তু বিদ্যমান। এই ভারী বস্তুকে পরমাণুর কেন্দ্র বা নিউক্লিয়াস বলে। পরমাণুর মোট আয়তনের তুলনায় নিউক্লিয়াসের আয়তন অতি নগণ্য।
গেইগার-মার্সডেন পরীক্ষায় রাদারফোর্ডের দুই সহকর্মী বিজ্ঞানী হ্যান্স গেইগার এবং আর্নেস্ট মার্সডেন পাতলা ধাতব পাতের উপর আলফা কণা চালনা করেন এবং ফ্লুরোসেন্ট পর্দার সাহায্যে তাদের বিচ্যুতি পরিমাপ করেন।[২] পরমাণুর ক্ষুদ্র ভরের ইলেকট্রণের মধ্য দিয়ে আলফা কণা প্রবাহিত হয়ে যাচ্ছে। কিন্তু কেন্দ্র থেকে বিচ্যুত হচ্ছে। ইলেকট্রন ঋণাত্বক আধান বিশিষ্ট এবং আলফা কণা ধনাত্বক আধানবিশিষ্ট। এই পরীক্ষার মাধ্যমে রাদারফোর্ড এই সিদ্ধান্তে উপনীত হন যে পরমাণুর কেন্দ্র ধনাত্বক আধানবিশিষ্ট।
এই পরীক্ষণের ভিত্তিতে বিজ্ঞানী রাদারফোর্ড পরমাণুর সৌর কাঠামো বা সোলার মডেল প্রকাশ করেন। এই মডেল অনুসারে পরমাণুর কেন্দ্রে অবস্থিত নিউক্লিয়াসের ধনাত্বক আধানকে ইলেকট্রনের মেঘ ঘিরে থাকে। যেমন সূর্যকে কেন্দ্র করে সৌরমন্ডলের গ্রহ নক্ষত্রগুলো আবর্তিত হয়।[৩]
পরমাণুর কোয়ান্টাম মডেলের পথে প্রথম পদক্ষেপ[সম্পাদনা]
পরমাণুর সৌর মডেলের দুটি সীমাবদ্ধতা ছিলো। সূর্যকে কেন্দ্র করে আবর্তিত গ্রহের মত ইলেকট্রন নিউক্লিয়াসকে কেন্দ্র করে আবর্তিত হচ্ছে। গ্রহ আধান নিরপেক্ষ হলেও ইলেকট্রন চার্জযুক্ত কণা। তড়িৎচুম্বকীয় তত্ত্বে লারমর ফর্মুলানুসারে কম্পনশীল চার্জিত বস্তুকণা সর্বদা আধান বিচ্ছুরণ করে। ঘুর্ণায়মান চার্জ বা আধান একসময় কমতে কমতে সর্পিলাকারে নিউক্লিয়াসের সাথে কয়েক সেকেন্ডের মধ্যেই মিলিত হয়ে যাবে। দ্বিতীয়ত সৌর মডেল উচ্চশক্তিসম্পন্ন পরমাণুর বিচ্ছুরণ স্পেকট্রাম এবং শোষণ স্পেকট্রাম ব্যাখ্যা করতে ব্যর্থ হয়।

কোয়ান্টাম তত্ত্ব বিশ শতকে পদার্থবিদ্যা চর্চায় যুগান্তকারী পরিবর্তন আনতে সক্ষম হয় যখন বিজ্ঞানী ম্যাক্স প্লাংক এবং আলবার্ট আইনস্টাইন মত প্রকাশ করেন যে আলোক শক্তি একটি নির্দিষ্ট পরিমানে শোষিত বা উদগিরিত হয় যা কোয়ান্টাম (একবচনে কোয়ান্টা) নামে পরিচিত। ১৯১৩ সালে নীলস বোর পরমাণুর বোর মডেলের সঙ্গে এই তত্ব একীভূত করেন। বোর মডেল অনুসারে ইলেক্ট্রন নিউক্লিয়াসকে কেন্দ্র করে নির্দিষ্ট কক্ষপথে নির্দিষ্ট কৌণিক ভরবেগ সহ আবর্তিত হয় এবং নিউক্লিয়াস থেকে ইলেকট্রনের দূরত্ব এর শক্তির সমানুপাতিক।[৪] এই মডেলানুসারে ইলেকট্রণ অবিরত শক্তি বিকিরণ করে না। এরা সহসা শক্তি বিকিরণ বা গ্রহণ করে এক কক্ষপথ থেকে অন্য কক্ষপথে লাফ দেয় যা কোয়ান্টাম লাফ (কোয়ান্টাম লিপ) নামে পরিচিত।[৪] শক্তি শোষন বা বিচ্ছুরণের ফলে স্পেকট্রাম বা বর্ণালী উৎপন্ন হয়। [৪]
বোর মডেল শতভাগ নির্ভুল ছিলোনা। এটা হাইড্রোজেনের বর্ণালি ব্যাখ্যা করতে সক্ষম হলেও বহুইলেকট্রনবিশিষ্ট পরমাণুর বর্ণালি ব্যাখ্যা করতে পারে না। অধুনা বর্ণালীগ্রাফী প্রযুক্তির (স্পেকট্রোগ্রাফিক টেকনোলজি) উন্নয়ন সাধন হওয়ায় হাইড্রোজেন বর্ণালীতে নতুন রেখার উদ্ভব হয়েছে যা বোর মডেল ব্যাখ্যা করতে পারে না। ১৯১৬ সালে আরনোল্ড সমারফিল্ড এই অতিরিক্ত রেখার ব্যাখ্যা দিতে বোর মডেলে উপবৃত্তাকার কক্ষপথ যুক্ত করেন। কিন্তু এই নতুন মডেল খুবই জটিল।
আইসোটোপ আবিষ্কার[সম্পাদনা]
আইসোটোপ হল একই মৌলিক পদার্থের ভিন্ন ভিন্ন পরমাণু যাদের পারমাণবিক সংখ্যা একই তবে নিউক্লিয়াসে নিউট্রনের সংখ্যা ভিন্ন। আইসোটপসমূহের পারমাণবিক সংখ্যা একই হলেও ভর সংখ্যা ভিন্ন। প্রোটনের সংখ্যা একই থাকায় আইসোটোপসমূহের রাসায়নিক ও ভৌত ধর্মে অনেক সাদৃশ্য বিদ্যমান। হাইড্রোজেনের আইসোটোপ তিনটি। প্রোটিয়াম, ডিউটেরিয়াম, টিট্রিয়াম। হাইড্রোজেনের পারমাণবিক সংখ্যা ১, তাই এই সকল আইসোটোপে নিউট্রনের সংখ্যা হল যথাক্রমে ২-১=১, ৩-১=২ এবং ৪-১=৩। সংক্ষেপে, আইসোটোপসমূহ ভিন্ন নিউট্রন সংখ্যা বিশিষ্ট একই পদার্থের পরমাণু। এদের প্রোটন ও ইলেকট্রন সংখ্যা একই।
পদার্থের তেজস্ক্রিয় ক্ষয় এর উপর পরীক্ষাকালীন সময়ে ১৯১৩ সালে তেজস্ক্রিয় রসায়ণবিদ ফ্রেডরিক সোড্ডে পর্যায় সারণীর একই স্থানে একাধিক মৌলের অবস্থান। আবিষ্কার করেন[৫] একই ধরনের বৈশিষ্ট্যবহনকারী পর্যায়সারণীতে একই স্থানদখলকারী এই কণাসমূহকে মার্গারেট টোড ‘“আইসোটোপ”’ নামকরণ করেন।
একই বছর জে জে থমসন একটি পরীক্ষা পরিচালনা করেন যেখানে চৌম্বকীয় ও তড়িৎ ক্ষেত্রের মধ্য দিয়ে নিয়ন আয়নের প্রবাহ পরিচালনা করেন যা অপর প্রান্তে একটি ফটোগ্রাফিক পাতে বাঁধা পায়।তিনি পাতে বাঁধাপ্রাপ্ত নিয়ন আলোর দুটি বিচ্যুতি দেখতে পান। থমসন এই সিদ্ধান্তে উপনিত হন যে এখানে উপস্থিত কিছু নিয়ন আয়নের ঘনত্ব আলাদা[৬] ১৯৩২ সালে নিউট্রন আবিষ্কারের পর একই মৌলের ভিন্ন ভর থাকার ব্যাখ্যা উদঘাটিত হয়।
নিউক্লিয়ীয় কণা আবিষ্কার[সম্পাদনা]
পরমাণুর কোয়ান্টাম মডেল[সম্পাদনা]
আরো পড়ুন[সম্পাদনা]
- বার্নাড পুলম্যান (১৯৯৮) The Atom in the History of Human Thought, অনুবাদকঃ এক্সেল রেইসিঙ্গার। অক্সফোর্ড বিশ্ববিদ্যালয় প্রেস।
- এরিক স্কেরিল (২০০৭) The Periodic Table, Its Story and Its Significance, অক্সফোর্ড বিশ্ববিদ্যালয় প্রেস, নিউইয়র্ক।
- চার্লস এডলফ উর্টজ (১৮৮১) The Atomic Theory, ড. এপেলটন এন্ড কোম্পানী, নিউইয়র্ক।
বহিঃসংযোগ[সম্পাদনা]
- পরমাণুবাদ লেখকঃ এস. মার্ক কোহেন
- পারমাণবিক তত্ত্ব - ইলেকট্রন এবং ইলেকট্রিসির ভিত্তিতে পারমাণবিক তত্ত্বের উপর বিশদ তথ্য আলোচনা।
উৎস[সম্পাদনা]
- ↑ Berryman, Sylvia, "Ancient Atomism", The Stanford Encyclopedia of Philosophy (Fall 2008 Edition), Edward N. Zalta (ed.), http://plato.stanford.edu/archives/fall2008/entries/atomism-ancient/
- ↑ Geiger, H (১৯১০)। "The Scattering of the α-Particles by Matter"। Proceedings of the Royal Society। A 83: 492–504।
- ↑ Rutherford, Ernest (১৯১১)। "The Scattering of α and β Particles by Matter and the Structure of the Atom" (পিডিএফ)। Philosophical Magazine। 21 (4): 669। ডিওআই:10.1080/14786435.2011.617037। বিবকোড:2012PMag...92..379R। ১৫ মে ২০১৯ তারিখে মূল (পিডিএফ) থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২৯ ডিসেম্বর ২০১৪।
- ↑ ক খ গ Bohr, Niels (১৯১৩)। "On the constitution of atoms and molecules" (পিডিএফ)। Philosophical Magazine। 26 (153): 476–502। ডিওআই:10.1080/14786441308634993। ৯ আগস্ট ২০১৭ তারিখে মূল (পিডিএফ) থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২৯ ডিসেম্বর ২০১৪।
- ↑ "ফ্রেডরিক সোড্ডে, রসায়নে নোবেল পুরস্কার ১৯২১"। নোবেল ফাউন্ডেশান। সংগ্রহের তারিখ ২০০৮-০১-১৮।
- ↑ Thomson, J.J. (১৯১৩)। "Rays of positive electricity"। Proceedings of the Royal Society। A 89 (607): 1–20। ডিওআই:10.1098/rspa.1913.0057। বিবকোড:1913RSPSA..89....1T। [as excerpted in Henry A. Boorse & Lloyd Motz, The World of the Atom, Vol. 1 (New York: Basic Books, 1966)]. Retrieved on August 29, 2007.
