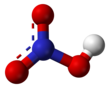
নাইট্রিক অ্যাসিড

| |||
| |||
| নামসমূহ | |||
|---|---|---|---|
| ইউপ্যাক নাম
নাইট্রিক অ্যাসিড
| |||
| অন্যান্য নাম
Aqua fortis, Spirit of niter, Eau forte, Hydrogen nitrate, Acidum nitricum
| |||
| শনাক্তকারী | |||
ত্রিমাত্রিক মডেল (জেমল)
|
|||
| থ্রিডিমেট | |||
| সিএইচইবিআই | |||
| সিএইচইএমবিএল | |||
| কেমস্পাইডার | |||
| ইসিএইচএ ইনফোকার্ড | ১০০.০২৮.৮৩২ | ||
| ইসি-নম্বর |
| ||
| মেলিন রেফারেন্স | 1576 | ||
| কেইজিজি | |||
| এমইএসএইচ | Nitric+acid | ||
পাবকেম CID
|
|||
| আরটিইসিএস নম্বর |
| ||
| ইউএনআইআই | |||
| ইউএন নম্বর | 2031 | ||
কম্পটক্স ড্যাশবোর্ড (EPA)
|
|||
| |||
| |||
| বৈশিষ্ট্য | |||
| HNO3 | |||
| আণবিক ভর | ৬৩.০১ g·mol−১ | ||
| বর্ণ | বর্ণহীন, হলুদ বা লাল ধূমায়মান তরল[১] | ||
| গন্ধ | কটু, শ্বাসরোধী[১] | ||
| ঘনত্ব | ১.৫১ গ্রাম সেমি−৩, ১.৪১ গ্রাম সেমি−৩ [68% w/w] | ||
| গলনাঙ্ক | −৪২ °সে (−৪৪ °ফা; ২৩১ K) | ||
| স্ফুটনাঙ্ক | ৮৩ °সে (১৮১ °ফা; ৩৫৬ K) ৬৮% দ্রবণের স্ফুটনাঙ্ক ১২১ °সে (২৫০ °ফা; ৩৯৪ K) | ||
| সম্পূর্ণ দ্রবণীয় | |||
| লগ পি | −0.13[২] | ||
| বাষ্প চাপ | 48 mmHg (20 °C)[১] | ||
| অম্লতা (pKa) | −1.4[৩] | ||
| অনুবন্ধী ক্ষারক | নাইট্রেট | ||
| −১.৯৯×১০−৫ cm3/mol | |||
| প্রতিসরাঙ্ক (nD) | 1.397 (16.5 °C) | ||
| ডায়াপল মুহূর্ত | 2.17 ± 0.02 D | ||
| তাপ রসায়নবিদ্যা | |||
| স্ট্যন্ডার্ড মোলার এন্ট্রোফি এস |
146 J·mol−1·K−1[৪] | ||
| গঠনে প্রমান এনথ্যাল্পির পরিবর্তন ΔfH |
−207 kJ·mol−1[৪] | ||
| ঝুঁকি প্রবণতা | |||
| নিরাপত্তা তথ্য শীট | ICSC 0183 | ||
| জিএইচএস চিত্রলিপি |  
| ||
| জিএইচএস সাংকেতিক শব্দ | বিপদজনক | ||
| জিএইচএস বিপত্তি বিবৃতি | H272, H300, H310, H330, H373, H411 | ||
| জিএইচএস সতর্কতামূলক বিবৃতি | P210, P220, P260, P305+351+338, P310, P370+378 | ||
| এনএফপিএ ৭০৪ | |||
| ফ্ল্যাশ পয়েন্ট | অদাহ্য | ||
| প্রাণঘাতী ডোজ বা একাগ্রতা (LD, LC): | |||
LC৫০ (মধ্যমা একাগ্রতা)
|
138 ppm (rat, 30 min)[১] | ||
| যুক্তরাষ্ট্রের স্বাস্থ্য অনাবৃতকরণ সীমা (NIOSH): | |||
PEL (অনুমোদনযোগ্য)
|
TWA 2 ppm (5 mg/m3)[১] | ||
REL (সুপারিশকৃত)
|
TWA 2 ppm (5 mg/m3) ST 4 ppm (10 mg/m3)[১] | ||
IDLH (তাৎক্ষণিক বিপদ
|
25 ppm[১] | ||
| সম্পর্কিত যৌগ | |||
অন্যান্য অ্যানায়নসমূহ
|
নাইট্রাস এসিড | ||
অন্যান্য ক্যাটায়নসমূহ
|
সোডিয়াম নাইট্রেট পটাশিয়াম নাইট্রেট অ্যামোনিয়াম নাইট্রেট | ||
সম্পর্কিত যৌগ
|
ডাইনাইট্রোজেন পেন্টক্সাইড | ||
সুনির্দিষ্টভাবে উল্লেখ করা ছাড়া, পদার্থসমূহের সকল তথ্য-উপাত্তসমূহ তাদের প্রমাণ অবস্থা (২৫ °সে (৭৭ °ফা), ১০০ kPa) অনুসারে দেওয়া হয়েছে। | |||
| তথ্যছক তথ্যসূত্র | |||
নাইট্রিক অ্যাসিড (HNO3), যা একুয়া ফর্টিস এবং স্পিরিট অফ নাইটার নামে পরিচিত, একটি ক্ষয়কারী খনিজ অ্যাসিড। যৌগটি বিশুদ্ধ অবস্থায় বর্ণহীন, পুরাতন এসিড হলুদাভ রঙ ধারণ করে কারণ এটা ভেঙে নাইট্রোজেনের অক্সাইড এবং পানি তৈরি করে। বাণিজ্যিক ভাবে উৎপন্ন নাইট্রিক এসিডের ঘনত্ব ৬৮%। যখন নাইট্রিক অ্যাসিডের ঘনত্ব ৮৬% এর বেশি হয় তখন একে "'ধূমায়িত নাইট্রিক অ্যাসিড "' বলে। নাইট্রোজেন ডাই অক্সাইডের উপস্থিতির ভিত্তিতে ধূমায়িত নাইট্রিক এসিড সাদা এবং লাল দুই ভাগে ভাগ করা হয়। ৯৫% এর বেশি ঘনত্বের নাইট্রিক এসিড নাইট্রেশান বিক্রিয়ার প্রধান রিএজেন্ট হিসেবে ব্যবহৃত হয়। নাইট্রিক অ্যাসিড সাধারণত দৃঢ় জারন উপাদান হিসেবে ব্যবহৃত হয়।
ইতিহাস
[সম্পাদনা]বিজ্ঞানী জাবির ইবনে হাইয়ান সর্ব প্রথম নাইট্রিক এসিড তৈরী করেন।
উৎপাদন
[সম্পাদনা]
নাইট্রোজেন অক্সাইডের (NO2) সাথে জলের বিক্রিয়ায় নাইট্রিক এসিড তৈরী হয়।
- 3 NO2 + H2O → 2 HNO3 + NO
সাধারণত এই বিক্রিয়ার মাধ্যমে উৎপাদিত নাইট্রিক অক্সাইড পুনরায় বাতাসের অক্সিজেন দ্বারা জারিত হয়ে নাইট্রোজেন ডাই অক্সাইড তৈরি করে।
হাইড্রোজেন পার অক্সাইড এর মধ্যে নাইট্রোজেন চালনা করলে এসিড উৎপন্ন হয়।
- 2 NO2 + H2O2 → 2 HNO3
বাণিজ্যিক নাইট্রিক এসিড দ্রবণে ৫২%-৬৮% নাইট্রিক এসিড থাকে। জার্মান রসায়নবিদ উইলহেলম অস্টওয়াল্ডের নামানুসারে নাইট্রিক এসিড উৎপাদন প্রক্রিয়াকে বলা হয় অস্টওয়াল্ড প্রক্রিয়া। এই প্রক্রিয়ায় অনাদ্র অ্যামোনিয়া প্লাটিনাম-রোডিয়াম সংকর প্রভাবকের এর উপস্থিতিতে ৫০০K তাপ ও ৯bar চাপে জারিতে হয়ে নাইট্রিক অক্সাইড তৈরি করে।
- 4 NH3 (g) + 5 O2 (g) → 4 NO (g) + 6 H2O (g) (ΔH = 905.2 kj)
হেবার পদ্ধতি তে উৎপাদিত শুষ্ক ও বিশুদ্ধ অ্যামোনিয়া প্রথমে উত্তপ্ত বাতাসের সাথে 1:7.5 আয়তনিক অনুপাতে মিশ্রিত হয় এই মিশ্রণকে ধূলিকণা মুক্ত করে উত্তপ্ত Pt-Rh তারজালি অনুঘটকের মধ্যে অতি দ্রুত পাঠালে ( সংস্পর্শ সময় = 1ms) অক্সিজেনের সাথে বিক্রিয়ায় অ্যামোনিয়া নাইট্রিক অক্সাইডে জারিত হয়।
- 2 NO (g) + O2 (g) → 2 NO2 (g) (ΔH = −114 kJ/mol)
এটা জলশোষণের দ্বারা নাইট্রিক এসিড ও নাইট্রিক অক্সাইড তৈরি করে।
- 3 NO2 (g) + H2O (l) → 2 HNO3 (aq) + NO (g) (ΔH = −117 kJ/mol)
নাইট্রিক অক্সাইড পুনরায় চক্রে ফিরে এসে নাইট্রিক এসিডে পরিণত হয়।
- 4 NO2 (g) + O2 (g) + 2 H2O (l) → 4 HNO3 (aq)
জলীয় HNO3 কে পাতনের মাধ্যমে গাঢ় নাইট্রিক এসিডে রূপান্তরিত করা যায়। গাঢ় H2SO4 এর সাথে জলবিয়োজনে ৯৮% গাঢ় নাইট্রিক এসিড পাওয়া যায়।
ব্যবহার
[সম্পাদনা]- সার কারখানায়।
- নাইট্রোগ্লিসারিন, TNT etc, বিস্ফোরক পদার্থ প্রস্তুতিতে।
- খনি হতে মূল্যবান ধাতু।
- সোনা আহরণে।
- রকেট জ্বালানিতে।
- বৈদ্যুতিক সেল তৈরিতে।
- সেলুলয়েড, কৃত্রিম রং, কৃত্রিম সিল্ক প্রস্তুতিতে।
তথ্যসূত্র
[সম্পাদনা]- ↑ ক খ গ ঘ ঙ চ ছ "NIOSH Pocket Guide to Chemical Hazards #0447" (ইংরেজি ভাষায়)। ন্যাশনাল ইনস্টিটিউট ফর অকুপেশনাল সেফটি অ্যান্ড হেলথ (NIOSH)।
- ↑ "nitric acid_msds"।
- ↑ Bell, R. P. (১৯৭৩), The Proton in Chemistry (2nd সংস্করণ), Ithaca, NY: Cornell University Press
- ↑ ক খ Zumdahl, Steven S. (২০০৯)। Chemical Principles 6th Ed.। Houghton Mifflin Company। পৃষ্ঠা A22। আইএসবিএন 978-0-618-94690-7।
বহিঃসংযোগ
[সম্পাদনা]- NIOSH Pocket Guide to Chemical Hazards
- National Pollutant Inventory – Nitric Acid Fact Sheet
- Calculators: surface tensions ওয়েব্যাক মেশিনে আর্কাইভকৃত ২২ ফেব্রুয়ারি ২০২০ তারিখে, and densities, molarities and molalities ওয়েব্যাক মেশিনে আর্কাইভকৃত ২২ ফেব্রুয়ারি ২০২০ তারিখে of aqueous nitric acid