অধিশোষণ
অধিশোষণ হল একটি পদার্থের তার সঙ্গে সংস্পর্শে থাকা অপর একটি পদার্থের অভ্যন্তরে প্রবেশ না করে উক্ত পদার্থের পৃষ্ঠতলে সঞ্চিত বা কেন্দ্রীভূত হওয়ার ঘটনা।
সাধারণত কঠিন পদার্থের পৃষ্ঠতলে গ্যাস বা কোনো দ্রবণে দ্রবীভূত দ্রাবের অধিশোষণ ঘটে। অন্যদিকে তরল পদার্থের পৃষ্ঠতলে কোনো গ্যাসের অধিশোষণ হয়ে থাকে।[১]

- অধিশোষক:যে পদার্থের পৃষ্ঠতলে অপর পদার্থের অধিশোষণ ঘটে তাকে অধিশোষক পদার্থ বলা হয়।যেমন-সক্রিয় চারকোল,সিলিকা জেল,বেন্টোনাইট ইত্যাদি।

- অধিশোষিত পদার্থ:অধিশোষক পদার্থের পৃষ্ঠতলে যে পদার্থের অধিশোষণ ঘটে তাকে অধিশোষিত পদার্থ বলা হয়।যেমন-অ্যামোনিয়া,হাইড্রোজেন,কার্বন ডাইঅক্সাইড,অক্সিজেন ইত্যাদি গ্যাসগুলি সক্রিয় চারকোল দ্বারা অধিশোষিত হয়।
অধিশোষণের কারণ
[সম্পাদনা]
অধিশোষণের কারণ হল অধিশোষকের পৃষ্ঠতলীয় কণাগুলির উপর ক্রিয়াশীল অসম বল।অধিশোষণ সম্পূর্ণরূপে পৃষ্ঠতলীয় ঘটনা,যা কঠিন বা তরল-এর পৃষ্ঠতলে সংঘটিত হয়।কঠিন বা তরল অধিশোষকের পৃষ্ঠতলে অবস্থিত কণাগুলির (কঠিনের ক্ষেত্রে অণু,পরমাণু বা আয়ন এবং তরলের ক্ষেত্রে অণু)শক্তিজনিত অবস্থা ওর অভ্যন্তরস্থ কণাগুলির শক্তিজনিত অবস্থা অপেক্ষা ভিন্ন হয়।অধিশোষকের অভ্যন্তরে অবস্থিত কোনো একটি কণা তার চতুর্দিকে একই রকমের কণা দ্বারা সমভাবে পরিবেষ্টিত থাকে এবং চতুর্দিক থেকে সমমানের আকর্ষণ বল ক্রিয়া করায় কণাটির উপর ক্রিয়াশীল লব্ধি বল শুন্য হয়।কিন্তু অধিশোষকের পৃষ্ঠতলে অবস্থানকারী কণার একটি দিকে প্রতিবেশী কণা না থাকায় উহা অপ্রতিসম বলের অধীনে থাকে।এজন্য কণাগুলির মুক্ত-শক্তিও বেশি হয়।মুক্ত-শক্তি কমানোর তাগিদেই অধিশোষকের পৃষ্ঠতলে অবস্থানকারী কণাগুলি অন্য পদার্থের অণু,পরমাণু বা আয়নকে অধিশোষিত করে।
অধিশোষণ প্রক্রিয়ায় সিস্টেমের মুক্ত-শক্তি,এনট্রপি এবং এনথ্যালপির পরিবর্তন
[সম্পাদনা]- গিবস মুক্ত-শক্তি-এর পরিবর্তন:স্থির চাপ ও উষ্ণতায় সংঘটিত স্বতঃস্ফূর্ত অধিশোষণ প্রক্রিয়ায় সিস্টেমের মুক্ত-শক্তির পরিবর্তন(ΔG)-এর মান ঋণাত্মক(-ve) হয়।
- এনট্রপি-এর পরিবর্তন:অধিশোষণ প্রক্রিয়ায় সিস্টেমের কণাগুলির বিশৃঙ্খলা তথা সিস্টেমের এনট্রপি হ্রাস পায়।অর্থাৎ সিস্টেমের ΔS-এর মান ঋণাত্মক হয়।
- এনথ্যালপি-এর পরিবর্তন:ΔG=ΔH-TΔS সম্পর্ক থেকে দেখা যায় যে ΔG ও ΔS উভয়ের মানই ঋণাত্মক হওয়ায় সিস্টেমের এনথ্যালপির পরিবর্তন ΔH-এর মানও ঋণাত্মক,অর্থাৎ অধিশোষণ একটি তাপদায়ী প্রক্রিয়া।[২]
লক্ষণীয়,অধিশোষণ সাম্যাবস্থায় সিস্টেমের ΔG-এর মান শুন্য হয়।
অধিশোষণের প্রকারভেদ
[সম্পাদনা]- ভৌত অধিশোষণ

যে অধিশোষণ প্রক্রিয়ায় অধিশোষিত পদার্থের কণাগুলি দুর্বল ভ্যান ডার ওয়ালস্ আকর্ষণ বল দ্বারা অধিশোষকের পৃষ্ঠতলে যুক্ত হয়,তাকে ভৌত অধিশোষণ বলে।[৩]
★বৈশিষ্ট্য:
- ভৌত অধিশোষণ পরাবর্ত প্রকৃতির হয়ে থাকে।
- অধিশোষকের পৃষ্ঠতলের ক্ষেত্রফল এবং সচ্ছিদ্রতা বৃদ্ধির সঙ্গে সঙ্গে ভৌত অধিশোষণের মাত্রাও বৃদ্ধি পায়।
- চাপ বাড়লে এই প্রকার অধিশোষণের হার বৃদ্ধি পায়।
- তাপমাত্রা বৃদ্ধি করলে এই প্রকার অধিশোষণের হার হ্রাস পায় (4-40 kJ/mol)।
- এই ধরনের অধিশোষণে সক্রিয়করণ শক্তি তথা উদ্ভূত তাপের পরিমাণ খুব কম হয়।
- ভৌত অধিশোষণে কঠিন অধিশোষকের পৃষ্ঠতলে গঠিত গ্যাসীয় স্তরের অণুগুলি ভ্যান ডার ওয়ালস্ বলের মাধ্যমে তাদের উপর অপর গ্যাসীয় অণু আবদ্ধ করতে পারে।এজন্য এক্ষেত্রে অধিশোষকের পৃষ্ঠতলে অধিশোষিত গ্যাসীয় পদার্থের অণুসমূহের বহু আণবিক স্তর (Multimilecular Layer) গঠিত হয়।
- রাসায়নিক অধিশোষণ

যে অধিশোষণ প্রক্রিয়ায় অধিশোষিত পদার্থের কণাগুলি রাসায়নিক বন্ধনের মাধ্যমে অধিশোষকের পৃষ্ঠতলে আবদ্ধ থাকে,তাকে রাসায়নিক অধিশোষণ বলে।[৩]
★বৈশিষ্ট্য:
- রাসায়নিক অধিশোষণ অপরাবর্ত প্রকৃতির হয়।
- অধিশোষকের পৃষ্ঠতলের ক্ষেত্রফল এবং সচ্ছিদ্রতা বৃদ্ধির সঙ্গে সঙ্গে রাসায়নিক অধিশোষণের মাত্রাও বৃদ্ধি পায়।
- চাপ বাড়লে এই প্রকার অধিশোষণের হার বৃদ্ধি পায়।
- তাপমাত্রা বৃদ্ধি করলে এই প্রকার অধিশোষণের হার বৃদ্ধি পায়।তবে অতি উচ্চ উষ্ণতায় অধিশোষণের মাত্রা ক্রমশঃ হ্রাস পেতে থাকে।
- এই ধরনের অধিশোষণে সক্রিয়করণ শক্তি তথা উদ্ভূত তাপের পরিমাণ বেশি হয় (40-200 kJ/mol)।
- ভৌত অধিশোষণে অধিশোষকের পৃষ্ঠতলে অধিশোষিত পদার্থের কণাগুলি রাসায়নিক বন্ধনের দ্বারা যুক্ত থাকে।এই বন্ধনে ক্রিয়াশীল বলের পাল্লা খুবই কম,আণবিক ব্যাসের কাছাকাছি।এজন্য অধিশোষিত পদার্থের কণাগুলি অধিশোষকের পৃষ্ঠতলে একটিমাত্র আণবিক স্তরেই (Unimolecular Layer) আবদ্ধ থাকে।
ফ্রয়েন্ডলিচের অধিশোষণ সমতাপীয়
[সম্পাদনা]স্থির উষ্ণতায় একক ভরের কোনো অধিশোষক দ্বারা অধিশোষণের পরিমাণ চাপের(গ্যাসের ক্ষেত্রে) বা গাঢ়ত্বের(দ্রবণের ক্ষেত্রে) উপর কীভাবে নির্ভরশীল,তা ব্যাখ্যা করতে বিজ্ঞানী ফ্রয়েন্ডলিচ তাঁর বিখ্যাত অধিশোষণ সমতাপীয় সূত্র এবং অধিশোষণ সমতাপীয় লেখচিত্র উদ্ভাবন করেন।
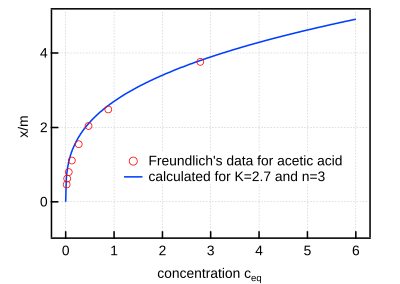
- গাণিতিক রূপ:কোনো অধিশোষকের একক ভরে অধিশোষণ মাত্রা x/m এবং চাপ p বা গাঢ়ত্ব c হলে,
অধিশোষণ সমচাপীয়
[সম্পাদনা]
তাপমাত্রাকে অনুভূমিক অক্ষ এবং প্রতি একক ভরের অধিশোষক দ্বারা অধিশোষিত পদার্থের পরিমাণকে উল্লম্ব অক্ষ বরাবর উপস্থাপিত করে অধিশোষণ সমচাপীয় লেখচিত্র অঙ্কন করা হয়।
যেহেতু দুর্বল ভ্যান ডার ওয়ালস্ বল ভৌত অধিশোষণের জন্য দায়ী এবং উষ্ণতা বৃদ্ধি পেলে অধিশোষক এবং অধিশোষিত পদার্থের কণাগুলির গতিশক্তির বৃদ্ধিজনিত কারণে ভ্যান ডার ওয়ালস্ বল ক্রমশঃ হ্রাস পায়, তাই উষ্ণতা বৃদ্ধিতে এই প্রকার অধিশোষণের হার কমে। এক্ষেত্রে অধিশোষণ সমচাপীয় লেখচিত্রটি হয় সমপরাবৃত্ত প্রকৃতির।
আবার, যেহেতু বিভিন্ন প্রকার রাসায়নিক বন্ধন রাসায়নিক অধিশোষণের জন্য দায়ী এবং উষ্ণতা বৃদ্ধি পেলে অধিশোষক ও অধিশোষিত পদার্থের কণাগুলির মধ্যে রাসায়নিক বন্ধন গঠনের পথ সুগম হয়, তাই উষ্ণতা বৃদ্ধিতে এই প্রকার অধিশোষণের হার প্রথমদিকে বৃদ্ধি পায়। তবে অতিরিক্ত উচ্চ তাপমাত্রায় কণাসমূহের গতিশক্তি বৃদ্ধিজনিত কারণে রাসায়নিক বন্ধন ক্রমশঃ দুর্বল হতে থাকে এবং রাসায়নিক অধিশোষণের হারও ক্রমশঃ হ্রাস পায়।[৫]
তথ্যসূত্র
[সম্পাদনা]- ↑ "absorption (chemistry)"। Memidex (WordNet) Dictionary/Thesaurus। ৫ অক্টোবর ২০১৮ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ 9 February,2019। এখানে তারিখের মান পরীক্ষা করুন:
|সংগ্রহের-তারিখ=(সাহায্য) - ↑ http://shodhganga.inflibnet.ac.in/jspui/bitstream/10603/69780/10/10_chapter%204.pdf
- ↑ ক খ https://old.iupac.org/reports/2001/colloid_2001/manual_of_s_and_t/node16.html
- ↑ Freundlich, Herbert. " Über die Adsorption in Lösungen." Zeitschrift für Physikalische Chemie - Stöchiometrie und Verwandschaftslehre (1907): Volume 57, Issue 4, pages 385-470.
- ↑ Chhaya Chemistry;Part:2 for HS Examination,WBJEE,JEE main,JEE advanced and other entrance examination
