বেরিলিয়াম আয়োডাইড
| |

| |

| |
| নামসমূহ | |
|---|---|
| পদ্ধতিগত ইউপ্যাক নাম
বেরিলিয়াম আয়োডাইড | |
| শনাক্তকারী | |
ত্রিমাত্রিক মডেল (জেমল)
|
|
| কেমস্পাইডার | |
| ইসিএইচএ ইনফোকার্ড | ১০০.০২৯.১৯৯ |
| ইসি-নম্বর | |
পাবকেম CID
|
|
| ইউএনআইআই | |
কম্পটক্স ড্যাশবোর্ড (EPA)
|
|
| |
| |
| বৈশিষ্ট্য | |
| BeI2 | |
| আণবিক ভর | ২৬২.৮২১ গ্রাম/মোল |
| বর্ণ | বর্ণহীন সূচালো স্ফটিক |
| ঘনত্ব | ৪.৩২৫ গ্রাম/সেমি৩ |
| গলনাঙ্ক | ৪৮০ °সে (৮৯৬ °ফা; ৭৫৩ K) |
| স্ফুটনাঙ্ক | ৫৯০ °সে (১,০৯৪ °ফা; ৮৬৩ K)[১] |
| জলের সঙ্গে বিক্রিয়া করে[১] | |
| দ্রাব্যতা | কার্বন ডাইসালফাইডে সামান্য দ্রবণীয় ইথানল, ডাইথাইল ইথারে দ্রবণীয়[২] |
| গঠন | |
| স্ফটিক গঠন | অর্থোরম্বিক |
| তাপ রসায়নবিদ্যা | |
| তাপ ধারকত্ব, C | ৭১.১৪ জুল/(মোল × কে) |
| স্ট্যন্ডার্ড মোলার এন্ট্রোফি এস |
১৩০ জুল/মোল K |
| গঠনে প্রমান এনথ্যাল্পির পরিবর্তন ΔfH |
-১৯২.৬২ কিলোজুল/মোল |
গিবসের মুক্ত শক্তি (ΔfG˚)
|
-২১০ কিলোজুল/মোল |
| দহনে প্রমান এনথ্যাল্পির পরিবর্তন ΔcH |
১৯ কিলোজুল/মোল |
| ঝুঁকি প্রবণতা | |
| প্রধান ঝুঁকিসমূহ | বেরিলিওসিস |
| এনএফপিএ ৭০৪ | |
| যুক্তরাষ্ট্রের স্বাস্থ্য অনাবৃতকরণ সীমা (NIOSH): | |
PEL (অনুমোদনযোগ্য)
|
TWA ০.০০২ mg/m3 C ০.০০৫ mg/m3 (৩০ মিনিট), এর সর্বোচ্চ শিখর ০.০২৫ mg/m3 (as Be)[৩] |
REL (সুপারিশকৃত)
|
Ca C ০.০০০৫ mg/m3 (as Be)[৩] |
IDLH (তাৎক্ষণিক বিপদ
|
Ca [৪ mg/m3 (as Be)][৩] |
| সম্পর্কিত যৌগ | |
অন্যান্য অ্যানায়নসমূহ
|
বেরিলিয়াম ফ্লোরাইড বেরিলিয়াম ক্লোরাইড বেরিলিয়াম ব্রোমাইড |
অন্যান্য ক্যাটায়নসমূহ
|
ম্যাগনেসিয়াম আয়োডাইড ক্যালসিয়াম আয়োডাইড স্ট্রনশিয়াম আয়োডাইড বেরিয়াম আয়োডাইড |
সুনির্দিষ্টভাবে উল্লেখ করা ছাড়া, পদার্থসমূহের সকল তথ্য-উপাত্তসমূহ তাদের প্রমাণ অবস্থা (২৫ °সে (৭৭ °ফা), ১০০ kPa) অনুসারে দেওয়া হয়েছে। | |
| তথ্যছক তথ্যসূত্র | |
বেরিলিয়াম আয়োডাইড একটি অজৈব যৌগ যার রাসায়নিক সংকেত BeI2 ।
প্রস্তুতি
[সম্পাদনা]৫০০ ডিগ্রি সেলসিয়াস থেকে ৭০০ ডিগ্রি সেলসিয়াস তাপমাত্রায় বেরিলিয়াম ধাতুর সাথে আয়োডিনের বিক্রিয়া করে বেরিলিয়াম আয়োডাইড প্রস্তুত করা যায়। বিক্রিয়াটি নিম্নরূপ:
- Be + I2 → BeI2
অন্য একটি পদ্ধতিতে গ্যাসীয় অবস্থায় হাইড্রোজেন আয়োডাইডের সাথে বেরিলিয়াম কার্বাইডের বিক্রিয়া করেও বেরিলিয়াম আয়োডাইড প্রস্তুত করা যায়। বিক্রিয়াটি নিম্নরূপ:
- Be2C + 4 HI → 2 BeI2 + CH4
ধর্ম
[সম্পাদনা]এটি একটি জলগ্রাহী সাদা রঙের কঠিন পদার্থ।
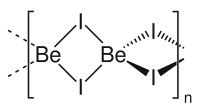
গঠন
[সম্পাদনা]বেরিলিয়াম আয়োডাইডের দুটি বহুরূপতা দেখা যায়। উভয়ের গঠনেই টেট্রাহেড্রাল। এতে Be2+ আয়নটি কেন্দ্রে থেকে আয়োডাইডের সঙ্গে আন্তঃসংযুক্ত হয়ে থাকে। একটি বহুরূপের গঠনে জিঙ্ক আয়োডাইডের গঠনের সাথে মিল রয়েছে। [৪]
বিক্রিয়া
[সম্পাদনা]বেরিলিয়াম আয়োডাইড ফ্লোরিন সঙ্গে বিক্রিয়া করে বেরিলিয়াম ফ্লোরাইড এবং আয়োডিন ফ্লোরাইড তৈরি করে। তেমনি আবার ক্লোরিনের সঙ্গে বিক্রিয়া করে বেরিলিয়াম ক্লোরাইড এবং ব্রোমিনের সঙ্গে বিক্রিয়া করে বেরিলিয়াম ব্রোমাইড উৎপন্ন হয়।
ব্যবহার
[সম্পাদনা]অতি বিশুদ্ধ বেরিলিয়াম তৈরি করতে বেরিলিয়াম আয়োডাইড ব্যবহার করা হয়। গরম টংস্টেন ফিলামেন্টের সাহায্যে যৌগটিকে ভেঙ্গে অতি বিশুদ্ধ বেরিলিয়াম তৈরি করা যেতে পারে।
তথ্যসূত্র
[সম্পাদনা]- ↑ ক খ Perry, Dale L.; Phillips, Sidney L. (১৯৯৫), Handbook of Inorganic Compounds, CRC Press, পৃষ্ঠা 63, আইএসবিএন 0-8493-8671-3, সংগ্রহের তারিখ ২০০৭-১২-১০
- ↑ Parsons, Charles Lathrop (১৯০৯), The Chemistry and Literature of Beryllium, Easton, Pa.: Chemical Publishing, পৃষ্ঠা 22–23, সংগ্রহের তারিখ ২০০৭-১২-১০
- ↑ ক খ গ "NIOSH Pocket Guide to Chemical Hazards #0054" (ইংরেজি ভাষায়)। ন্যাশনাল ইনস্টিটিউট ফর অকুপেশনাল সেফটি অ্যান্ড হেলথ (NIOSH)।
- ↑ Troyanov, S.I. (২০০০)। "Crystal Modifications of Beryllium Dihalides BeCl2, BeBr2 and BeI2": 1619-1624।

