আপেক্ষিক কোয়ান্টাম রসায়ন
আপেক্ষিক কোয়ান্টাম রসায়ন আপেক্ষিকতা ও কোয়ান্টাম রসায়নকে মিলিত করে, আর উত্তর দেয় বস্তুর ধর্ম এবং গঠন সংক্রান্ত প্রশ্নের, বিশেষ করে পর্যায় সারণির ভারী মৌলগুলোর ব্যাপারে। এর উৎকৃষ্ট উদাহরণ হতে পারে স্বর্ণের রং, আপেক্ষিকতার কারণে তা অন্য ধাতুর মত রুপালি হয়না।
আপেক্ষিকতা প্রভাব কথাটি কোয়ান্টাম মেকানিক্সের ইতিহাস থেকে নেয়া। প্রথমে কোয়ান্টাম মেকানিক্স আপেক্ষিকতা তত্ত্ব ছাড়াই গঠিত হয়।[১] সম্মিলিতভাবে আপেক্ষিক প্রভাব বলতে আপেক্ষিকতা ধরা বা না ধরার পার্থক্য নির্দেশ করে।[২] এই প্রভাব উচ্চ পারমাণবিক সংখ্যার মৌলের ক্ষেত্রে খুবই প্রয়োজনীয়। পর্যায় সারণির সবচেয়ে সাধারণ চিত্রে দেখা যায়, এসব মৌলকে নিচের দিকে স্থান দেয়া হয়েছে। উদাহরণ ল্যান্থানাইড ও এক্টিনাইড গ্রুপ।
রসায়নে আপেক্ষিকতা প্রভাব চাঞ্চল্য অথবা অনাপেক্ষিক তত্ত্বের ছোটখাট সংশোধন বলে ধরে নেয়া হয় (শ্রোডিঙার সমীকরণ থেকে পাওয়া সমাধান অনুযায়ী)। এসব সংশোধন ইলেকট্রনের উপর প্রভাব ফেলে যা আলোর বেগের সাপেক্ষে ইলেকট্রনের উপর নির্ভর করে। আপেক্ষিকতার প্রভাব ভারী পরমাণুর ক্ষেত্রে বেশি কার্যকর কারণ শুধু সেসব বস্তুতেই ইলেকট্রনের গতির ওরকম পার্থক্য ধরা পরে।
ইতিহাস[সম্পাদনা]
১৯৩৫ এর দিকে বার্থা সয়ার্লস নামে এক বিজ্ঞানী বহু ইলেকট্রন ব্যবস্থায় আপেক্ষিক প্রভাব দেখেন,[৩] ১৯২৯ সালে পল ডিরাকের বিবৃতি (কোয়ান্টাম মেকানিক্সের একমাত্র অপূর্ণতা) ছিল, "শুধুমাত্র উচ্চগতির কণা থাকলে তা সমস্যার জন্ম দেয়, এবং তাই এর পারমাণবিক লেভেল এবং আণবিক গঠনে এবং রাসায়নিক বিক্রিয়ায় প্রয়োজনীয় না, যা যথেষ্ট নির্ভুল হবে যদি ভর ও বেগের আপেক্ষিক পার্থক্য বাদ দেয়া হয় এবং শুধু ইলেকট্রন ও আণবিক নিউক্লেই এর মধ্যকার কুলম্ব বল মেনে নেয়।"[৪]
বিভিন্ন তাত্ত্বিক রসায়নবিদরা ১৯৭০ এর আগ পর্যন্ত ডিরাকের বিবৃতি মেনে নেয়, যতদিন না পর্যন্ত ভারী বস্তুতে আপেক্ষিক প্রভাব বুঝা যাচ্ছিল।[৫] স্রোডিঞ্জারের ১৯২৬ সালের রিপোর্টে আপেক্ষিকতা আমলে না নিয়েই শ্রোডিঙার সমীকরণ তৈরি হয়।[৬] আণবিক বর্ণালী বর্ণনা করার জন্যে স্রোডিঞ্জারের সমীকরনে আপেক্ষিকতা আনা হয়, কিন্তু এই উন্নতি রসায়নবিদদের ঠিক লাগেনি। যেহেতু আণবিক বর্ণালী লাইন পদার্থবিদ্যার অন্তর্গত ছিল, রসায়নে এর পরিচিতি অনেক স্বল্প ছিল। অনেক রসায়নবিদরাই আপেক্ষিক কোয়ান্টাম রসায়ন এর সাথে অপরিচিত ছিল, এবং তাদের নজর ছিল হালকা বস্তুর দিকে, বিশেষত জৈব রসায়ন এর জন্যে।[৭]
ডিরাকের বিবৃতির ফলে এমন অবস্থা হয় যে রাসায়নিক ব্যবস্থা দুটি কারণে ভুলঃ প্রথম হল s ও p শক্তিস্তরে ইলেকট্রন আলোর বেগের উল্লেখযোগ্য অংশের গতিতে ভ্রমণ করে এবং দ্বিতীয়টি হল আপেক্ষিক প্রভাবের পরোক্ষ ফল যা d ও f শক্তিস্তরের প্রমাণ দেয়।[৫]
গুণগত ব্যবস্থা[সম্পাদনা]
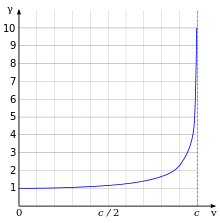
আপেক্ষিকতার অন্যতম প্রয়োজনীয় ও পরিচিত ফল হল ইলেকট্রনের আপেক্ষিক ভর বৃদ্ধি: যেখানে হল যথাক্রমে ইলেকট্রনের স্থিতিভর, ইলেকট্রনের বেগ ও আলোর বেগ। চিত্রে দেখানো হয়েছে বেগের ফাংশান হিসেবে ইলেকট্রনের ভরের আপেক্ষিক প্রভাব।
এর আবার বোরের ব্যাসার্ধ এর উপর তাৎক্ষণিক প্রভাব আছে যা নিম্নোক্তভাবে প্রকাশ করা হয়। যেখানে হল হ্রাসপ্রাপ্ত প্লাঙ্কের ধ্রুবক আর α হল সূক্ষ্ম-গঠন ধ্রুবক (বোরের মডেল এর আপেক্ষিক শুদ্ধিকরণ)।
আর্নল্ড সমারফেল্ড গণনা করেছিলেন যে হাইড্রোজেনের 1s এ কক্ষপথের ব্যাসার্ধ ০.০৫২৯ ন্যানোমিটার, α ≈১/১৩৭। তো বলা যায়, সূক্ষ্ম-গঠন ধ্রুবক দেখায় যে ইলেকট্রন আলোর গতির ১/১৩৭ গুণ বেগে ভ্রমণ করে।[৮] যে কেউ এটা বড় বস্তুর জন্য v ≈ Zc/১৩৭ (1s ইলেকট্রনের জন্য) সূত্র ব্যবহার করে বাড়াতে পারে, যেখানে v ইলেকট্রনের কৌণিক বেগ। স্বর্ণের জন্য (Z=৭৯) 1s ইলেকট্রনের বেগ হবে আলোর বেগের ৫৮%। একে আপেক্ষিক ভরের জন্যে v/c এ ব্যবহার করে mrel = ১.২২e পাওয়া যায়। এবং একে বোরের ব্যাসার্ধের জন্য ব্যবহার করে দেখা যায় ব্যাসার্ধ ২২% সংকুচিত হয়ে যায়।
এখন যদি বোরের ব্যাসার্ধে আপেক্ষিক ভর ব্যবহার করা যায় তবে লিখা যায় যে,

যা থেকে আসবে, ঊপরে আপেক্ষিক ও অনাপেক্ষিক বোরের ব্যসার্ধের অনুপাতকে ইলেকট্রনের বেগের ফাংশান হিসেবে ব্যবহৃত হয়েছে। দেখা যায় আপেক্ষিক মডেল বেগ বাড়ার সাথে ব্যাসার্ধ কমার ব্যাপারটা দেখায়।
যখন কোয়ান্টাম পদ্ধতি ব্যবহার করে বোরের ব্যবস্থকে বিস্তৃত করা হয়, তখন বোরের ব্যাসার্ধ হয়, যেখানে হল প্রধান কোয়ান্টাম সংখ্যা এবং Z পারমাণবিক সংখ্যা। কোয়ান্টাম মেকানিক্স অনুযায়ী কৌণিক বেগ হল । একে উপরের সমীকরণে বসালে পাওয়া যায়, একে সাধারণভাবে লিখা যায়, একে বোরের ব্যাসার্ধের সূত্রে বসালে পাই, এখান থেকে দেখা যায় যে এর ক্ষুদ্র মানের ফলেও এর বৃহৎ মান পাওয়া যায়। এটা অনুমানের সাথে মিলে যায়ঃ যেসব ইলেকট্রনের উচ্চ প্রধান কোয়ান্টাম সংখ্যা আছে তাদের নিউক্লিয়াসের কাছাকাছি থাকার উচ্চ সম্ভাব্যতা ঘনত্ব আছে। উচ্চ চার্জের নিউক্লিয়াস উচ্চ গতির কারণ হবে। আর তার মানে তাদের আপেক্ষিক ভর বাড়বে, ফলে ইলেকট্রন নিউক্লিয়াসের কাছে অধিক সময় ধরে থাকবে এবং ক্ষুদ্র প্রধান কোয়ান্টাম সংখ্যার জন্য ব্যাসার্ধ সংকুচিত করবে।[৯]
পর্যায় সারণি বিচ্যুতি[সম্পাদনা]
পর্যায় সারণি সেসব বিজ্ঞানীদের দ্বারা তৈরি হয় যারা কিছু পদার্থের মধ্যে পর্যাবৃত্ত ধর্ম দেখতে পান। প্রকৃতপক্ষে এই পর্যাবৃত্ততাই পর্যায় সারণিকে শক্তি যোগায়। ৫ম ও ৬ষ্ঠ পর্যায়ে রাসায়নিক ও শারীরিক পার্থক্য থেকে বৃহৎ আপেক্ষিক প্রভাব তৈরি হয়। সেটা স্বর্ণ, প্লাটিনাম ও মার্কারির আপেক্ষিক প্রভাব অপেক্ষাকৃত বিশাল হয়।
পারদ[সম্পাদনা]
পারদ ৩৯° তাপমাত্রায় তরল থাকে। পারদ-পারদ বন্ধন ক্যাডমিয়াম ও স্বর্ণের চেয়ে অনেক দুর্বল হয়। ল্যান্থানাইড সংকোচন একটি পার্শ্বীয় ব্যাখ্যা; যাই হোক এটি সম্পূর্ণভাবে দায়ী নয়। গ্যাসীয় দশায় তা ধাতুতে একাকী মনোমারিক অবস্থায় থাকে। Hg22+ ও তৈরী হয় এবং এটি একটি বন্ধনের আপেক্ষিক সংক্ষিপ্তকরণের স্থায়ী অবস্থা। Hg2(g) তৈরী হয়না কারণ 6s2 শক্তিস্তর আপেক্ষিক প্রভাব দ্বারা সংকুচিত এবং যেকোন বন্ধন এর সাথে দুর্বলভাবে বন্ধিত থাকে; আসলে মার্কারী-মার্কারী বন্ধন ভ্যানডার ওয়ালস বল দ্বারা বন্ধিত, যা বোঝায় কিজন্যে মার্কারী-মার্কারী বন্ধন দুর্বল হয় যার ফলে মার্কারী কক্ষ তাপমাত্রায় তরল হয়। Au2 ও Hg অনুরূপ, কমপক্ষে একই প্রকৃতির পার্থক্য থাকা। এর কারণ 6s2 কক্ষপথের আপেক্ষিক সংকোচন, যার ফলে গ্যাসীয় মার্কারী নকল আদর্শ গ্যাস বলা হয়।
স্বর্ণ ও সিজিয়ামের বর্ণ[সম্পাদনা]


Au, Ag ,Al এর প্রতিবিম্বন চিত্রে দেখানো হয়েছে। মানুষের চোখ ৬০০ ন্যানোমিটার তরঙ্গদৈর্ঘ্য পর্যন্ত আলো দেখতে পারে। প্রতিবিম্ব বর্ণালি থেকে এটা স্পষ্ট যে স্বর্ণ হলুদ দেখায় কারণ এটি অন্যান্য দৃশ্য তরঙ্গদৈর্ঘ্য থেক নীল বেশি শোষণ করে; যে প্রতিফলিত আলো চোখে পৌছায়, অতএব সংঘটিত আলো নীলের অনুপস্থিতি দেখায়। যেহেতু হলুদ নীলের পরিপূরক, তাই সাদা আলোয় স্বর্ণ হলুদ দেখায়।
এই শোষণের জন্য দায়ী 5d থেকে 6s এ রূপান্তরের এই তাড়িত রূপান্তর। Ag তে একটি অনুরূপ রূপান্তর ঘটে কিন্তু এতে আপেক্ষিক প্রভাব কম তাই যখন 4d সম্প্রসারিত হয় এবং 5s সংকুচিত হয়, Ag এ 4d-5s পার্থক্য Au এর চেয়ে অনেক বেশি হয় কারণ Ag আপেক্ষিক প্রভাব অপেক্ষাকৃত ছোট। এভাবে অয়াপেক্ষিক স্বর্ণ সাদা দেখায়। আপেক্ষিক প্রভাব 5d কক্ষপথ বাড়ায় ও 6s কক্ষপথ কমায়।[১০] একই প্রভাব দেখা যায় সিজিয়াম ধাতুর ক্ষেত্রে ( যা এলকালির মধ্যে সবচেয়ে ভারী)। তাই যেখানে অন্যান্য এলকালি রুপালী-সাদা, সিজিয়াম অনেকটাই সোনালী।
লেড এসিড ব্যাটারি[সম্পাদনা]
আপেক্ষিকতা ছাড়া, লেডকে টিনের মতোই মনে হত, আর তাই টিন-এসিড ব্যাটারি ও লেড-এসিড ব্যাটারি একই কাজ করত। যাই হোক, গণনা বলে লেড এসিড ব্যাটারির ১০-১২ ভোল্ট আপেক্ষিকতারই ফল, যা বর্ণনা করে টিন এসিড ব্যাটারি কেন কাজ করেনা।[১১]
নিষ্ক্রিয় জোড় প্রভাব[সম্পাদনা]
T(|), Pb(||) Bi(|||) বলে যে এর 6s2 ইলেকট্রন জোড় আছে। এর প্রভাব 6s কক্ষপথে আপেক্ষিক সংকোচনের ফলে ইলেকট্রন জোড়ের জারণ বাধা দেয়ার প্রবণতা তৈরি হয়।
অন্যান্য[সম্পাদনা]
কিছু ঘটনা যা আপেক্ষিক প্রভাব হিসেবে বলা হয়:
- অরোফিলিসিটি
- CsAu এ স্বর্ণের অ্যানায়নের স্থিতিশীলতা Au−
- সীসা এর স্ফটিক গঠন, যা ডায়মন্ড আকৃতির হওয়ার বদলে মুখ-কেন্দ্রিক কিউবিক হয়।
- জিরকোনিয়াম ও হাফনিয়াম এর মধ্যকার একচ্ছত্র মিল।
- প্রাথমিক এক্টিনাইড (Pa-Am) এর উচ্চ জারণ অবস্থার পাশাপাশি ইউরানাইল ক্যাটায়ন এর স্থিতিশীলতা
- ফ্র্যান্সিয়াম ও রেডিয়ামের ক্ষুদ্র পারমাণবিক ব্যাসার্ধ।
- ১০% এর মত ল্যান্থানাইড সংকোচন ইলেকট্রনের আপেক্ষিক ভর ও অপেক্ষাকৃত ক্ষুদ্র বোর ব্যাসার্ধের জন্য হয়।
- স্বর্ণের ক্ষেত্রে অপেক্ষাকৃত বৃহদাকার ইলেকট্রনের জন্য ১০% এর চেয়েও বেশি সংকোচন হয়, এবং স্বর্ণ সীসার চেয়ে দ্বিগুণ ঘন হয়।
তথ্যসূত্র[সম্পাদনা]
- ↑ Kleppner, Daniel (১৯৯৯)। "A short history of atomic physics in the twentieth century" (পিডিএফ)। Reviews of Modern Physics। 71 (2): S78। ডিওআই:10.1103/RevModPhys.71.S78। বিবকোড:1999RvMPS..71...78K। ৩ মার্চ ২০১৬ তারিখে মূল (পিডিএফ) থেকে আর্কাইভ করা। সংগ্রহের তারিখ ১২ মার্চ ২০১৮।
- ↑ Kaldor, U.; Wilson, Stephen (২০০৩)। Theoretical Chemistry and Physics of Heavy and Superheavy Elements। Dordrecht, Netherlands: Kluwer Academic Publishers। পৃষ্ঠা 4। আইএসবিএন 1-4020-1371-X।
- ↑ Swirles, B. (১৯৩৫)। "The Relativistic Self-Consistent Field"। Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences। 152 (877): 625। ডিওআই:10.1098/rspa.1935.0211। বিবকোড:1935RSPSA.152..625S।
- ↑ Dirac, P. A. M. (১৯২৯)। "Quantum Mechanics of Many-Electron Systems" (পিডিএফ)। Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences। 123 (792): 714। জেস্টোর 95222। ডিওআই:10.1098/rspa.1929.0094। বিবকোড:1929RSPSA.123..714D। ২৩ ডিসেম্বর ২০১৮ তারিখে মূল (free download pdf) থেকে আর্কাইভ করা। সংগ্রহের তারিখ ১৩ মার্চ ২০১৮।
- ↑ ক খ Pyykkö, Pekka (১৯৮৮)। "Relativistic effects in structural chemistry"। Chemical Reviews। 88 (3): 563। ডিওআই:10.1021/cr00085a006।
- ↑ Erwin Schrödinger, Annalen der Physik, (Leipzig) (1926), Main paper ওয়েব্যাক মেশিনে আর্কাইভকৃত ১৭ ডিসেম্বর ২০০৮ তারিখে
- ↑ Kaldor, U.; Wilson, Stephen, সম্পাদকগণ (২০০৩)। Theoretical Chemistry and Physics of Heavy and Superheavy Elements। Dordrecht, Netherlands: Kluwer Academic Publishers। আইএসবিএন 1-4020-1371-X।
- ↑ Norrby, Lars J. (১৯৯১)। "Why is mercury liquid? Or, why do relativistic effects not get into chemistry textbooks?"। Journal of Chemical Education। 68 (2): 110। ডিওআই:10.1021/ed068p110। বিবকোড:1991JChEd..68..110N।
- ↑ Pitzer, Kenneth S. (১৯৭৯)। "Relativistic effects on chemical properties"। Accounts of Chemical Research। 12 (8): 271। ডিওআই:10.1021/ar50140a001।
- ↑ Pyykkö, Pekka; Desclaux, Jean Paul (১৯৭৯)। "Relativity and the periodic system of elements"। Accounts of Chemical Research। 12 (8): 276। ডিওআই:10.1021/ar50140a002।
- ↑ Ahuja, Rajeev; Blomqvist, Anders; Larsson, Peter; Pyykkö, Pekka; Zaleski-Ejgierd, Patryk (২০১১)। "Relativity and the Lead-Acid Battery"। Physical Review Letters। 106: 018301। arXiv:1008.4872
 । ডিওআই:10.1103/PhysRevLett.106.018301। বিবকোড:2011PhRvL.106a8301A।
। ডিওআই:10.1103/PhysRevLett.106.018301। বিবকোড:2011PhRvL.106a8301A।


















