ক্লাউজিউস-ক্লাপেরোঁ সমীকরণ
রুডলফ ক্লাউজিউস[১] এবং ব্যনোয়া পোল এমিল ক্লাপেরোঁ-র[২] নামানুসারে ক্লাউজিউস-ক্লাপেরোঁ সম্পর্কটির নামকরণ করা হয়েছে, যা কোন পদার্থের দুটি দশার মধ্যে বিচ্ছিন্ন দশা রুপান্তরের একটি রূপকার হিসেবে কাজ করে।
এটি মূলত সাম্যাবস্থায় কোন পদার্থের দুটি দশার চাপ এবং তাপমাত্রাকে ব্যবকলনীয় সমীকরণের মাধ্যমে প্রকাশ করে।[৩]
সংজ্ঞা
[সম্পাদনা]চাপ বনাম তাপমাত্রা লেখচিত্রে যেই রেখা দুটি ভিন্ন দশাকে পৃথক করে তা সহাবস্থান লেখ হিসাবে পরিচিত। ক্লাউজিউস-ক্লাপেরোঁ সম্পর্ক মূলত কোন বিন্দুতে এই লেখের স্পর্শকের ঢাল নির্দেশ করে। গাণিতিকভাবে,
যেখানে হচ্ছে সহাবস্থান লেখের কোনও নির্দিষ্ট বিন্দুতে অঙ্কিত স্পর্শকের ঢাল, আপেক্ষিক সুপ্ততাপ, তাপমাত্রা, দশা পরিবর্তনের কারণে আপেক্ষিক আয়তনের পরিবর্তন এবং দশা পরিবর্তনের কারণে আপেক্ষিক এনট্রপির পরিবর্তন।
উপপাদন
[সম্পাদনা]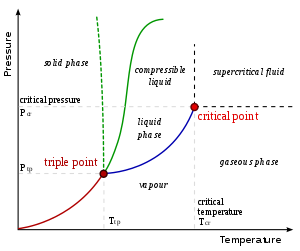
অবস্থা স্বীকার্য থেকে উপপাদন
[সম্পাদনা]অবস্থা স্বীকার্য (স্টেট পসটুলেট) ব্যবহার করে ধরা যাক কোন সমজাতিক পদার্থের আপেক্ষিক এনট্রপি বস্তুটির আপেক্ষিক আয়তন এবং তাপমাত্রা এর একটি ফাংশন ।
ক্লাউজিউস-ক্লাপেরোঁ সম্পর্ক বদ্ধ সিস্টেমে স্থির তাপমাত্রা ও চাপে দশা পরিবর্তনের বৈশিষ্ট্য রুপায়িত করে। অতএব[৪],
উপযুক্ত ম্যাক্সওয়েল সমীকরণ ব্যবহার করে পাওয়া যায়[৫]
যেখানে চাপ নির্দেশ করে। যেহেতু তাপমাত্রা এবং চাপ ধ্রুবক, এতএব সংজ্ঞানুসারে বলা যায় তাপমাত্রার সাথে চাপের অন্তরজ পরিবর্তিত হয় না।[৬][৭]:৫৭, ৬২ & ৬৭১ সুতরাং আপেক্ষিক এন্ট্রপির আংশিক অন্তরজ কে পূর্ণ অন্তরজে পরিবর্তন করে পাওয়া যায়
এবং প্রারম্ভিক দশা থেকে চূড়ান্ত দশা পর্যন্ত সমাকলনে তাপমাত্রার সাপেক্ষে চাপের পূর্ণ অন্তরজ পাওয়া যেতে পারে
যেখানে এবং যথাক্রমে আপেক্ষিক এনট্রপি এবং আপেক্ষিক আয়তনের পরিবর্তন। দশা পরিবর্তনকে অভ্যন্তরীণভাবে একটি প্রত্যাবর্তী প্রক্রিয়া এবং প্রদত্ত সিস্টেমকে বদ্ধ সিস্টেম ধরা হলে তাপগতিবিদ্যার প্রথম সূত্র থেকে পাওয়া যায়
যেখানে সিস্টেমের অভ্যন্তরীণ শক্তি । ধ্রুব চাপ এবং তাপমাত্রা ধরে নিয়ে (দশা পরিবর্তনের সময়) এবং আপেক্ষিক এনথালপির সংজ্ঞা হতে আমরা পাই
দশা পরিবর্তনের সময় চাপ ও তাপমাত্রা স্থির ধরে নেওয়ায় আমরা পাই
আপেক্ষিক সুপ্ততাপকে দ্বারা প্রতিস্থাপন করে পাওয়া যায়
উপরে বর্ণিত চাপ অন্তরজে ( ) এই মান প্রতিস্থাপন করে আমরা পাই
এই সমীকরণটি (ক্লাপেরোঁ সমীকরণ নামেও পরিচিত) সহাবস্থান লেখের কোন বিন্দুতে অঙ্কিত স্পর্শকের ঢাল কে নির্দিষ্ট সুপ্ত তাপ , তাপমাত্রা , এবং আপেক্ষিক আয়তনের পরিবর্তন এর ফাংশন ( ) হিসেবে প্রকাশ করে ।
গিবস-ডুহেম সম্পর্ক থেকে উপপাদন
[সম্পাদনা]ধরা যাক দুটি দশা সাম্যাবস্থায় পরস্পরের সংস্পর্শে অবস্থান করে। তাদের রাসায়নিক বিভব নিম্নোক্ত সমীকরণের মাধ্যমে সম্পর্কিত
সহাবস্থান লেখ বরাবর,
এখানে গিবস-ডুহেম সমীকরণ
(যেখানে আপেক্ষিক এনট্রপি, আপেক্ষিক আয়তন, এবং মোলার ভর) ব্যবহার করে পাওয়া যায়
পুর্নবিন্যাস করে পাই
যা থেকে পূর্ববর্তী পরিচ্ছেদের মতো ক্লাপেরোঁ সমীকরণ উপপাদন করা যায়।
নিম্ন তাপমাত্রায় আদর্শ গ্যাসের আসন্নায়ন
[সম্পাদনা]যখন কোন পদার্থের ক্রান্তি তাপমাত্রারও অনেক নিচে পদার্থটির গ্যাসীয় অবস্থা থেকে তরল বা কঠিনে দশা পরিবর্তন ঘটে তখন গ্যাসীয় দশার আপেক্ষিক আয়তন ঘনীভূত দশার (তরল বা কঠিন) আপেক্ষিক আয়তন অপেক্ষা অনেক বৃদ্ধি পায়। সুতরাং কম তাপমাত্রার ক্ষেত্রে এটা আসন্নায়ন করা যেতে পারে যে
যদি চাপও কম থাকে তবে গ্যাসটিকে আদর্শ গ্যাসের সূত্রের মাধ্যমে লেখা যেতে পারে
যেখানে চাপ, সার্বজনীন গ্যাস ধ্রুবক, এবং তাপমাত্রা। উপর্যুক্ত রাশি নিচের -ক্লাপেরোঁ সমীকরণে প্রতিস্থাপন করে ক্লাউজিউস-ক্লাপেরোঁ সমীকরণ পাওয়া যায়
ক্লাউজিউস-ক্লাপেরোঁ সমীকরণ
সমীকরণটি নিম্ন তাপমাত্রা এবং চাপের জন্য, যেখানে পদার্থের আপেক্ষিক সুপ্ততাপ ।
এবং দশা দুটির মধ্যে সহাবস্থান লেখে যেকোন দুটি বিন্দু এবং নেওয়া হলো। সাধারণত, এমন দুটি বিন্দুর মধ্যে এর মান তাপমাত্রার ফাংশন হিসেবে পরিবর্তিত হয়। কিন্তু যদি ধ্রুবক হয়,
বা[৮]
শেষের সমীকরণগুলি বেশ কার্যকর কারণ এগুলো সম্পৃক্ত বাষ্প চাপ এবং তাপমাত্রাকে আপেক্ষিক আয়তন ব্যাতিরেকেই দশা পরিবর্তনের সুপ্ত তাপের সাথে সম্পর্কিত করে।
প্রয়োগ
[সম্পাদনা]রসায়ন এবং রাসায়নিক প্রকৌশল
[সম্পাদনা]গ্যাসীয় হতে ঘনীভূত দশার পরিবর্তনের ক্ষেত্রে উপরের বর্ণিত আসন্নায়নের মাধ্যমে সমীকরণটি এভাবে লেখা যায়
যেখানে একটি ধ্রুক। তরল-গ্যাসীয় পরিবর্তন প্রক্রিয়ার ক্ষেত্রে বাষ্পায়নের আপেক্ষিক সুপ্ত তাপ (অথবা আপেক্ষিক এনথালপি); কঠিন-গ্যাসীয় পরিবর্তনের ক্ষেত্রে উর্ধ্বপাতনের আপেক্ষিক সুপ্ততাপ । যদি সুপ্ততাপের মান জানা থাকে তবে সহাবস্থান লেখের উপরে একটি বিন্দুর তথ্য থেকে বাকি লেখটি বের করে ফেলা যায়। বিপরীতভাবে, এবং মধ্যে সম্পর্ক রৈখিক হওয়ায় লিনিয়ার রিগ্রেশন ব্যবহার করে সুপ্ততাপ বের করা হয়।
আবহাওয়া এবং জলবায়ু
[সম্পাদনা]বায়ুমণ্ডলীয় জলীয় বাষ্প অনেকগুলো গুরুত্বপূর্ণ আবহাওয়া সংক্রান্ত ঘটনার (বিশেষত বৃষ্টিপাত ) নিয়ামক হিসেবে কাজ করে, যা আমাদেরকে এর কার্যকারিতার প্রতি আগ্রহী করে তোলে। সাধারণ বায়ুমণ্ডলীয় অবস্থায় জলীয় বাষ্পের জন্য ক্লাউজিউস-ক্লাপেরোঁ সমীকরণ (আদর্শ তাপমাত্রা এবং চাপের কাছাকাছি মানের ক্ষেত্রে) নিম্নোক্ত
যেখানেঃ
- সম্পৃক্ত বাষ্প চাপ
- তাপমাত্রা
- পানির বাষ্পীভবনের আপেক্ষিক সুপ্ত তাপ
- জলীয় বাষ্পের গ্যাস ধ্রুবক
এক্ষেত্রে সুপ্ত তাপ এর (এবং সম্পৃক্ত বাষ্প চাপ এর) তাপমাত্রার উপর নির্ভরশীলতা উপেক্ষা করা যায় না। তবে সৌভাগ্যক্রমে, অগাস্ট-রশ-ম্যাগনাস (August–Roche–Magnus) এর নিমোক্ত সূত্রটি এসব ক্ষেত্রে বেশ ভালো আসন্নায়ন করতে পারে
উপরের রাশিতে, hPa (হেক্টো প্যাসকেল) এবং সেলসিয়াসে এককে প্রকাশিত যেখানে এই পৃষ্ঠার অন্য সকল স্থানে কেলভিন এককে প্রকাশিত। (এটিকে কখনও কখনও ম্যাগনাস বা ম্যাগনাস – টিটেনস আসন্নায়ন বলা হয়, যদিও ঐতিহাসিকভাবে নামকরণটি ভুল বলে প্রতীয়মান হয়) [৯]
সাধারণ বায়ুমন্ডলীয় শর্তাবলীতে সূচকের হর T এর উপর সামান্যই নির্ভরশীল (সেলসিয়াস এককে প্রকাশিত)। সুতরাং, অগাস্ট-রশ-ম্যাগনাস (August–Roche–Magnus) সমীকরণ থেকে প্রতীয়মান হয় যে সম্পৃক্ত বাষ্পচাপ সাধারণ বায়ুমন্ডলীয় শর্তাবলীতে সূচকীয়ভাবে বৃদ্ধি পায় ফলে প্রতি ১° সেলসিয়াস তাপমাত্রা বৃদ্ধির কারণে বায়ুমন্ডলের পানি ধারণ ক্ষমতা প্রায় ৭% বৃদ্ধি পায়।
উদাহরণ
[সম্পাদনা]এই সমীকরণের অনেক ব্যবহারের মধ্যে একটি উল্লেখযোগ্য ব্যবহার হলো প্রদত্ত অবস্থায় দশা পরিবর্তন হবে কিনা তা নির্ণয় করা। 0° সেলসিয়াস এর নিচে তাপমাত্রার কোন বরফকে কি পরিমাণ চাপ প্রয়োগ করে গলানো যায় এমন প্রশ্নের উত্তরও ক্লাউজিউস-ক্লাপেরোঁ সমীকরণের মাধ্যমে দেওয়া যায়। এখানে লক্ষণীয় যে বরফ গলনের সময় এর আয়তন হ্রাস পায় ফলে আয়তনের পরিবর্তন ঋণাত্মক হয়। আমরা ধরে নিতে পারি
এবং নিচের মানগুলো প্রতিস্থাপন করি
- (বরফ গলনের সুপ্ত তাপ),
- K (পরম তাপমাত্রা), এবং
- (কঠিন থেকে তরলের আপেক্ষিক আয়তনের পরিবর্তন),
মানগুলো প্রতিস্থাপন করে পাই
−7 °C এর বরফকে গলাতে কি পরিমাণ চাপ দরকার তার একটা ধারণা দিতে বলা যায় এক্ষেত্রে চাপের মান অতি ক্ষুদ্র ক্ষেত্রফল (১ বর্গসেমি) এর উপর প্রায় ১০০০কেজি ভরের একটি গাড়িকে স্থির রাখতে যে পরিমাণ চাপ লাগে তার সমান।
দ্বিতীয় অন্তরজ
[সম্পাদনা]ক্লাউজিউস-ক্লাপেরোঁ সমীকরণ সহাবস্থান লেখের ঢাল প্রকাশ করলেও এটি লেখের বক্রতা বা দ্বিতীয় অন্তরজ সম্পর্কে কোনও ধারণা দেয় না। দশা 1 এবং 2 এর সহাবস্থান লেখের দ্বিতীয় অন্তরজ নিম্নোক্তভাবে দেওয়া যায়
যেখানে 1 এবং 2 সাবস্ক্রিপ্টগুলি বিভিন্ন দশা বোঝায়, ধ্রুব চাপে আপেক্ষিক তাপ ধারণ ক্ষমতা, হ'ল তাপীয় প্রসারণ সহগ, এবং সমতাপীয় সংকোচনশীলতা গুণাঙ্ক।
আরো দেখুন
[সম্পাদনা]- ভ্যান্ট হফ সমীকরণ (Van 't Hoff equation)
- অ্যানটোয়ান সমীকরণ (Antoine equation)
- লি-কেসলার নিয়ম (Lee–Kesler method)
তথ্যসূত্র
[সম্পাদনা]- ↑ "On the motive power of heat and the laws which can be deduced therefrom regarding the theory of heat"। Annalen der Physik (in German)।
- ↑ "Mémoire sur la puissance motrice de la chaleur"। Journal de l'École polytechnique [fr] (in French)।
- ↑ "Clausius–Clapeyron equation"। American Meteorological Society।
- ↑ Wark, Kenneth (১৯৮৮)। Thermodynamics (5th ed.)। New York: McGraw-Hill, Inc.। আইএসবিএন 978-0-07-068286-3।
- ↑ Wark, Kenneth (১৯৮৮)। Thermodynamics (5th ed সংস্করণ)। New York: McGraw-Hill। আইএসবিএন 0-07-068286-0। ওসিএলসি 16355355।
- ↑ Çengel, Yunus A.; Boles, Michael A. (১৯৯৮)। Thermodynamics – An Engineering Approach। McGraw-Hill Series in Mechanical Engineering (3rd সংস্করণ)। McGraw-Hill। আইএসবিএন 978-0-07-011927-7।
- ↑ Masterton, William L., Hurley, Cecile N. (২০০৮)। Chemistry : Principles and Reactions (6th ed.)। Cengage Learning। পৃষ্ঠা 230। আইএসবিএন 9780495126713।
- ↑ Lawrence, M. G. (২০০৫)। "The Relationship between Relative Humidity and the Dewpoint Temperature in Moist Air: A Simple Conversion and Applications" (পিডিএফ): 225–233। ডিওআই:10.1175/BAMS-86-2-225।


































































![{\displaystyle {\begin{aligned}{\frac {\mathrm {d} ^{2}P}{\mathrm {d} T^{2}}}={\frac {1}{v_{2}-v_{1}}}\left[{\frac {c_{p2}-c_{p1}}{T}}-2(v_{2}\alpha _{2}-v_{1}\alpha _{1}){\frac {\mathrm {d} P}{\mathrm {d} T}}\right]+{}\\{\frac {1}{v_{2}-v_{1}}}\left[(v_{2}\kappa _{T2}-v_{1}\kappa _{T1})\left({\frac {\mathrm {d} P}{\mathrm {d} T}}\right)^{2}\right],\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6b1f9040b083bf122ad453b25f90fd71f4504034)


