মূলক
এই নিবন্ধটির রচনা সংশোধনের প্রয়োজন হতে পারে। কারণ ব্যাকরণ, রচনাশৈলী, বানান বা বর্ণনাভঙ্গিগত সমস্যা রয়েছে। |

রসায়নে একটি মূলক (ইংরেজি: Radical, রেডিক্যাল) হলো এক বা একাধিক
কিছু ব্যতিক্রমগুলির সাথে, এই অপ্রচলিত ইলেকট্রনগুলি অন্যান্য পদার্থের প্রতি অত্যন্ত রাসায়নিকভাবে প্রতিক্রিয়াশীল, অথবা এমনকি নিজেদের প্রতি ফ্রি র্যাডিক্যাল তৈরি করে: যদি তারা একে অপরের সাথে যোগাযোগ করে থাকে তবে তাদের অণুগুলি প্রায়ই স্বতঃস্ফূর্তভাবে হ্রাস পাবে বা পলিমারাইজ করবে। বেশিরভাগ র্যাডিক্যাল গুলি অকার্যকর মিডিয়াতে বা ভ্যাকুয়ামে খুব কম ঘনত্বের ক্ষেত্রেই স্থিতিশীল।
ইতিহাস ও নামকরণ[সম্পাদনা]

বিংশ শতকের শেষ অবধি রসায়নে "রেডিক্যাল" শব্দটি ব্যবহার করা হতো পরমাণুর কোনো সংযুক্ত গোষ্ঠীকে নির্দেশ করতে, যেমন একটি মিথাইল গ্রুপ বা একটি কার্বক্সিল, তা বৃহত্তর অণুর অংশ হোক বা নিজে থেকে একটি অণু। একটি রেডিক্যাল প্রায়ই একটি R গ্রুপ হিসাবে পরিচিত। সাম্প্রতিক নামকরণ সংশোধনের পরে, একটি বৃহত্তর অণুর একটি অংশকে এখন একটি কার্যকরী গোষ্ঠী বা বিকল্প বলা হয় এবং "মূলক" এখন "মুক্ত" বোঝায়। যাইহোক, পুরানো নামকরণ এখনও কিছু বইয়ে প্রদর্শিত হতে পারে।
র্যাডিকেল শব্দটি আগে থেকেই ব্যবহার করা হয়েছিল যখন এখন অপ্রচলিত র্যাডিক্যাল তত্ত্বটি তৈরি হয়েছিল। লুই-বার্নার্ড গাইটন ডি মরভেউ ১৭৮৫ সালে "রেডিক্যাল" শব্দগুচ্ছ প্রবর্তন করেন এবং এই শব্দগুচ্ছটি ১৭৮৯ সালে অঁতোয়ান লাভোয়াজিয়ে তার Traité Élémentaire de Chimie-এ ব্যবহার করেছিলেন। একটি র্যাডিক্যাল তখন নির্দিষ্ট অ্যাসিডের মূল ভিত্তি হিসাবে চিহ্নিত করা হয়েছিল (ল্যাটিন শব্দ "রেডিক্স" যার অর্থ "মূল")। ঐতিহাসিকভাবে, র্যাডিকাল তত্ত্বে র্যাডিকাল শব্দটি অণুর আবদ্ধ অংশের জন্যও ব্যবহৃত হত, বিশেষ করে যখন তারা প্রতিক্রিয়ায় অপরিবর্তিত থাকে। এগুলোকে এখন ফাংশনাল গ্রুপ বলা হয়। উদাহরণস্বরূপ, মিথাইল অ্যালকোহল একটি মিথাইল "র্যাডিক্যাল" এবং একটি হাইড্রক্সিল "র্যাডিকাল" সমন্বিত হিসাবে বর্ণনা করা হয়েছিল। আধুনিক রাসায়নিক অর্থে র্যাডিকেলও নয়, কারণ তারা একে অপরের সাথে স্থায়ীভাবে আবদ্ধ, এবং তাদের কোন জোড়াবিহীন, প্রতিক্রিয়াশীল ইলেকট্রন নেই; যাইহোক, ভর স্পেকট্রোমেট্রিতে এগুলিকে র্যাডিকেল হিসাবে পরিলক্ষিত করা যেতে পারে যখন শক্তিমান ইলেকট্রনের সাথে বিকিরণ দ্বারা বিচ্ছিন্ন হয়ে যায়।
আধুনিক প্রেক্ষাপটে প্রথম জৈব (কার্বন-ধারণকারী) র্যাডিকেল চিহ্নিত করা হয়েছিল ট্রাইফিনাইলমিথাইল র্যাডিক্যাল, (C6H5)3C•। এই প্রজাতিটি ১৯০০ সালে মোসেস গোমবার্গ আবিষ্কার করেছিলেন। ১৯৩৩ সালে মরিস এস. খারাশ এবং ফ্রাঙ্ক মায়ো প্রস্তাব করেছিলেন যে অ্যালাইল ব্রোমাইডে হাইড্রোজেন ব্রোমাইডের অ্যান্টি-মার্কভনিকভ সংযোজনের জন্য ফ্রি র্যাডিক্যাল দায়ী।[১][২]
উৎপত্তি[সম্পাদনা]
কোন মুক্তমূলক উৎপন্ন হওয়ার ক্ষেত্রে সাধারণত পাঁচটি কারণ দায়ী:
হোমোলাইসিস[সম্পাদনা]
দুটি পরমাণুর মধ্যে অবস্থিত একটি সমযোজী বন্ধন ভেঙে গিয়ে ওই বন্ধনের দুটি ইলেকট্রন দুটি পরমাণু প্রত্যেকের কাছে আলাদা হয়ে মুক্তমূলক উৎপন্ন করে।
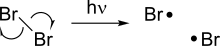
বিজারণ[সম্পাদনা]
বিজোড় ইলেকট্রন বিশিষ্ট কোনো বিক্রিয়ক বিজারণ ক্রিয়াকলাপের মাধ্যমে মুক্তমূলক সৃষ্টি করতে পারে।[৪]

অন্য মুক্তমূলকের প্রভাবে[সম্পাদনা]
প্রতিস্থাপন বা অ্যাবস্ট্রাকশন[সম্পাদনা]

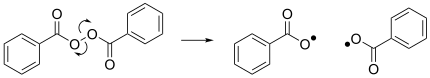
প্রতিস্থাপন একটি নতুন র্যাডিকাল এবং একটি নতুন স্পিন-জোড়া অণু তৈরি করে। এটি হোমোলাইসিস থেকে ভিন্ন, যার ফলে একটি একক স্পিন-পেয়ার্ড অণু থেকে দুটি র্যাডিকেল হয় এবং এর বিক্রিয়ক হিসাবে একটি র্যাডিকেল অন্তর্ভুক্ত করে না। হাইড্রোজেন প্রতারিত র্যাডিকাল রসায়নে একটি মৌলিক প্রক্রিয়া কারণ এটি অনেক রাসায়নিক বিক্রিয়ায় চূড়ান্ত প্রচারের ধাপ হিসেবে কাজ করে, কার্বন র্যাডিকালকে স্থিতিশীল অণুতে রূপান্তর করে। ডানদিকের চিত্রটি একটি বেঞ্জোইলক্সি রেডিক্যাল এবং একটি হাইড্রোজেন ব্রোমাইড অণুর মধ্যে একটি র্যাডিকাল প্রতিস্থাপন দেখায়, যার ফলে একটি বেঞ্জোয়িক অ্যাসিড অণু এবং একটি ব্রোমিন র্যাডিকাল উৎপাদন হয়।
সংযোজন বা অ্যাডিশন[সম্পাদনা]
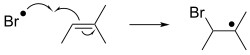
মুক্তমূলক সংযোজন বিক্রিয়ার পদ্ধতি ব্যাখ্যা করতে এরূপ ঘটনা দেখানো হয়।
বিয়োজন বা এলিমিনেশন[সম্পাদনা]
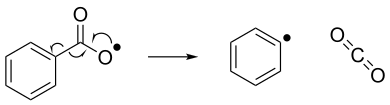
স্থিতিশীলতা[সম্পাদনা]
মুক্ত মূলকের স্থিতিশীলতা যত বৃদ্ধি পায়, তত তার বিক্রিয়া করার ক্ষমতাও বৃদ্ধি পায়, ফলে বিক্রিয়ার হারও বৃদ্ধি পায়।
হাইপারকনজুগেশন[সম্পাদনা]
র্যাডিকাল কেমিস্ট্রিতে, র্যাডিকালগুলি সংলগ্ন অ্যালকাইল গ্রুপের সাথে হাইপারকনজুগেশনের মাধ্যমে স্থিতিশীল হয়। আংশিকভাবে ফাঁকা র্যাডিকাল অরবিটালে সিগমা (σ) C−H বন্ডের দান প্রগৌণ (টারশিয়ারি), গৌণ (সেকেন্ডারি) এবং প্রাথমিক (প্রাইমারি) কার্বনে র্যাডিকালগুলির স্থিতিশীলতাকে আলাদা করতে সাহায্য করে। টারশিয়ারি কার্বন র্যাডিকেলের তিনটি σ C-H বন্ড থাকে যা দান করে, সেকেন্ডারি র্যাডিকেল মাত্র দুটি এবং প্রাথমিক র্যাডিকেল মাত্র একটি। অতএব, টারশিয়ারি র্যাডিকাল হল সবচেয়ে স্থিতিশীল এবং প্রাথমিক র্যাডিকেল হল সবচেয়ে কম স্থিতিশীল।
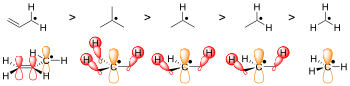
এছাড়া, মুক্তামূলক গুলি কনজুকেটেড সিস্টেম বা পাই বন্ধনের সাথে রেজোন্যান্স করতে পারে, যা তাদের স্থিতিশীলতাকে আরও বাড়িয়ে দেয়।
স্টেরিক প্রতিবন্ধকতা[সম্পাদনা]
স্টেরিক প্রভাব যত বাড়ে, তত বিক্রিয়ার হার কমে ও মূলক অবস্থার স্থিতিশীলতা বাড়ে।
অজৈব মূলক[সম্পাদনা]
অজৈব র্যাডিকেলের একটি বৃহৎ প্রকার স্থিতিশীল এবং প্রকৃতপক্ষে বিচ্ছিন্ন। উদাহরণগুলির মধ্যে বেশিরভাগ প্রথম-সারির রূপান্তর ধাতব কমপ্লেক্স অন্তর্ভুক্ত।
প্রধান গ্রুপ র্যাডিক্যাল এর ক্ষেত্রে, মহাবিশ্বের সবচেয়ে প্রচুর পরিমাণে থাকা র্যাডিকেল হল H•। বেশিরভাগ প্রধান গোষ্ঠীর র্যাডিকেলগুলি তাদের অন্তর্নিহিত স্থিতিশীলতা সত্ত্বেও বিচ্ছিন্ন নয়। উদাহরণস্বরূপ হাইড্রোজেন র্যাডিকেলগুলি সাগ্রহে একত্রিত হয়ে H2 গঠন করে। নাইট্রিক অক্সাইড (NO) একটি বিচ্ছিন্ন অজৈব র্যাডিকেলের সুপরিচিত উদাহরণ। ফ্রেমির লবণ (পটাশিয়াম নাইট্রোসোডাইসালফোনেট,(KSO3)2NO) একটি সম্পর্কিত উদাহরণ। π রেজোন্যান্স স্থিতিশীলতার সীমিত পরিমাণ সত্ত্বেও অনেক টেট্রাসালফার টেট্রানাইট্রাইড (S4N4) র্যাডিকাল পরিচিত।[৭][৮]
2•
তথ্যসূত্র[সম্পাদনা]
- ↑ Kharasch, M. S. (১৯৩৩)। "The Peroxide Effect in the Addition of Reagents to Unsaturated Compounds. I. The Addition of Hydrogen Bromide to Allyl Bromide"। Journal of the American Chemical Society। 55 (6): 2468–2496। ডিওআই:10.1021/ja01333a041।
- ↑ Yan, M; Lo, JC; Edwards, JT; Baran, PS (২০১৬)। "Radicals: Reactive Intermediates with Translational Potential"। J Am Chem Soc। 138 (39): 12692–12714। ডিওআই:10.1021/jacs.6b08856। পিএমআইডি 27631602। পিএমসি 5054485
 ।
।
- ↑ "Diacyl Peroxides"। polymerdatabase.com। সংগ্রহের তারিখ ২০২০-১২-০৮।
- ↑ "IV. Nonchain Reactions: Radical Formation by Electron Transfer"। Chemistry LibreTexts (ইংরেজি ভাষায়)। ২০১৫-০১-২১। সংগ্রহের তারিখ ২০২০-১২-০৮।
- ↑ "II. Atom Abstraction"। Chemistry LibreTexts (ইংরেজি ভাষায়)। ২০১৫-০১-১১। সংগ্রহের তারিখ ২০২০-১২-০৮।
- ↑ Su, Wei-Fang (২০১৩), Su, Wei-Fang, সম্পাদক, "Radical Chain Polymerization", Principles of Polymer Design and Synthesis, Lecture Notes in Chemistry (ইংরেজি ভাষায়), Berlin, Heidelberg: Springer, 82, পৃষ্ঠা 137–183, আইএসবিএন 978-3-642-38730-2, ডিওআই:10.1007/978-3-642-38730-2_7

- ↑ Oakley, Richard T. (১৯৮৮)। "Cyclic and Heterocyclic Thiazenes" (পিডিএফ)। Progress in Inorganic Chemistry। Cyclic and Heterocyclic Thiazenes (section)। Progress in Inorganic Chemistry। 36। পৃষ্ঠা 299–391। আইএসবিএন 978-0-470-16637-6। ডিওআই:10.1002/9780470166376.ch4। ২০১৫-০৯-২৩ তারিখে মূল (পিডিএফ) থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২০১১-০৩-৩১।
- ↑ Rawson, J; Banister, A; Lavender, I (১৯৯৫)। The Chemistry of Dithiadiazolylium and Dithiadiazolyl Rings। Advances in Heterocyclic Chemistry। 62। পৃষ্ঠা 137–247। আইএসবিএন 978-0-12-020762-6। ডিওআই:10.1016/S0065-2725(08)60422-5।

