মার্কারি সালফাইড
| |

| |
| নামসমূহ | |
|---|---|
| ইউপ্যাক নাম
মার্কারি সালফাইড
| |
| অন্যান্য নাম | |
| শনাক্তকারী | |
ত্রিমাত্রিক মডেল (জেমল)
|
|
| ইসিএইচএ ইনফোকার্ড | ১০০.০১৪.২৭০ |
| ইসি-নম্বর | |
পাবকেম CID
|
|
| ইউএনআইআই | |
কম্পটক্স ড্যাশবোর্ড (EPA)
|
|
| |
| বৈশিষ্ট্য | |
| HgS | |
| আণবিক ভর | 232.66 g/mol |
| ঘনত্ব | 8.10 g/cm3 |
| গলনাঙ্ক | ৫৮০ °সে (১,০৭৬ °ফা; ৮৫৩ K) decomposes |
| অদ্রবণীয় | |
| ব্যান্ড ব্যবধান | 2.1 eV (direct, α-HgS) [১] |
| −55.4·10−6 cm3/mol | |
| প্রতিসরাঙ্ক (nD) | w=2.905, e=3.256, bire=0.3510 (α-HgS) [২] |
| তাপ রসায়নবিদ্যা | |
| স্ট্যন্ডার্ড মোলার এন্ট্রোফি এস |
78 J·mol−1·K−1[৩] |
| গঠনে প্রমান এনথ্যাল্পির পরিবর্তন ΔfH |
−58 kJ·mol−1[৩] |
| ঝুঁকি প্রবণতা | |
| নিরাপত্তা তথ্য শীট | ICSC 0981 |
ইইউ শ্রেণীবিভাগ (ডিএসডি)
|
Very toxic (T+) Dangerous for the environment (N) |
| আর-বাক্যাংশ | আর২৬/২৭/২৮, আর৩৩, আর৫০/৫৩ |
| এস-বাক্যাংশ | (এস১/২), এস১৩, এস২৮, এস৪৫, এস৬০, এস৬১ |
| এনএফপিএ ৭০৪ | |
| ফ্ল্যাশ পয়েন্ট | Non-flammable |
| সম্পর্কিত যৌগ | |
অন্যান্য অ্যানায়নসমূহ
|
Mercury oxide Mercury selenide Mercury telluride |
অন্যান্য ক্যাটায়নসমূহ
|
Zinc sulfide Cadmium sulfide |
সুনির্দিষ্টভাবে উল্লেখ করা ছাড়া, পদার্থসমূহের সকল তথ্য-উপাত্তসমূহ তাদের প্রমাণ অবস্থা (২৫ °সে (৭৭ °ফা), ১০০ kPa) অনুসারে দেওয়া হয়েছে। | |
| তথ্যছক তথ্যসূত্র | |
মার্কারি সালফাইড, মারকিউরিক সালফাইড বা মার্কারি(II) সালফাইড হল পারদ এবং গন্ধকের একটি রাসায়নিক যৌগ। এর রাসায়নিক সংকেত HgS। এটি জলে কার্যত অদ্রবণীয়।[৪]
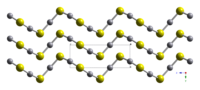
কেলাসের গঠন[সম্পাদনা]

মার্কারি সালফাইডের দুই ধরনের কেলাস আছে:
- লাল সিনাবার (α-HgS), মার্কারি সালফাইডের এই রূপটি প্রকৃতিতে সাধারণভাবে পাওয়া যায়। এটি সিঁন্দুর রঙের।
- কালো মেটাসিনবার (β-HgS), প্রকৃতিতে খুব কম দেখা যায়।
লাল, α-HgS এর স্ফটিকগুলি আলোক সক্রিয়। Hg-S এর কুণ্ডলী গঠনের জন্য হয়।
প্রস্তুতি এবং রসায়ন[সম্পাদনা]
মার্কারি (II) লবণের দ্রবণের মধ্য দিয়ে হাইড্রোজেন সালফাইড গ্যাস পরিচালিত করলে কালো পাউডার হিসাবে β-HgS এর অধঃক্ষেপ পড়ে।[৫] সিনাবার অকরিককে বায়ুতে তাপজারণ করার সময় যে বাষ্প উৎপন্ন হয় তাকে ঘনীভূত করে পারদ পাওয়া যায়।[৪]
ব্যবহার[সম্পাদনা]
α-HgS লাল রঙ্গক হিসাবে সিঁদুর নামেই বেশি পরিচিত। সিঁদুরের রঙ আস্তে আস্তে গাঢ় হওয়ার যে প্রবণতা থাকে তা আসলে লাল α-HgS থেকে কালো β-HgS রূপান্তরের জন্য হয়। তবে ইটালির পম্পেইয়ে প্রত্নতাত্ত্বিক খননকালের সময় β-HgS সনাক্ত করা যায়নি, যেখানে প্রাথমিকভাবে লাল দেয়াল কালো হয়ে গিয়েছিল। এর কারণ হিসেবে পারদের ক্লোরাইড যৌগ (যেমন, কর্ডিয়ারাইট, ক্যালোমেল এবং টেরলিংগুয়াইট), ক্যালসিয়াম সালফেট, এবং জিপসাম এর গঠনের জন্য দায়ী ছিল।[৬]
তথ্যসূত্র[সম্পাদনা]
- ↑ L. I. Berger, Semiconductor Materials (1997) CRC Press আইএসবিএন ০-৮৪৯৩-৮৯১২-৭
- ↑ Webminerals
- ↑ ক খ Zumdahl, Steven S. (২০০৯)। Chemical Principles 6th Ed.। Houghton Mifflin Company। পৃষ্ঠা A22। আইএসবিএন 978-0-618-94690-7।
- ↑ ক খ Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. p. 1406. ISBN 978-0-08-022057-4.
- ↑ Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (১৯৯৯), Advanced Inorganic Chemistry (6th সংস্করণ), New York: Wiley-Interscience, আইএসবিএন 0-471-19957-5
- ↑ Cotte, M; Susini J; Metrich N; Moscato A; Gratziu C; Bertagnini A; Pagano M (২০০৬)। "Blackening of Pompeian Cinnabar Paintings: X-ray Microspectroscopy Analysis"। Anal. Chem.। 78 (21): 7484–7492। ডিওআই:10.1021/ac0612224। পিএমআইডি 17073416।

