অ্যামিনো অ্যাসিড: সংশোধিত সংস্করণের মধ্যে পার্থক্য
{{কাজ চলছে/২০২২}} |
"Amino acid" পাতাটি অনুবাদ করে তৈরি করা হয়েছে |
||
| ১ নং লাইন: | ১ নং লাইন: | ||
{{কাজ চলছে/২০২২}}[[চিত্র:Amino acid2.png|thumb|আলফা অ্যামিনো অ্যাসিডের সাধারণ চিত্র]] |
|||
কোনো যৌগে যুগপৎ অন্ততপক্ষে একটি [[কার্বক্সিলিক অ্যাসিড]] ও অন্তত একটি [[অ্যামিন]] [[কার্যকরী মূলক]] থাকলে তাকে '''অ্যামিনো অ্যাসিড''' বলা যায়। [[আমিষ|আমিষের]] মৌলিক গাঠনিক একক হলো এই অ্যামিনো অম্ল।<ref>{{বই উদ্ধৃতি|শিরোনাম=Chemistry|শেষাংশ=Chang|প্রথমাংশ=Raymond|বছর=২০০৭|প্রকাশক=ম্যাকগ্র-হিল এজুকেশন|অবস্থান=ভারত|পাতাসমূহ=১০৪৬}}</ref> |
|||
[[চিত্র:L-amino_acid_structure.svg|থাম্ব| "নিরপেক্ষ" রূপে একটি সাধারণ এল-অ্যামিনো অ্যাসিডের গঠনঃ এই রূপটি আসলে জলীয় দ্রবণে বা কঠিন অবস্থায় সনাক্তযোগ্য পরিমাণে বিদ্যমান-এটি বুঝানো ছাড়াই এটির জন্য একটি পদ্ধতিগত নাম প্রয়োজন।]] |
|||
তবে [[প্রাণরসায়ন|প্রাণরসায়নে]] অ্যামিনো অ্যাসিড শব্দটি বিশেষভাবে প্রয়োগ হয় '''আলফা অ্যামিনো অ্যাসিড''' হিসেবে, যেখানে [[কার্বক্সিলিক অ্যাসিড]] আর অ্যামিন গ্রুপদুটি একই (আলফা) কার্বনে যুক্ত। |
|||
'''অ্যামিনো অ্যাসিড''' হল [[জৈব যৌগ]] যাতে [[অ্যামিন|অ্যামিনো]] এবং [[কার্বক্সিলিক অ্যাসিড|কার্বক্সিলেট]] [[কার্যকরী মূলক|ফাংশনাল গ্রুপ]] বিদ্যমান থাকে, সাথে প্রতিটি অ্যামিনো অ্যাসিডের জন্য নির্দিষ্ট একটি সাইড চেইনও (R গ্রুপ) থাকে।<ref>{{Lehninger4th|name-list-style=vanc}}</ref> নেলসন, ডেভিড এল.; কক্স, মাইকেল এম. (২০০৫), ''Principles of Biochemistry'' (৪র্থ সংস্করণ), নিউ ইয়র্ক: ডব্লিউ. এইচ. ফ্রিম্যান, [[আন্তর্জাতিক মান পুস্তক সংখ্যা|আইএসবিএন]] [[বিশেষ:বইয়ের উৎস/0-7167-4339-6|0-7167-4339-6]] প্রতিটি অ্যামিনো অ্যাসিডে উপস্থিত [[মৌলিক পদার্থ|উপাদানগুলি]] হল [[কার্বন]] (C), [[হাইড্রোজেন]] (H), [[অক্সিজেন]] (O), এবং [[নাইট্রোজেন]] (N); এছাড়াও সিস্টাইন এবং মেথিওনিনের পার্শ্ব শৃঙ্খলে [[গন্ধক|সালফার]] (S) থাকে এবং কম প্রচলিত অ্যামিনো অ্যাসিড, যেমনসেলেনোসিস্টাইনে [[সেলেনিয়াম]] (Se) উপস্থিত থাকে। {{As of|2020}}, ৫০০ টিরও বেশি প্রাকৃতিকভাবে প্রাপ্ত অ্যামিনো অ্যাসিড পেপটাইড যৌগসমূহের মনোমার একক গঠন করে বলে জানা যায়, যেসব পেপটাইড যৌগসমূহের মধ্যে [[প্রোটিন]]<nowiki/>ও অন্তর্ভুক্ত। <ref>{{সাময়িকী উদ্ধৃতি|শেষাংশ=Flissi|প্রথমাংশ=Areski|শেষাংশ২=Ricart|প্রথমাংশ২=Emma|বছর=2020|শিরোনাম=Norine: update of the nonribosomal peptide resource|পাতাসমূহ=D465–D469|doi=10.1093/nar/gkz1000|pmc=7145658|pmid=31691799}}</ref> (যদিও [[বংশগতীয় সংকেত|জেনেটিক কোডে]] মাত্র 20টি দেখা যায়, অতিরিক্ত দেখা যায় সেলেনোসিস্টাইন, যা একটি বিশেষ উপায়ে এনকোড করা হয়)। <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Böck A, Forchhammer K, Heider J, Baron C|তারিখ=December 1991|শিরোনাম=Selenoprotein synthesis: an expansion of the genetic code|পাতাসমূহ=463–7|doi=10.1016/0968-0004(91)90180-4|pmid=1838215}}</ref> |
|||
জৈব-রাসায়নিক নামকরণের যৌথ কমিশন<ref name="iupaciub2">{{cite web|year=1983|publisher=IUPAC-IUB Joint Commission on Biochemical Nomenclature|title=Nomenclature and Symbolism for Amino Acids and Peptides|url=http://www.chem.qmul.ac.uk/iupac/AminoAcid/AA1n2.html|url-status=dead|archive-url=https://web.archive.org/web/20081009023202/http://www.chem.qmul.ac.uk/iupac/AminoAcid/AA1n2.html|archive-date=9 October 2008|access-date=17 November 2008}}</ref> (Joint Commission on Biochemical Nomenclature) অ্যামিনো অ্যাসিডসমূহের আনুষ্ঠানিক নাম প্রদান করেঃ এক্ষেত্রে তারা চিত্রে দেখানো অ্যামিনো অ্যাসিডের (এল-অ্যামিনো অ্যাসিড) কাল্পনিক "নিরপেক্ষ" কাঠামোর পরিপ্রেক্ষিতে নামকরণ করে থাকে। |
|||
==ইতিহাস== |
|||
উনিশ শতকের শুরুর দিকে কিছু অ্যামিনো অম্ল আবিষ্কৃত হয়। ১৮০৬ সালে ফরাসি রসায়নবিদ [[Louis-Nicolas Vauquelin|লুই নিকোলা ভাকলাঁ]] এবং [[Pierre Jean Robiquet|পিয়ের-জঁ রবিকে]] প্রথম অ্যামিনো এসিড [[এসপারাজিন|অ্যাসপারাজিন]] আবিষ্কার করেন [[শতমূলী]] থেকে।<ref>{{সাময়িকী উদ্ধৃতি|শিরোনাম=The discovery of a new plant principle in Asparagus sativus |vauthors=Vauquelin LN, Robiquet PJ |সাময়িকী=Annales de Chimie |বছর=1806 |খণ্ড=57 |পাতাসমূহ=88–93}}</ref><ref name=Anfinsen>{{বই উদ্ধৃতি|শিরোনাম=Advances in Protein Chemistry |ইউআরএল=https://archive.org/details/advancesinprotei26anfi |vauthors=Anfinsen CB, Edsall JT, Richards FM |বছর=1972 |পাতাসমূহ=[https://archive.org/details/advancesinprotei26anfi/page/99 99], 103 |প্রকাশক=Academic Press |অবস্থান=New York |আইএসবিএন=978-0-12-034226-6}}</ref> |
|||
উদাহরণস্বরূপ, অ্যালানিনের পদ্ধতিগত নাম হল 2-অ্যামিনোপ্রোপ্যানোইক অ্যাসিড যা নির্ভর করে এর গাঠনিক সংকেত, CH<sub>3</sub>-CH(NH<sub>2</sub>)-COOH এর উপর। উক্ত কমিশন এই পদ্ধতির যথার্থতা নিম্নরূপে তুলে ধরে :<blockquote>প্রদত্ত পদ্ধতিগত নাম এবং সংকেতগুলো অনুমানমূলক (রাসায়নিক) গঠন নির্দেশ করে যেখানে অ্যামিনো গ্রুপগুলি হাইড্রোজেনমুক্ত (unprotonated) এবং কার্বক্সিল গ্রুপগুলি অবিভাজিত (undissociated)। এই রীতিটি বিভিন্ন নামকরণ সংক্রান্ত সমস্যা এড়ানোর ক্ষেত্রে কার্যকর কিন্তু, এর দ্বারা এমনটা বোঝানো ঠিক হবে না যে এই (গাঠনিক) কাঠামোগুলি অ্যামিনো-অ্যাসিড অণুগুলোর একটি মাত্রা পরিমাণ অংশের প্রতিনিধিত্ব করে।</blockquote>'''<big>প্রকারভেদ ও অবস্থান</big>''' |
|||
{{অ্যামিনো অ্যাসিড তালিকা}} |
|||
সাধারণ গঠন |
|||
অ্যামিনো অ্যাসিডগুলোকে মূল কাঠামোগত কার্যকরী মূলকগুলির অবস্থান অনুসারে [[আলফা এবং বিটা কার্বন|আলফা- <span style="white-space: nowrap">(α-)</span>, বিটা- <span style="white-space: nowrap">(β-)</span>, গামা- <span style="white-space: nowrap">(γ-)</span> বা ডেল্টা- <span style="white-space: nowrap">(δ-)</span>]] শ্রেণিতে বিন্যস্ত করা যেতে পারে; অন্যান্য শ্রেণীগুলি রাসায়নিক মেরুতা বা [[রাসায়নিক মেরুতা|পোলারিটি]], [[আয়নিকরণ]], এবং পার্শ্ব-শিকল গ্রুপ টাইপ ( [[অ্যালিফ্যাটিক হাইড্রোকার্বন|এলিফ্যাটিক]], অ্যাসাইক্লিক, অ্যারোমেটিক, হাইড্রক্সিল বা [[গন্ধক|সালফার]] ধারণকারী, ইত্যাদির সাথে সম্পর্কিত)। অ্যামিনো অ্যাসিডের [[অবশিষ্টাংশ (রসায়ন)|অবশিষ্টাংশগুলি]] ([[:en:Residue_(chemistry)|residues]]), প্রোটিনরুপে মানুষের [[ঐচ্ছিক পেশী|পেশী]] এবং অন্যান্য [[কলা (জীববিজ্ঞান)|টিস্যুগুলির]] দ্বিতীয় বৃহত্তম গাঠনিক উপাদান ([[পানি]] হল বৃহত্তম) হিসেবে বিরাজ করে। <ref>{{বই উদ্ধৃতি|শিরোনাম=Human nutrition in the developing world|শেষাংশ=Latham|প্রথমাংশ=Michael C.|অধ্যায়ের-ইউআরএল=http://www.fao.org/docrep/W0073E/w0073e04.htm#P1625_217364|বছর=1997|ধারাবাহিক=Food and Nutrition Series – No. 29|প্রকাশক=Food and Agriculture Organization of the United Nations|অধ্যায়=Chapter 8. Body composition, the functions of food, metabolism and energy}}</ref> এছাড়া, প্রোটিনের অবশিষ্টাংশ (protein residues) হিসাবে তাদের ভূমিকা ছাড়াও, অ্যামিনো অ্যাসিডগুলি [[নিউরোট্রান্সমিটার]] পরিবহন এবং [[জৈবসংশ্লেষণ|জৈব সংশ্লেষণের]] মতো অনেকগুলি প্রক্রিয়াতে অংশগ্রহণ করে। |
|||
==বিক্রিয়া== |
|||
==ব্যবহার== |
|||
==আরও দেখুন== |
|||
== ইতিহাস == |
|||
==তথ্যসূত্র== |
|||
প্রথম কয়েকটি অ্যামিনো অ্যাসিড ১৯০০-এর দশকের গোড়ার দিকে আবিষ্কৃত হয়েছিল।<ref>{{cite journal|vauthors=Vickery HB, Schmidt CL|year=1931|title=The history of the discovery of the amino acids|pages=169–318|doi=10.1021/cr60033a001|journal=Chem. Rev.|volume=9|issue=2}}</ref><ref>{{cite web|last=Hansen|first=Sabine|date=May 2015|language=de|title=Die Entdeckung der proteinogenen Aminosäuren von 1805 in Paris bis 1935 in Illinois|url=https://www.arginium.de/wp-content/uploads/2015/12/Entdeckung-der-Aminos%C3%A4uren.pdf|archive-url=https://web.archive.org/web/20171201232937/https://www.arginium.de/wp-content/uploads/2015/12/Entdeckung-der-Aminos%C3%A4uren.pdf|archive-date=1 December 2017|name-list-style=vanc|location=Berlin}}</ref> ১৮০৬ সালে ফরাসি রসায়নবিদ লুই-নিকোলাস ভাউকুলিন ([[:en:Louis-Nicolas_Vauquelin|Louis-Nicolas Vauquelin]]) এবং পিয়েরে জিন রবিকেট ([[:en:Pierre_Jean_Robiquet|Pierre Jean Robiquet]]) অ্যাসপারাগাস ([[:en:Asparagus|asparagus]]) থেকে একটি যৌগ নিষ্কাশন করেছিলেন যা পরবর্তীকালে অ্যাসপারাগিন ([[:en:Asparagus|asparagus]]) নামে পরিচিতি পেয়েছিল- এটিই ছিল প্রথম আবিষ্কৃত অ্যামিনো অ্যাসিড।<ref>{{Cite journal|vauthors=Vauquelin LN, Robiquet PJ|year=1806|title=The discovery of a new plant principle in Asparagus sativus|pages=88–93|journal=Annales de Chimie|volume=57}}</ref><ref name="Anfinsen2">{{Cite book|url=https://archive.org/details/advancesinprotei26anfi/page/99|title=Advances in Protein Chemistry|vauthors=Anfinsen CB, Edsall JT, Richards FM|year=1972|publisher=Academic Press|pages=[https://archive.org/details/advancesinprotei26anfi/page/99 99, 103]|isbn=978-0-12-034226-6|location=New York}}</ref> সিস্টিন ([[:en:Cystine|Cystine]]) আবিষ্কৃত হয়েছিল ১৮১০ সালে,<ref>{{Cite journal|vauthors=Wollaston WH|year=1810|title=On cystic oxide, a new species of urinary calculus|pages=223–230|doi=10.1098/rstl.1810.0015|s2cid=110151163|journal=Philosophical Transactions of the Royal Society|volume=100}}</ref> যদিও এর মনোমার- সিস্টেইন ([[:en:Cysteine|cysteine]]) ১৮৮৪ সাল পর্যন্ত অনাবিষ্কৃত ছিল।<ref>{{Cite journal|vauthors=Baumann E|year=1884|title=Über cystin und cystein|url=http://vlp.mpiwg-berlin.mpg.de/library/data/lit16533|pages=299–305|archive-url=https://web.archive.org/web/20110314075450/http://vlp.mpiwg-berlin.mpg.de/library/data/lit16533|archive-date=14 March 2011|url-status=dead|access-date=28 March 2011|journal=Z Physiol Chem|volume=8|issue=4}}</ref>{{efn|The late discovery is explained by the fact that cysteine becomes oxidized to cystine in air.}} |
|||
{{সূত্র তালিকা}} |
|||
১৮২০ সালে গ্লাইসিন এবং লিউসিন আবিষ্কৃত হয়।<ref>{{Cite journal|vauthors=Braconnot HM|year=1820|title=Sur la conversion des matières animales en nouvelles substances par le moyen de l'acide sulfurique|series=2nd Series|pages=113–125|journal=Annales de Chimie et de Physique|volume=13}}</ref> আবিষ্কৃত ২০ টি সাধারণ অ্যামিনো অ্যাসিডের মধ্যে শেষটি ছিল থ্রেওনিন যেটি উইলিয়াম কামিং রোজ ([[:en:William_Cumming_Rose|William Cumming Rose]]) ১৯৩৫ সালে আবিষ্কার করেছিলেন, (এছাড়াও) তিনি অপরিহার্য অ্যামিনো অ্যাসিডও ([[:en:Essential_amino_acid|essential amino acids]]) নিরুপণ করেছিলেন এবং অত্যানুকুল বৃদ্ধির (optimal growth) জন্য সকল অ্যামিনো অ্যাসিডের ন্যূনতম দৈনিক চাহিদা নির্ধারণ করেছিলেন।<ref>{{cite journal|vauthors=Simoni RD, Hill RL, Vaughan M|date=September 2002|title=The discovery of the amino acid threonine: the work of William C. Rose [classical article]|url=http://www.jbc.org/content/277/37/e25|pages=E25|doi=10.1016/S0021-9258(20)74369-3|pmid=12218068|doi-access=free|journal=The Journal of Biological Chemistry|volume=277|issue=37}}</ref><ref>{{cite journal|vauthors=McCoy RH, Meyer CE, Rose WC|year=1935|title=Feeding Experiments with Mixtures of Highly Purified Amino Acids. VIII. Isolation and Identification of a New Essential Amino Acid|pages=283–302|doi=10.1016/S0021-9258(18)74986-7|doi-access=free|journal=Journal of Biological Chemistry|volume=112}}</ref> |
|||
[[বিষয়শ্রেণী:প্রাণরসায়ন]] |
|||
(অ্যামিনো অ্যাসিড) রাসায়নিক যৌগশ্রেণীর একত্ব (unity) ১৮৬৫ সালে বিজ্ঞানী উর্টজ ([[:en:Charles_Adolphe_Wurtz|Wurtz]]) কর্তৃক প্রথম চিহ্নিত হয়েছিল, তবে তিনি এর কোনও নির্দিষ্ট নাম দেননি।<ref>Menten, P. ''Dictionnaire de chimie: Une approche étymologique et historique''. De Boeck, Bruxelles. [https://books.google.com/books?id=NKTKDgAAQBAJ link].</ref> ইংরেজি ভাষায় "অ্যামিনো অ্যাসিড" শব্দটির প্রথম ব্যবহার ১৮৯৮ সাল থেকে শুরু হয়,<ref>{{cite web|last=Harper|first=Douglas|title=amino-|url=https://www.etymonline.com/word/amino-|access-date=19 July 2010|work=Online Etymology Dictionary|name-list-style=vanc}}</ref> আর; জার্মান শব্দ, Aminosäure, এর আগে থেকে ব্যবহৃত হচ্ছিল।<ref>{{cite journal|vauthors=Paal C|year=1894|title=Ueber die Einwirkung von Phenyl‐i‐cyanat auf organische Aminosäuren|url=https://zenodo.org/record/1425732|pages=974–979|doi=10.1002/cber.189402701205|archive-url=https://web.archive.org/web/20200725075835/https://zenodo.org/record/1425732|archive-date=2020-07-25|url-status=dead|journal=Berichte der Deutschen Chemischen Gesellschaft|volume=27}}</ref> দেখা যায় যে, এনজাইমঘটিত বিপাকক্রিয়া বা অম্ল পানি-বিশ্লেষণ (অ্যাসিড হাইড্রোলাইসিস-acid [[:en:Hydrolysis|hydrolysis]]) পরবর্তী ধাপে প্রোটিনগুলি অ্যামিনো অ্যাসিড উৎপন্ন করে থাকে। ১৯০২ সালে, এমিল ফিশার ([[:en:Hermann_Emil_Fischer|Emil Fischer]]) এবং ফ্রাঞ্জ হফমেস্টার ([[:en:Franz_Hofmeister|Franz Hofmeister]]) স্বাধীনভাবে প্রস্তাব করেছিলেন যে, প্রোটিনগুলি অনেক অ্যামিনো অ্যাসিড থেকে গঠিত হয়, যার ফলে একটি অ্যামিনো অ্যাসিডের অ্যামিনো গ্রুপের সাথে অন্য অ্যামিনো অ্যাসিডের কার্বোক্সিল গ্রুপের বন্ধন তৈরি হয় , যার ফলে একটি রৈখিক কাঠামো তৈরি হয় যেটিকে বিজ্ঞানী ফিশার "পেপটাইড" ([[:en:Peptide|peptide]]) (পেপটাইড বন্ধন) বলে অভিহিত করেছিলেন।<ref>{{cite book|title=Contrasts in Scientific Style: Research Groups in the Chemical and Biochemical Sciences|last=Fruton|first=Joseph S.|year=1990|publisher=American Philosophical Society|pages=163–165|chapter=Chapter 5- Emil Fischer and Franz Hofmeister|isbn=978-0-87169-191-0|name-list-style=vanc|volume=191}}</ref> |
|||
== সাধারণ কাঠামো == |
|||
এই পাতার শীর্ষে দেখানো কাঠামোতে R বলতে প্রতিটি অ্যামিনো অ্যাসিডের জন্য নির্দিষ্ট একটি পার্শ্ব চেইন ([[:en:Substituent|side chain]]) বুঝায়। [[কার্বক্সিলিক অ্যাসিড|কার্বক্সিল গ্রুপের]] ([[:en:Carboxyl_group|carboxyl group]]) পাশে থাকা [[কার্বন]] ([[:en:Carbon|carbon]]) পরমাণুকে [[আলফা এবং বিটা কার্বন|α–কার্বন]] ([[:en:Alpha_carbon|α–carbon]]) বলা হয়। α-কার্বনের সাথে সরাসরি সংযুক্ত একটি [[অ্যামিন|অ্যামিনো গ্রুপ]] ([[:en:Amino_group|amino group]]) ধারণকারী অ্যামিনো অ্যাসিডগুলিকে ''α-অ্যামিনো অ্যাসিড'' হিসাবে উল্লেখ করা হয়। <ref>{{ওয়েব উদ্ধৃতি|প্রকাশক=Merriam-Webster Inc.|শিরোনাম=Alpha amino acid|ইউআরএল=http://www.merriam-webster.com/medical/alpha-amino%20acid|ওয়েবসাইট=The Merriam-Webster.com Medical Dictionary}}.</ref> এর মধ্যে রয়েছে [[প্রোলিন]] ([[:en:Proline|proline]]) এবং হাইড্রোক্সিপ্রোলিন ([[:en:Hydroxyproline|hydroxyproline]]), যেগুলো [[অ্যামিন|সেকেন্ডারি অ্যামাইন]] ([[:en:Secondary_amine|secondary amines]]) এর অন্তর্ভুক্ত । পূর্বে এগুলিকে প্রায়শই ''ইমিনো অ্যাসিড'' বলা হত, যেটি ছিল একটি ভুল নাম, কারণ এগুলোতে কোন ইমাইন গ্রুপিং (HN=C) থাকে না । <ref name="goldbook2">{{GoldBookRef|file=I02959|title=Imino acids}}Retrieved 2 April 2012</ref> তথাপিও, পুরাতন নামটি প্রায়শই ব্যবহৃত হয়। |
|||
=== সমরুপতা বা আইসোমেরিজম === |
|||
অ্যামিনো অ্যাসিডের সাধারণ প্রাকৃতিক রুপগুলির গঠনে রয়েছে -NH<sub>3</sub><sup>+</sup> (প্রোলিনের ক্ষেত্রে -NH<sub>2</sub><sup>+</sup>-) এবং -CO<sub>2</sub><sup>-</sup> কার্যকরী মূলক একই C পরমাণুর সাথে সংযুক্ত থাকে, এবং এইকারণে এরা α-অ্যামিনো অ্যাসিড শ্রেণীভুক্ত। অ্যাকাইরাল [[গ্লাইসিন]] ([[:en:Glycine|glycin]]) বাদে, সকল প্রাকৃতিক অ্যামিনো অ্যাসিডের <small>এল</small> কনফিগারেশন রয়েছে, <ref name="Creighton">{{বই উদ্ধৃতি|শিরোনাম=Proteins: structures and molecular properties|শেষাংশ=Creighton|প্রথমাংশ=Thomas H.|অধ্যায়ের-ইউআরএল=https://archive.org/details/proteinsstructur0000crei|বছর=1993|প্রকাশক=W. H. Freeman|অধ্যায়=Chapter 1|আইএসবিএন=978-0-7167-7030-5}}</ref> এবং এগুলো শুধুমাত্র রাইবোসোমে রুপান্তরণের (translation) সময় [[প্রোটিন|প্রোটিনে]] ([[:en:Protein|proteins]]) পাওয়া যায়। |
|||
অ্যামিনো অ্যাসিড কনফিগারেশনের <small>এল</small> এবং <small>ডি</small> নিয়মটি অ্যামিনো অ্যাসিডের নিজস্ব আলোক ক্রিয়াকে (optical activity) বোঝায় না বরং [[গ্লিসারাল্ডিহাইড|গ্লিসারালডিহাইডের]] ([[:en:Glyceraldehyde|glyceraldehyde]]) আইসোমারের আলোক ক্রিয়াকে বোঝায় যেখান থেকে তাত্ত্বিকভাবে অ্যামিনো অ্যাসিড সংশ্লেষিত হতে পারে ( <small>ডি</small> -গ্লিসারালডিহাইড ডান-ঘূর্ণীঃ dextrorotatory ; <small>এল</small> -গ্লিসারালডিহাইড বাম-ঘূর্ণীঃ levorotatory)। |
|||
একটি বিকল্প নিয়ম হল, ''পরম কনফিগারেশন'' নির্দিষ্ট করার জন্য ( <nowiki><i id="mwqA">S</i></nowiki> ) এবং ( <nowiki><i id="mwqQ">R</i></nowiki> ) নির্দেশক ([[:en:Cahn–Ingold–Prelog_priority_rules|(''S'') and (''R'') designators]]) ব্যবহার করা। <ref name="Cahn" /> প্রোটিনের প্রায় সমস্ত অ্যামিনো অ্যাসিডের α কার্বন ( ''S'' ) রুপে থাকে, যার মধ্যে সিস্টাইন ( ''R'' ) এবং [[গ্লাইসিন]] অ- কাইরাল। <ref>{{ওয়েব উদ্ধৃতি|শেষাংশ=Hatem|প্রথমাংশ=Salama Mohamed Ali|বছর=2006|প্রকাশক=University of Giessen|শিরোনাম=Gas chromatographic determination of Amino Acid Enantiomers in tobacco and bottled wines|ইউআরএল=http://geb.uni-giessen.de/geb/volltexte/2006/3038/index.html|ইউআরএল-অবস্থা=dead|আর্কাইভের-ইউআরএল=https://web.archive.org/web/20090122104055/http://geb.uni-giessen.de/geb/volltexte/2006/3038/index.html|আর্কাইভের-তারিখ=22 January 2009|সংগ্রহের-তারিখ=17 November 2008}}</ref> অন্যান্য অ্যামিনো অ্যাসিডের মতো একই জ্যামিতিক অবস্থানে সিস্টাইনের পার্শ্ব-শিকল রয়েছে, কিন্তু ''R'' / ''S'' পরিভাষাটি বিপরীত; কারণ কার্বক্সিল অক্সিজেনের তুলনায় [[গন্ধক|সালফারের]] পারমাণবিক সংখ্যা বেশি, তাই '''ক্যান-ইনগোল্ড-প্রিলোগ এর অনুক্রম নিয়ম ([[:en:Cahn–Ingold–Prelog_priority_rules#:~:text=The_Cahn%E2%80%93Ingold%E2%80%93Prelog_(,name_a_stereoisomer_of_a|Cahn-Ingold-Prelog sequence rules]])''' মতে পার্শ্ব চেইন উচ্চতর অগ্রাধিকার পেয়ে থাকে, বিপরীতে কার্বক্সিল গ্রুপের তুলনায় বেশিরভাগ অন্যান্য পার্শ্ব -শিকলে পরমাণুগুলি তাদের কম অগ্রাধিকার দেয়। <ref name="Cahn">{{সাময়িকী উদ্ধৃতি|শেষাংশ=Cahn, R.S.|শেষাংশ২=Ingold, C.K.|বছর=1966|শিরোনাম=Specification of Molecular Chirality|পাতাসমূহ=385–415|doi=10.1002/anie.196603851}}</ref> |
|||
<nowiki><small id="mwvQ">ডি</small></nowiki> -অ্যামিনো অ্যাসিডের অবশিষ্ট ([[:en:D-Amino_acid|<small>D</small>-amino acid residues]]) কিছু প্রোটিনে পাওয়া যায়, কিন্তু তারা বিরল। |
|||
=== পার্শ্ব-শিকল সমূহ === |
|||
অ্যামিনো অ্যাসিডগুলিকে α- হিসাবে মনোনীত করা হয় যখন অ্যামিনো নাইট্রোজেন পরমাণু α-কার্বনের সাথে সংযুক্ত থাকে, কার্বন পরমাণুটি কার্বক্সিলেট গ্রুপের পাশেই থাকে। |
|||
নীচের সব ক্ষেত্রে <math>\mathrm{p}K_\mathrm{a}</math> মান (যদি থাকে) প্রোটিনের মধ্যে অ্যামিনো অ্যাসিডের অবশিষ্টাংশ হিসাবে গ্রুপগুলির আয়নীকরণ মান বুঝায়। তারা মুক্ত অ্যামিনো অ্যাসিডের <math>\mathrm{p}K_\mathrm{a}</math> মান নির্দেশ করে না (যার সামান্য প্রাণ-রাসায়নিক গুরুত্ব আছে)। |
|||
==== আলিফ্যাটিক পার্শ্ব-শিকল সমূহ ==== |
|||
বেশ কয়েকটি পার্শ্ব-শিকলে শুধুমাত্র H এবং C থাকে এবং আয়নিত হয় না। এগুলি নিম্নরূপ (বন্ধনীতে তিন- এবং এক-অক্ষরের চিহ্ন সহ): |
|||
[[চিত্র:Proline01.png|ডান|থাম্ব| প্রোলিনের গঠন]] |
|||
* [[গ্লাইসিন]] (গ্লাই, জি): (Gly, G): H- |
|||
* [[অ্যালানিন|অ্যালানাইন]] (আলা, এ): (Ala, A): CH<sub>3</sub>- |
|||
* ভ্যালাইন (ভাল, ভি): (Val, V): (CH<sub>3</sub>)<sub>2</sub>CH- |
|||
* লিউসিন (লিউ, এল): (Leu, L) (CH<sub>3</sub>)<sub>2</sub>CHCH<sub>2</sub>- |
|||
* আইসোলিউসিন (ইলে, আই):(Ile, I):CH<sub>3</sub>CH<sub>2</sub>CH(CH<sub>3</sub>) |
|||
* [[প্রোলিন]] (প্রো, পি): (Pro, P): -CH<sub>2</sub>CH<sub>2</sub>CH<sub>2</sub>- অ্যামিনের উপর চাক্রিক কাঠামোকৃত (cyclized onto the amine) |
|||
==== নিরপেক্ষ মেরুক পার্শ্ব-শিকলসমূহ (Polar neutral side-chains) ==== |
|||
দুটি অ্যামিনো অ্যাসিড অ্যালকোহল যুক্ত পার্শ্ব-শিকল ধারণ করে। এগুলি স্বাভাবিক অবস্থায় আয়নিত হয় না, যদিও একটি অ্যামিনো অ্যাসিড যার নাম সেরিন, সেটি [[সেরিন প্রোটিজ|সেরিন প্রোটিস]] ([[:en:Serine_protease#Catalytic_mechanism|serine proteases]]) দ্বারা প্রভাবনের (catalysis) সময় প্রোটন-বর্জিত (deprotonated:ডিপ্রোটোনেটেড) হয়ে যায়: এটি একটি খুবই ব্যতিক্রমী উদাহরণ, এবং সাধারণভাবে তা সেরিন অবশিষ্টাংশের (serine residues) বৈশিষ্ট্য নয়। |
|||
* সেরিন (Ser, S, https://wikimedia.org/api/rest_v1/media/math/render/svg/b030798b388df75544df8fc8c18fd46eaaf59a9b নাই, যখন খুবই ব্যতিক্রমী না হয়): HOCH<sub>2</sub>- |
|||
* থ্রিওনিন (Thr, T, https://wikimedia.org/api/rest_v1/media/math/render/svg/b030798b388df75544df8fc8c18fd46eaaf59a9b নাই ): CH<sub>3</sub>CHOH- |
|||
থ্রিওনিনের দুটি কাইরাল কেন্দ্র রয়েছে, শুধুমাত্র অ-কাইরাল গ্লাইসিন বাদে সমস্ত অ্যামিনো অ্যাসিডের সাধারণ α-কার্বনে যে <small>এল</small> (2 ''S'' ) কাইরাল কেন্দ্র আছে তা নয়, বরং β-কার্বনেও (3 ''R'' ) রয়েছে । সম্পূর্ণ স্টেরিও-রাসায়নিক বৈশিষ্টরুপ (stereochemical specification) হল <small>এল</small> -থ্রিওনিন (2 ''S'' ,3 ''R'' )। |
|||
==== অ্যামাইড পার্শ্ব-শিকলসমূহ ==== |
|||
দুটি অ্যামিনো অ্যাসিডের অ্যামাইড পার্শ্ব-শিকল রয়েছে, যা নিম্নরূপ: |
|||
* অ্যাস্পারাজিন (Asn, N): NH<sub>2</sub>COCH<sub>2</sub>- |
|||
* গ্লুটামিন (Gln, Q): NH<sub>2</sub>COCH<sub>2</sub>CH<sub>2</sub>- |
|||
এই পার্শ্ব-শিকলগুলি pH-এর স্বাভাবিক পরিসরে আয়নিত হয় না। |
|||
==== সালফারযুক্ত পার্শ্ব-শিকলসমূহ ==== |
|||
দুটি পার্শ্ব-শিকলে সালফার পরমাণু থাকে, যার মধ্যে একটি সাধারণ পরিসরে আয়নিত হয় ( <math>\mathrm{p}K_\mathrm{a}</math> নির্দেশিত) এবং অন্যটি করে না: |
|||
* সিস্টাইন (Cys, C, <math>\mathrm{p}K_\mathrm{a} = 8.3</math> ): SHCH<sub>2</sub>- |
|||
* মেথিওনিন(Met, M, <math>\mathrm{p}K_\mathrm{a}</math> নাই): CH<sub>3</sub>SCH<sub>2</sub>CH<sub>2</sub>- |
|||
==== অ্যারোমেটিক পার্শ্ব-শিকলসমূহ ==== |
|||
[[চিত্র:Aromatic_amino_acid_side-chains.png|থাম্ব|360x360পিক্সেল| ফিনাইল অ্যালানিনের পার্শ্ব-চেইন (বামে), টাইরোসিন (মাঝখানে) এবং ট্রিপটোফ্যান (ডানে)]] |
|||
চিত্রে পার্শ্ব-চেইন হিসাবে অ্যারোমেটিক বলয় যুক্ত তিনটি অ্যামিনো অ্যাসিডের গঠন দেখানো হয়েছে। এর মধ্যে, টাইরোসিন স্বাভাবিক পরিসরে আয়নিত করে; অন্য দুটি করে না)। |
|||
* ফিনাইল অ্যালানিন (Phe, F, <math>\mathrm{p}K_\mathrm{a}</math> নাই ): চিত্রে বামে |
|||
* টাইরোসিন(Tyr, Y, <math>\mathrm{p}K_\mathrm{a} = 9.6</math>) চিত্রে মাঝখানে |
|||
* [[ট্রিপ্টোফ্যান|ট্রিপটোফ্যান]] (Trp, W, <math>\mathrm{p}K_\mathrm{a}</math>নাই ): চিত্রে ডানে |
|||
==== ঋণাত্মক-ধর্মী (Anionic) পার্শ্ব-শিকলসমূহ ==== |
|||
দুটি অ্যামিনো অ্যাসিডের সাইড-চেইন রয়েছে যা সাধারণ pH-এ অ্যাানায়ন। যদিও ভুল নামটি এতটাই বিস্তৃত যে তা শুধরানোর নয়, তবে এগুলিকে ''অ্যাসিডিক অ্যামিনো অ্যাসিড'' বলা উচিত '''নয়''', কারণ তারা পেপসিনের মতো এনজাইমগুলি ব্যতীত সমস্ত ক্ষেত্রে [[ব্রনস্টেড-লাউরি অম্ল-ক্ষার তত্ত্ব|ব্রনস্টেড '''বেস''']] হিসাবে কাজ করে, অন্যদিকে পেপসিন স্তন্যপায়ী পাকস্থলীর মতো খুব কম pH-এর পরিবেশেও কাজ করে। |
|||
* [[অ্যাস্পার্টিক অ্যাসিড|অ্যাসপার্টেট]] ("অ্যাসপার্টিক অ্যাসিড '''নয়''' ", D, <math>\mathrm{p}K_\mathrm{a} = 4.1</math>): O<sub>2</sub>CCH<sub>2</sub>- |
|||
* [[গ্লুটামিক অ্যাসিড|গ্লুটামেট]] ( "গ্লুটামিক অ্যাসিড '''নয়''' ", Glu, E, <math>\mathrm{p}K_\mathrm{a} = 4.5</math>): <sup>-</sup>O<sub>2</sub>CCH<sub>2</sub>CH<sub>2</sub>- |
|||
==== ধণাত্মক-ধর্মী (Cationic) পার্শ্ব-শিকলসমূহ ==== |
|||
[[চিত্র:Side-chains_of_His,_Lys_and_Arg.png|থাম্ব|450x450পিক্সেল| হিস্টিডিনের সাইড-চেইন (বামে), লাইসিন (মাঝখানে) এবং আরজিনিন (ডা্নে)]] |
|||
সাইড-চেইন সহ তিনটি অ্যামিনো অ্যাসিড রয়েছে যা নিরপেক্ষ pH-এ ক্যাটায়ন (যদিও একটিতে যার নাম হিস্টিডিন, ক্যাটায়নিক এবং নিরপেক্ষ উভয় রুপই বিদ্যমান)। এগুলিকে সাধারণত ''ক্ষারীয় অ্যামিনো অ্যাসিড'' বলা হয়, কিন্তু এই শব্দটি বিভ্রান্তিকর: হিস্টিডিন, নিরপেক্ষ pH এ, ব্রনস্টেড অম্ল এবং ব্রনস্টেড ক্ষার উভয় হিসাবেই কাজ করতে পারে, লাইসিন ব্রনস্টেড অম্ল হিসাবে কাজ করে এবং আরজিনিনের একটি নির্দিষ্ট ধনাত্মক চার্জ থাকে এবং এটি নিরপেক্ষ অবস্থায় আয়নিত হয় না। । ''হিস্টিডিনিয়াম, লাইসিনিয়াম'' ''এবং আর্জিনিনিয়াম'' নামগুলি এদের গঠনগুলোর জন্য আরও সঠিক নাম হত, তবে মূলত এগুলোর প্রচলন নেই। |
|||
[[চিত্র:Ionization_of_groups_in_proteins.png|বাম|থাম্ব|468x468পিক্সেল| এন-টার্মিনাল অ্যামিনো, সি-টার্মিনাল কার্বক্সিলেট এবং অ্যামিনো অ্যাসিড অবশিষ্টাংশের পার্শ্ব চেইনগুলির আয়নকরণ এবং ব্রোন্সটেড চরিত্র]] |
|||
[[চিত্র:Amino_Acid_Titration_Curves_By_Side_Chain.png|ডান|থাম্ব|360x360পিক্সেল| সাইড চেইন বিভাগ দ্বারা গোষ্ঠীভুক্ত বিশটি প্রোটিনোজেনিক অ্যামিনো অ্যাসিডের টাইট্রেশন বক্ররেখার সংমিশ্রণ]] |
|||
=== আদর্শ অ্যামিনো অ্যাসিডসমূহের নাম-সংক্ষেপণ এবং বৈশিষ্ট্যের সারণী === |
|||
{{মূল নিবন্ধ|Proteinogenic amino acid}} |
|||
যদিও এক-অক্ষরের চিহ্নগুলি টেবিলে অন্তর্ভুক্ত করা হয়েছে, IUPAC-IUBMB <ref name="iupaciub">{{ওয়েব উদ্ধৃতি|বছর=1983|প্রকাশক=IUPAC-IUB Joint Commission on Biochemical Nomenclature|শিরোনাম=Nomenclature and Symbolism for Amino Acids and Peptides|ইউআরএল=http://www.chem.qmul.ac.uk/iupac/AminoAcid/AA1n2.html|ইউআরএল-অবস্থা=dead|আর্কাইভের-ইউআরএল=https://web.archive.org/web/20081009023202/http://www.chem.qmul.ac.uk/iupac/AminoAcid/AA1n2.html|আর্কাইভের-তারিখ=9 October 2008|সংগ্রহের-তারিখ=17 November 2008}}</ref> এর সুপারিশ মতে, "এক-অক্ষরের চিহ্নগুলির ব্যবহার দীর্ঘ ক্রমগুলির তুলনায় সীমিত করা উচিত"। |
|||
{| class="wikitable sortable" style="text-align:center;" |
|||
! rowspan="2" |অ্যামিনো অ্যাসিড |
|||
! colspan="2" |৩- ও ১-অক্ষর প্রতিকসমূহ |
|||
! colspan="3" |পার্শ্ব-শিকল |
|||
! rowspan="2" |Hydropathy <nowiki><br id="mwAeU"></nowiki><nowiki><br></nowiki>index<ref>{{সাময়িকী উদ্ধৃতি|vauthors=Kyte J, Doolittle RF|তারিখ=May 1982|শিরোনাম=A simple method for displaying the hydropathic character of a protein|পাতাসমূহ=105–132|citeseerx=10.1.1.458.454|doi=10.1016/0022-2836(82)90515-0|pmid=7108955}}</ref> |
|||
! colspan="2" |Molar absorptivity |
|||
! rowspan="2" |[[আণবিক ভর|Molecular mass]] |
|||
! rowspan="2" |Abundance in<br /><br />proteins (%)<ref>{{সাময়িকী উদ্ধৃতি|vauthors=Kozlowski LP|তারিখ=January 2017|শিরোনাম=Proteome-p''I'': proteome isoelectric point database|পাতাসমূহ=D1112–D1116|doi=10.1093/nar/gkw978|pmc=5210655|pmid=27789699}}</ref> |
|||
! rowspan="2" |Standard genetic coding,<br /><br />IUPAC notation |
|||
|- |
|||
!৩ |
|||
!১ |
|||
!শ্রেণী |
|||
!মেরুতা<ref name="Hausman">{{বই উদ্ধৃতি|শিরোনাম=The cell: a molecular approach|শেষাংশ=Hausman|প্রথমাংশ=Robert E.|শেষাংশ২=Cooper|প্রথমাংশ২=Geoffrey M.|বছর=2004|প্রকাশক=ASM Press|পাতা=51|আইএসবিএন=978-0-87893-214-6}}</ref> |
|||
!Net charge<br /><br />at pH{{Spaces}}7.4<ref name="Hausman" /> |
|||
!Wavelength,<br /><br />''λ''<sub>max</sub> (nm) |
|||
!Coefficient ''ε''<br /><br />(mM<sup>−1</sup>·cm<sup>−1</sup>) |
|||
|- |
|||
|[[অ্যালানিন|Alanine]] |
|||
|Ala |
|||
|A |
|||
|Aliphatic |
|||
|Nonpolar |
|||
|Neutral |
|||
|1.8 |
|||
| |
|||
| |
|||
|89.094 |
|||
|8.76 |
|||
|GCN |
|||
|- |
|||
|Arginine |
|||
|Arg |
|||
|R |
|||
|Fixed cation |
|||
|Basic polar |
|||
|Positive |
|||
|−4.5 |
|||
| |
|||
| |
|||
|174.203 |
|||
|5.78 |
|||
|MGR, CGY |
|||
|- |
|||
|Asparagine |
|||
|Asn |
|||
|N |
|||
|Amide |
|||
|Polar |
|||
|Neutral |
|||
|−3.5 |
|||
| |
|||
| |
|||
|132.119 |
|||
|3.93 |
|||
|AAY |
|||
|- |
|||
|[[অ্যাস্পার্টিক অ্যাসিড|Aspartate]] |
|||
|Asp |
|||
|D |
|||
|Anion |
|||
|Brønsted base |
|||
|Negative |
|||
|−3.5 |
|||
| |
|||
| |
|||
|133.104 |
|||
|5.49 |
|||
|GAY |
|||
|- |
|||
|Cysteine |
|||
|Cys |
|||
|C |
|||
|Thiol |
|||
|Brønsted acid |
|||
|Neutral |
|||
|2.5 |
|||
|250 |
|||
|0.3 |
|||
|121.154 |
|||
|1.38 |
|||
|UGY |
|||
|- |
|||
|Glutamine |
|||
|Gln |
|||
|Q |
|||
|Amide |
|||
|Polar |
|||
|Neutral |
|||
|−3.5 |
|||
| |
|||
| |
|||
|146.146 |
|||
|3.9 |
|||
|CAR |
|||
|- |
|||
|[[গ্লুটামিক অ্যাসিড|Glutamate]] |
|||
|Glu |
|||
|E |
|||
|Anion |
|||
|Brønsted base |
|||
|Negative |
|||
|−3.5 |
|||
| |
|||
| |
|||
|147.131 |
|||
|6.32 |
|||
|GAR |
|||
|- |
|||
|[[গ্লাইসিন|Glycine]] |
|||
|Gly |
|||
|G |
|||
|Aliphatic |
|||
|Nonpolar |
|||
|Neutral |
|||
|−0.4 |
|||
| |
|||
| |
|||
|75.067 |
|||
|7.03 |
|||
|GGN |
|||
|- |
|||
|Histidine |
|||
|His |
|||
|H |
|||
|Aromatic cation |
|||
|Brønsted acid and base |
|||
|Positive, 10%<br /><br />Neutral, 90% |
|||
|−3.2 |
|||
|211 |
|||
|5.9 |
|||
|155.156 |
|||
|2.26 |
|||
|CAY |
|||
|- |
|||
|Isoleucine |
|||
|Ile |
|||
|I |
|||
|Aliphatic |
|||
|Nonpolar |
|||
|Neutral |
|||
|4.5 |
|||
| |
|||
| |
|||
|131.175 |
|||
|5.49 |
|||
|AUH |
|||
|- |
|||
|Leucine |
|||
|Leu |
|||
|L |
|||
|Aliphatic |
|||
|Nonpolar |
|||
|Neutral |
|||
|3.8 |
|||
| |
|||
| |
|||
|131.175 |
|||
|9.68 |
|||
|YUR, CUY |
|||
|- |
|||
|[[লাইসিন|Lysine]] |
|||
|Lys |
|||
|K |
|||
|Cation |
|||
|Brønsted acid |
|||
|Positive |
|||
|−3.9 |
|||
| |
|||
| |
|||
|146.189 |
|||
|5.19 |
|||
|AAR |
|||
|- |
|||
|Methionine |
|||
|Met |
|||
|M |
|||
|Thioether |
|||
|Nonpolar |
|||
|Neutral |
|||
|1.9 |
|||
| |
|||
| |
|||
|149.208 |
|||
|2.32 |
|||
|AUG |
|||
|- |
|||
|Phenylalanine |
|||
|Phe |
|||
|F |
|||
|Aromatic |
|||
|Nonpolar |
|||
|Neutral |
|||
|2.8 |
|||
|257, 206, 188 |
|||
|0.2, 9.3, 60.0 |
|||
|165.192 |
|||
|3.87 |
|||
|UUY |
|||
|- |
|||
|[[প্রোলিন|Proline]] |
|||
|Pro |
|||
|P |
|||
|Cyclic |
|||
|Nonpolar |
|||
|Neutral |
|||
|−1.6 |
|||
| |
|||
| |
|||
|115.132 |
|||
|5.02 |
|||
|CCN |
|||
|- |
|||
|Serine |
|||
|Ser |
|||
|S |
|||
|Hydroxylic |
|||
|Polar |
|||
|Neutral |
|||
|−0.8 |
|||
| |
|||
| |
|||
|105.093 |
|||
|7.14 |
|||
|UCN, AGY |
|||
|- |
|||
|Threonine |
|||
|Thr |
|||
|T |
|||
|Hydroxylic |
|||
|Polar |
|||
|Neutral |
|||
|−0.7 |
|||
| |
|||
| |
|||
|119.119 |
|||
|5.53 |
|||
|ACN |
|||
|- |
|||
|[[ট্রিপ্টোফ্যান|Tryptophan]] |
|||
|Trp |
|||
|W |
|||
|Aromatic |
|||
|Nonpolar |
|||
|Neutral |
|||
|−0.9 |
|||
|280, 219 |
|||
|5.6, 47.0 |
|||
|204.228 |
|||
|1.25 |
|||
|UGG |
|||
|- |
|||
|Tyrosine |
|||
|Tyr |
|||
|Y |
|||
|Aromatic |
|||
|Brønsted acid |
|||
|Neutral |
|||
|−1.3 |
|||
|274, 222, 193 |
|||
|1.4, 8.0, 48.0 |
|||
|181.191 |
|||
|2.91 |
|||
|UAY |
|||
|- |
|||
|ভ্যালিন |
|||
|Val |
|||
|V |
|||
|Aliphatic |
|||
|Nonpolar |
|||
|Neutral |
|||
|4.2 |
|||
| |
|||
| |
|||
|117.148 |
|||
|6.73 |
|||
|GUN |
|||
|} |
|||
{| class="wikitable" style="text-align:center;" |
|||
!দ্ব্যর্থবোধক |
|||
অ্যামিনো অ্যাসিড |
|||
!৩-অক্ষর |
|||
!১-অক্ষর |
|||
!অন্তর্ভুক্ত অ্যামিনো অ্যাসিডগুলি |
|||
!অন্তর্ভুক্তকডনস (Codons ) |
|||
|- |
|||
|Any / unknown |
|||
|Xaa |
|||
|X |
|||
|All |
|||
|NNN |
|||
|- |
|||
|Asparagine or aspartic acid |
|||
|Asx |
|||
|B |
|||
|D, N |
|||
|RAY |
|||
|- |
|||
|Glutamine or glutamic acid |
|||
|Glx |
|||
|Z |
|||
|E, Q |
|||
|SAR |
|||
|- |
|||
|Leucine or isoleucine |
|||
|Xle |
|||
|J |
|||
|I, L |
|||
|YTR, ATH, CTY |
|||
|- |
|||
|Hydrophobic |
|||
| |
|||
|Φ |
|||
|V, I, L, F, W, Y, M |
|||
|NTN, TAY, TGG |
|||
|- |
|||
|Aromatic |
|||
| |
|||
|Ω |
|||
|F, W, Y, H |
|||
|YWY, TTY, TGG |
|||
|- |
|||
|[[অ্যালিফ্যাটিক হাইড্রোকার্বন|Aliphatic]] (non-aromatic) |
|||
| |
|||
|Ψ |
|||
|V, I, L, M |
|||
|VTN, TTR |
|||
|- |
|||
|Small |
|||
| |
|||
|π |
|||
|P, G, A, S |
|||
|BCN, RGY, GGR |
|||
|- |
|||
|Hydrophilic |
|||
| |
|||
|ζ |
|||
|S, T, H, N, Q, E, D, K, R |
|||
|VAN, WCN, CGN, AGY |
|||
|- |
|||
|[[আয়ন|Positively-charged]] |
|||
| |
|||
| + |
|||
|K, R, H |
|||
|ARR, CRY, CGR |
|||
|- |
|||
|[[আয়ন|Negatively-charged]] |
|||
| |
|||
|− |
|||
|D, E |
|||
|GAN |
|||
|} |
|||
== প্রাণ রসায়নে প্রাপ্তিতা এবং কার্যাবলী == |
|||
{{multiple image |
|||
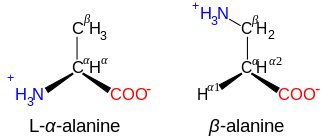
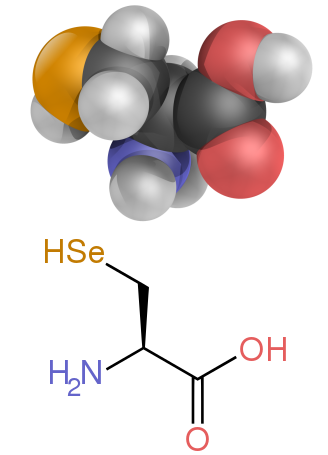
<!-- Layout parameters -->|align=right|alt6=Diagrammatic comparison of the structures of β-alanine and α-alanine|height7=|width7=|alt7=A diagram showing the structure of selenocysteine|image7=Selenocysteine skeletal 3D.svg|caption6=β-Alanine and its α-alanine isomer |
|||
<!--image 7-->|height6=|width6=|image6=Beta alanine comparison.svg|direction=vertical|caption5=A [[polypeptide]] is an unbranched chain of amino acids |
|||
<!--image 6-->|height5=|width5=|alt5=A protein depicted as a long unbranched string of linked circles each representing amino acids|image5=Protein primary structure.svg|header=<!--image 5-->|header_align=<!-- center (default), left, right -->|total_width=340 |
|||
<!-- Header -->|caption7=The amino acid [[selenocysteine]]}} |
|||
[[Category:Pages using multiple image with auto scaled images]] |
|||
কার্বক্সিল গ্রুপের পাশে [[আলফা এবং বিটা কার্বন|(আলফা-) কার্বন]] পরমাণুর সাথে অ্যামাইন গ্রুপ যুক্ত অ্যামিনো অ্যাসিডগুলির বিশেষ গুরুত্ব রয়েছে। এগুলি '''2-''', '''আলফা-''' বা '''α-অ্যামিনো অ্যাসিড''' নামে পরিচিত (বেশীরভাগ ক্ষেত্রে সাধারণ সংকেত H<sub>2</sub>NCHRCOOH যেখানে R হল একটি [[জৈব রসায়ন|জৈব]] প্রতিস্থাপক যা " পার্শ্ব চেইন " নামে পরিচিত); <ref>{{Cite web|last=Clark|first=Jim|date=August 2007|title=An introduction to amino acids|url=http://www.chemguide.co.uk/organicprops/aminoacids/background.html|access-date=4 July 2015|website=chemguide}}</ref> তবে, প্রায়শই "অ্যামিনো অ্যাসিড" শব্দটি বিশেষভাবে এগুলোর জন্য ব্যবহৃত হয়। এর মধ্যে রয়েছে 22টি প্রোটিনোজেনিক ("প্রোটিন-বিল্ডিং") অ্যামিনো অ্যাসিড, <ref>{{বিশ্বকোষ উদ্ধৃতি|বিশ্বকোষ=Peptides from A to Z: A Concise Encyclopedia}}</ref> <ref>{{বই উদ্ধৃতি|শিরোনাম=Unnatural Amino Acids: Methods and Protocols|বছর=2012|ধারাবাহিক=Methods in Molecular Biology|প্রকাশক=Humana Press|পাতা=v|doi=10.1007/978-1-61779-331-8|আইএসবিএন=978-1-61779-331-8|oclc=756512314}}</ref> <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Hertweck C|তারিখ=October 2011|শিরোনাম=Biosynthesis and Charging of Pyrrolysine, the 22nd Genetically Encoded Amino Acid|পাতাসমূহ=9540–9541|doi=10.1002/anie.201103769|pmid=21796749}}{{Closed access}} |
|||
</ref> যা পেপটাইড চেইনে ("পলিপেপটাইড") একত্রিত হয়ে [[প্রোটিন|প্রোটিনের]] বিশাল বিন্যাসের গাঠনিক ব্লকসমূহ তৈরি করে। <ref name="NIGMS">{{ওয়েব উদ্ধৃতি|তারিখ=27 October 2011|প্রকাশক=National Institute of General Medical Sciences|শিরোনাম=Chapter 1: Proteins are the Body's Worker Molecules|ইউআরএল=http://publications.nigms.nih.gov/structlife/chapter1.html|ইউআরএল-অবস্থা=dead|আর্কাইভের-ইউআরএল=https://web.archive.org/web/20140607084902/http://publications.nigms.nih.gov/structlife/chapter1.html|আর্কাইভের-তারিখ=7 June 2014|সংগ্রহের-তারিখ=20 May 2008|ওয়েবসাইট=The Structures of Life}}</ref> এগুলি সবই <small>এল</small> - স্টেরিওইসোমার (" বাম-হাতি/ঘূর্ণী " অ্যানানশিওমার ), যদিও কিছু <small>ডি</small> -অ্যামিনো অ্যাসিড ("ডান-হাতি/ঘূর্ণী") ব্যাকটেরিয়গত পর্দায় ([[:en:Bacterial_envelope|bacterial envelopes]]), নিউরোমোডুলেটর ( <small>ডি</small> - সেরিন ) হিসাবে এবং কিছু [[অ্যান্টিবায়োটিক]] পদার্থে দেখা যায়। <ref>{{বই উদ্ধৃতি|শিরোনাম=Biochemical Pathways: An Atlas of Biochemistry and Molecular Biology|বছর=2012|প্রকাশক=Wiley-Blackwell|পাতা=5|আইএসবিএন=978-0-470-14684-2|সংস্করণ=2nd}}</ref> |
|||
[[Category:Pages using multiple image with manual scaled images]] |
|||
{{Catecholamine and trace amine biosynthesis|align=right|caption=[[Catecholamine]]s and [[trace amine]]s are synthesized from phenylalanine and tyrosine in humans.}} |
|||
[[চিত্র:Peptidformationball.svg|alt=Two amino acids are shown next to each other. One loses a hydrogen and oxygen from its carboxyl group (COOH) and the other loses a hydrogen from its amino group (NH2). This reaction produces a molecule of water (H2O) and two amino acids joined by a peptide bond (–CO–NH–). The two joined amino acids are called a dipeptide.|ডান|থাম্ব|400x400পিক্সেল| দুটি অ্যামিনো অ্যাসিডের ঘনীভবন দ্বারা একটি দ্বি-পেপটাইড গঠন। দুটি অ্যামিনো অ্যাসিডের ''অবশিষ্টাংশ (residues)'' একটি ''[[পেপটাইড বন্ধন]]'' দ্বারা যুক্ত থাকে।]] |
|||
{{টীকা তালিকা}} |
|||
== তথ্যসূত্র == |
|||
<nowiki> |
|||
[[বিষয়শ্রেণী:নাইট্রোজেন চক্র]] |
|||
[[বিষয়শ্রেণী:অ্যামিনো অ্যাসিড]] |
|||
[[বিষয়শ্রেণী:Category:জুইটারায়ন]]</nowiki> |
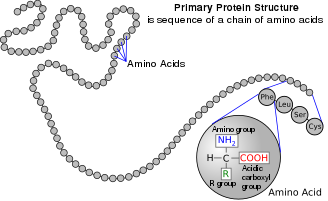
|||
০৩:২৬, ৫ মার্চ ২০২২ তারিখে সংশোধিত সংস্করণ

অ্যামিনো অ্যাসিড হল জৈব যৌগ যাতে অ্যামিনো এবং কার্বক্সিলেট ফাংশনাল গ্রুপ বিদ্যমান থাকে, সাথে প্রতিটি অ্যামিনো অ্যাসিডের জন্য নির্দিষ্ট একটি সাইড চেইনও (R গ্রুপ) থাকে।[১] নেলসন, ডেভিড এল.; কক্স, মাইকেল এম. (২০০৫), Principles of Biochemistry (৪র্থ সংস্করণ), নিউ ইয়র্ক: ডব্লিউ. এইচ. ফ্রিম্যান, আইএসবিএন 0-7167-4339-6 প্রতিটি অ্যামিনো অ্যাসিডে উপস্থিত উপাদানগুলি হল কার্বন (C), হাইড্রোজেন (H), অক্সিজেন (O), এবং নাইট্রোজেন (N); এছাড়াও সিস্টাইন এবং মেথিওনিনের পার্শ্ব শৃঙ্খলে সালফার (S) থাকে এবং কম প্রচলিত অ্যামিনো অ্যাসিড, যেমনসেলেনোসিস্টাইনে সেলেনিয়াম (Se) উপস্থিত থাকে। ২০২০-এর হিসাব অনুযায়ী[হালনাগাদ], ৫০০ টিরও বেশি প্রাকৃতিকভাবে প্রাপ্ত অ্যামিনো অ্যাসিড পেপটাইড যৌগসমূহের মনোমার একক গঠন করে বলে জানা যায়, যেসব পেপটাইড যৌগসমূহের মধ্যে প্রোটিনও অন্তর্ভুক্ত। [২] (যদিও জেনেটিক কোডে মাত্র 20টি দেখা যায়, অতিরিক্ত দেখা যায় সেলেনোসিস্টাইন, যা একটি বিশেষ উপায়ে এনকোড করা হয়)। [৩]
জৈব-রাসায়নিক নামকরণের যৌথ কমিশন[৪] (Joint Commission on Biochemical Nomenclature) অ্যামিনো অ্যাসিডসমূহের আনুষ্ঠানিক নাম প্রদান করেঃ এক্ষেত্রে তারা চিত্রে দেখানো অ্যামিনো অ্যাসিডের (এল-অ্যামিনো অ্যাসিড) কাল্পনিক "নিরপেক্ষ" কাঠামোর পরিপ্রেক্ষিতে নামকরণ করে থাকে।
উদাহরণস্বরূপ, অ্যালানিনের পদ্ধতিগত নাম হল 2-অ্যামিনোপ্রোপ্যানোইক অ্যাসিড যা নির্ভর করে এর গাঠনিক সংকেত, CH3-CH(NH2)-COOH এর উপর। উক্ত কমিশন এই পদ্ধতির যথার্থতা নিম্নরূপে তুলে ধরে :
প্রদত্ত পদ্ধতিগত নাম এবং সংকেতগুলো অনুমানমূলক (রাসায়নিক) গঠন নির্দেশ করে যেখানে অ্যামিনো গ্রুপগুলি হাইড্রোজেনমুক্ত (unprotonated) এবং কার্বক্সিল গ্রুপগুলি অবিভাজিত (undissociated)। এই রীতিটি বিভিন্ন নামকরণ সংক্রান্ত সমস্যা এড়ানোর ক্ষেত্রে কার্যকর কিন্তু, এর দ্বারা এমনটা বোঝানো ঠিক হবে না যে এই (গাঠনিক) কাঠামোগুলি অ্যামিনো-অ্যাসিড অণুগুলোর একটি মাত্রা পরিমাণ অংশের প্রতিনিধিত্ব করে।
প্রকারভেদ ও অবস্থান
অ্যামিনো অ্যাসিডগুলোকে মূল কাঠামোগত কার্যকরী মূলকগুলির অবস্থান অনুসারে আলফা- (α-), বিটা- (β-), গামা- (γ-) বা ডেল্টা- (δ-) শ্রেণিতে বিন্যস্ত করা যেতে পারে; অন্যান্য শ্রেণীগুলি রাসায়নিক মেরুতা বা পোলারিটি, আয়নিকরণ, এবং পার্শ্ব-শিকল গ্রুপ টাইপ ( এলিফ্যাটিক, অ্যাসাইক্লিক, অ্যারোমেটিক, হাইড্রক্সিল বা সালফার ধারণকারী, ইত্যাদির সাথে সম্পর্কিত)। অ্যামিনো অ্যাসিডের অবশিষ্টাংশগুলি (residues), প্রোটিনরুপে মানুষের পেশী এবং অন্যান্য টিস্যুগুলির দ্বিতীয় বৃহত্তম গাঠনিক উপাদান (পানি হল বৃহত্তম) হিসেবে বিরাজ করে। [৫] এছাড়া, প্রোটিনের অবশিষ্টাংশ (protein residues) হিসাবে তাদের ভূমিকা ছাড়াও, অ্যামিনো অ্যাসিডগুলি নিউরোট্রান্সমিটার পরিবহন এবং জৈব সংশ্লেষণের মতো অনেকগুলি প্রক্রিয়াতে অংশগ্রহণ করে।
ইতিহাস
প্রথম কয়েকটি অ্যামিনো অ্যাসিড ১৯০০-এর দশকের গোড়ার দিকে আবিষ্কৃত হয়েছিল।[৬][৭] ১৮০৬ সালে ফরাসি রসায়নবিদ লুই-নিকোলাস ভাউকুলিন (Louis-Nicolas Vauquelin) এবং পিয়েরে জিন রবিকেট (Pierre Jean Robiquet) অ্যাসপারাগাস (asparagus) থেকে একটি যৌগ নিষ্কাশন করেছিলেন যা পরবর্তীকালে অ্যাসপারাগিন (asparagus) নামে পরিচিতি পেয়েছিল- এটিই ছিল প্রথম আবিষ্কৃত অ্যামিনো অ্যাসিড।[৮][৯] সিস্টিন (Cystine) আবিষ্কৃত হয়েছিল ১৮১০ সালে,[১০] যদিও এর মনোমার- সিস্টেইন (cysteine) ১৮৮৪ সাল পর্যন্ত অনাবিষ্কৃত ছিল।[১১][ক]
১৮২০ সালে গ্লাইসিন এবং লিউসিন আবিষ্কৃত হয়।[১২] আবিষ্কৃত ২০ টি সাধারণ অ্যামিনো অ্যাসিডের মধ্যে শেষটি ছিল থ্রেওনিন যেটি উইলিয়াম কামিং রোজ (William Cumming Rose) ১৯৩৫ সালে আবিষ্কার করেছিলেন, (এছাড়াও) তিনি অপরিহার্য অ্যামিনো অ্যাসিডও (essential amino acids) নিরুপণ করেছিলেন এবং অত্যানুকুল বৃদ্ধির (optimal growth) জন্য সকল অ্যামিনো অ্যাসিডের ন্যূনতম দৈনিক চাহিদা নির্ধারণ করেছিলেন।[১৩][১৪]
(অ্যামিনো অ্যাসিড) রাসায়নিক যৌগশ্রেণীর একত্ব (unity) ১৮৬৫ সালে বিজ্ঞানী উর্টজ (Wurtz) কর্তৃক প্রথম চিহ্নিত হয়েছিল, তবে তিনি এর কোনও নির্দিষ্ট নাম দেননি।[১৫] ইংরেজি ভাষায় "অ্যামিনো অ্যাসিড" শব্দটির প্রথম ব্যবহার ১৮৯৮ সাল থেকে শুরু হয়,[১৬] আর; জার্মান শব্দ, Aminosäure, এর আগে থেকে ব্যবহৃত হচ্ছিল।[১৭] দেখা যায় যে, এনজাইমঘটিত বিপাকক্রিয়া বা অম্ল পানি-বিশ্লেষণ (অ্যাসিড হাইড্রোলাইসিস-acid hydrolysis) পরবর্তী ধাপে প্রোটিনগুলি অ্যামিনো অ্যাসিড উৎপন্ন করে থাকে। ১৯০২ সালে, এমিল ফিশার (Emil Fischer) এবং ফ্রাঞ্জ হফমেস্টার (Franz Hofmeister) স্বাধীনভাবে প্রস্তাব করেছিলেন যে, প্রোটিনগুলি অনেক অ্যামিনো অ্যাসিড থেকে গঠিত হয়, যার ফলে একটি অ্যামিনো অ্যাসিডের অ্যামিনো গ্রুপের সাথে অন্য অ্যামিনো অ্যাসিডের কার্বোক্সিল গ্রুপের বন্ধন তৈরি হয় , যার ফলে একটি রৈখিক কাঠামো তৈরি হয় যেটিকে বিজ্ঞানী ফিশার "পেপটাইড" (peptide) (পেপটাইড বন্ধন) বলে অভিহিত করেছিলেন।[১৮]
সাধারণ কাঠামো
এই পাতার শীর্ষে দেখানো কাঠামোতে R বলতে প্রতিটি অ্যামিনো অ্যাসিডের জন্য নির্দিষ্ট একটি পার্শ্ব চেইন (side chain) বুঝায়। কার্বক্সিল গ্রুপের (carboxyl group) পাশে থাকা কার্বন (carbon) পরমাণুকে α–কার্বন (α–carbon) বলা হয়। α-কার্বনের সাথে সরাসরি সংযুক্ত একটি অ্যামিনো গ্রুপ (amino group) ধারণকারী অ্যামিনো অ্যাসিডগুলিকে α-অ্যামিনো অ্যাসিড হিসাবে উল্লেখ করা হয়। [১৯] এর মধ্যে রয়েছে প্রোলিন (proline) এবং হাইড্রোক্সিপ্রোলিন (hydroxyproline), যেগুলো সেকেন্ডারি অ্যামাইন (secondary amines) এর অন্তর্ভুক্ত । পূর্বে এগুলিকে প্রায়শই ইমিনো অ্যাসিড বলা হত, যেটি ছিল একটি ভুল নাম, কারণ এগুলোতে কোন ইমাইন গ্রুপিং (HN=C) থাকে না । [২০] তথাপিও, পুরাতন নামটি প্রায়শই ব্যবহৃত হয়।
সমরুপতা বা আইসোমেরিজম
অ্যামিনো অ্যাসিডের সাধারণ প্রাকৃতিক রুপগুলির গঠনে রয়েছে -NH3+ (প্রোলিনের ক্ষেত্রে -NH2+-) এবং -CO2- কার্যকরী মূলক একই C পরমাণুর সাথে সংযুক্ত থাকে, এবং এইকারণে এরা α-অ্যামিনো অ্যাসিড শ্রেণীভুক্ত। অ্যাকাইরাল গ্লাইসিন (glycin) বাদে, সকল প্রাকৃতিক অ্যামিনো অ্যাসিডের এল কনফিগারেশন রয়েছে, [২১] এবং এগুলো শুধুমাত্র রাইবোসোমে রুপান্তরণের (translation) সময় প্রোটিনে (proteins) পাওয়া যায়।
অ্যামিনো অ্যাসিড কনফিগারেশনের এল এবং ডি নিয়মটি অ্যামিনো অ্যাসিডের নিজস্ব আলোক ক্রিয়াকে (optical activity) বোঝায় না বরং গ্লিসারালডিহাইডের (glyceraldehyde) আইসোমারের আলোক ক্রিয়াকে বোঝায় যেখান থেকে তাত্ত্বিকভাবে অ্যামিনো অ্যাসিড সংশ্লেষিত হতে পারে ( ডি -গ্লিসারালডিহাইড ডান-ঘূর্ণীঃ dextrorotatory ; এল -গ্লিসারালডিহাইড বাম-ঘূর্ণীঃ levorotatory)।
একটি বিকল্প নিয়ম হল, পরম কনফিগারেশন নির্দিষ্ট করার জন্য ( <i id="mwqA">S</i> ) এবং ( <i id="mwqQ">R</i> ) নির্দেশক ((S) and (R) designators) ব্যবহার করা। [২২] প্রোটিনের প্রায় সমস্ত অ্যামিনো অ্যাসিডের α কার্বন ( S ) রুপে থাকে, যার মধ্যে সিস্টাইন ( R ) এবং গ্লাইসিন অ- কাইরাল। [২৩] অন্যান্য অ্যামিনো অ্যাসিডের মতো একই জ্যামিতিক অবস্থানে সিস্টাইনের পার্শ্ব-শিকল রয়েছে, কিন্তু R / S পরিভাষাটি বিপরীত; কারণ কার্বক্সিল অক্সিজেনের তুলনায় সালফারের পারমাণবিক সংখ্যা বেশি, তাই ক্যান-ইনগোল্ড-প্রিলোগ এর অনুক্রম নিয়ম (Cahn-Ingold-Prelog sequence rules) মতে পার্শ্ব চেইন উচ্চতর অগ্রাধিকার পেয়ে থাকে, বিপরীতে কার্বক্সিল গ্রুপের তুলনায় বেশিরভাগ অন্যান্য পার্শ্ব -শিকলে পরমাণুগুলি তাদের কম অগ্রাধিকার দেয়। [২২]
<small id="mwvQ">ডি</small> -অ্যামিনো অ্যাসিডের অবশিষ্ট (D-amino acid residues) কিছু প্রোটিনে পাওয়া যায়, কিন্তু তারা বিরল।
পার্শ্ব-শিকল সমূহ
অ্যামিনো অ্যাসিডগুলিকে α- হিসাবে মনোনীত করা হয় যখন অ্যামিনো নাইট্রোজেন পরমাণু α-কার্বনের সাথে সংযুক্ত থাকে, কার্বন পরমাণুটি কার্বক্সিলেট গ্রুপের পাশেই থাকে।
নীচের সব ক্ষেত্রে মান (যদি থাকে) প্রোটিনের মধ্যে অ্যামিনো অ্যাসিডের অবশিষ্টাংশ হিসাবে গ্রুপগুলির আয়নীকরণ মান বুঝায়। তারা মুক্ত অ্যামিনো অ্যাসিডের মান নির্দেশ করে না (যার সামান্য প্রাণ-রাসায়নিক গুরুত্ব আছে)।
আলিফ্যাটিক পার্শ্ব-শিকল সমূহ
বেশ কয়েকটি পার্শ্ব-শিকলে শুধুমাত্র H এবং C থাকে এবং আয়নিত হয় না। এগুলি নিম্নরূপ (বন্ধনীতে তিন- এবং এক-অক্ষরের চিহ্ন সহ):

- গ্লাইসিন (গ্লাই, জি): (Gly, G): H-
- অ্যালানাইন (আলা, এ): (Ala, A): CH3-
- ভ্যালাইন (ভাল, ভি): (Val, V): (CH3)2CH-
- লিউসিন (লিউ, এল): (Leu, L) (CH3)2CHCH2-
- আইসোলিউসিন (ইলে, আই):(Ile, I):CH3CH2CH(CH3)
- প্রোলিন (প্রো, পি): (Pro, P): -CH2CH2CH2- অ্যামিনের উপর চাক্রিক কাঠামোকৃত (cyclized onto the amine)
নিরপেক্ষ মেরুক পার্শ্ব-শিকলসমূহ (Polar neutral side-chains)
দুটি অ্যামিনো অ্যাসিড অ্যালকোহল যুক্ত পার্শ্ব-শিকল ধারণ করে। এগুলি স্বাভাবিক অবস্থায় আয়নিত হয় না, যদিও একটি অ্যামিনো অ্যাসিড যার নাম সেরিন, সেটি সেরিন প্রোটিস (serine proteases) দ্বারা প্রভাবনের (catalysis) সময় প্রোটন-বর্জিত (deprotonated:ডিপ্রোটোনেটেড) হয়ে যায়: এটি একটি খুবই ব্যতিক্রমী উদাহরণ, এবং সাধারণভাবে তা সেরিন অবশিষ্টাংশের (serine residues) বৈশিষ্ট্য নয়।
- সেরিন (Ser, S, https://wikimedia.org/api/rest_v1/media/math/render/svg/b030798b388df75544df8fc8c18fd46eaaf59a9b নাই, যখন খুবই ব্যতিক্রমী না হয়): HOCH2-
- থ্রিওনিন (Thr, T, https://wikimedia.org/api/rest_v1/media/math/render/svg/b030798b388df75544df8fc8c18fd46eaaf59a9b নাই ): CH3CHOH-
থ্রিওনিনের দুটি কাইরাল কেন্দ্র রয়েছে, শুধুমাত্র অ-কাইরাল গ্লাইসিন বাদে সমস্ত অ্যামিনো অ্যাসিডের সাধারণ α-কার্বনে যে এল (2 S ) কাইরাল কেন্দ্র আছে তা নয়, বরং β-কার্বনেও (3 R ) রয়েছে । সম্পূর্ণ স্টেরিও-রাসায়নিক বৈশিষ্টরুপ (stereochemical specification) হল এল -থ্রিওনিন (2 S ,3 R )।
অ্যামাইড পার্শ্ব-শিকলসমূহ
দুটি অ্যামিনো অ্যাসিডের অ্যামাইড পার্শ্ব-শিকল রয়েছে, যা নিম্নরূপ:
- অ্যাস্পারাজিন (Asn, N): NH2COCH2-
- গ্লুটামিন (Gln, Q): NH2COCH2CH2-
এই পার্শ্ব-শিকলগুলি pH-এর স্বাভাবিক পরিসরে আয়নিত হয় না।
সালফারযুক্ত পার্শ্ব-শিকলসমূহ
দুটি পার্শ্ব-শিকলে সালফার পরমাণু থাকে, যার মধ্যে একটি সাধারণ পরিসরে আয়নিত হয় ( নির্দেশিত) এবং অন্যটি করে না:
- সিস্টাইন (Cys, C, ): SHCH2-
- মেথিওনিন(Met, M, নাই): CH3SCH2CH2-
অ্যারোমেটিক পার্শ্ব-শিকলসমূহ

চিত্রে পার্শ্ব-চেইন হিসাবে অ্যারোমেটিক বলয় যুক্ত তিনটি অ্যামিনো অ্যাসিডের গঠন দেখানো হয়েছে। এর মধ্যে, টাইরোসিন স্বাভাবিক পরিসরে আয়নিত করে; অন্য দুটি করে না)।
- ফিনাইল অ্যালানিন (Phe, F, নাই ): চিত্রে বামে
- টাইরোসিন(Tyr, Y, ) চিত্রে মাঝখানে
- ট্রিপটোফ্যান (Trp, W, নাই ): চিত্রে ডানে
ঋণাত্মক-ধর্মী (Anionic) পার্শ্ব-শিকলসমূহ
দুটি অ্যামিনো অ্যাসিডের সাইড-চেইন রয়েছে যা সাধারণ pH-এ অ্যাানায়ন। যদিও ভুল নামটি এতটাই বিস্তৃত যে তা শুধরানোর নয়, তবে এগুলিকে অ্যাসিডিক অ্যামিনো অ্যাসিড বলা উচিত নয়, কারণ তারা পেপসিনের মতো এনজাইমগুলি ব্যতীত সমস্ত ক্ষেত্রে ব্রনস্টেড বেস হিসাবে কাজ করে, অন্যদিকে পেপসিন স্তন্যপায়ী পাকস্থলীর মতো খুব কম pH-এর পরিবেশেও কাজ করে।
- অ্যাসপার্টেট ("অ্যাসপার্টিক অ্যাসিড নয় ", D, ): O2CCH2-
- গ্লুটামেট ( "গ্লুটামিক অ্যাসিড নয় ", Glu, E, ): -O2CCH2CH2-
ধণাত্মক-ধর্মী (Cationic) পার্শ্ব-শিকলসমূহ

সাইড-চেইন সহ তিনটি অ্যামিনো অ্যাসিড রয়েছে যা নিরপেক্ষ pH-এ ক্যাটায়ন (যদিও একটিতে যার নাম হিস্টিডিন, ক্যাটায়নিক এবং নিরপেক্ষ উভয় রুপই বিদ্যমান)। এগুলিকে সাধারণত ক্ষারীয় অ্যামিনো অ্যাসিড বলা হয়, কিন্তু এই শব্দটি বিভ্রান্তিকর: হিস্টিডিন, নিরপেক্ষ pH এ, ব্রনস্টেড অম্ল এবং ব্রনস্টেড ক্ষার উভয় হিসাবেই কাজ করতে পারে, লাইসিন ব্রনস্টেড অম্ল হিসাবে কাজ করে এবং আরজিনিনের একটি নির্দিষ্ট ধনাত্মক চার্জ থাকে এবং এটি নিরপেক্ষ অবস্থায় আয়নিত হয় না। । হিস্টিডিনিয়াম, লাইসিনিয়াম এবং আর্জিনিনিয়াম নামগুলি এদের গঠনগুলোর জন্য আরও সঠিক নাম হত, তবে মূলত এগুলোর প্রচলন নেই।


আদর্শ অ্যামিনো অ্যাসিডসমূহের নাম-সংক্ষেপণ এবং বৈশিষ্ট্যের সারণী
যদিও এক-অক্ষরের চিহ্নগুলি টেবিলে অন্তর্ভুক্ত করা হয়েছে, IUPAC-IUBMB [২৪] এর সুপারিশ মতে, "এক-অক্ষরের চিহ্নগুলির ব্যবহার দীর্ঘ ক্রমগুলির তুলনায় সীমিত করা উচিত"।
| অ্যামিনো অ্যাসিড | ৩- ও ১-অক্ষর প্রতিকসমূহ | পার্শ্ব-শিকল | Hydropathy <br id="mwAeU"><br>index[২৫] | Molar absorptivity | Molecular mass | Abundance in proteins (%)[২৬] |
Standard genetic coding, IUPAC notation | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| ৩ | ১ | শ্রেণী | মেরুতা[২৭] | Net charge at pH 7.4[২৭] |
Wavelength, λmax (nm) |
Coefficient ε (mM−1·cm−1) | |||||
| Alanine | Ala | A | Aliphatic | Nonpolar | Neutral | 1.8 | 89.094 | 8.76 | GCN | ||
| Arginine | Arg | R | Fixed cation | Basic polar | Positive | −4.5 | 174.203 | 5.78 | MGR, CGY | ||
| Asparagine | Asn | N | Amide | Polar | Neutral | −3.5 | 132.119 | 3.93 | AAY | ||
| Aspartate | Asp | D | Anion | Brønsted base | Negative | −3.5 | 133.104 | 5.49 | GAY | ||
| Cysteine | Cys | C | Thiol | Brønsted acid | Neutral | 2.5 | 250 | 0.3 | 121.154 | 1.38 | UGY |
| Glutamine | Gln | Q | Amide | Polar | Neutral | −3.5 | 146.146 | 3.9 | CAR | ||
| Glutamate | Glu | E | Anion | Brønsted base | Negative | −3.5 | 147.131 | 6.32 | GAR | ||
| Glycine | Gly | G | Aliphatic | Nonpolar | Neutral | −0.4 | 75.067 | 7.03 | GGN | ||
| Histidine | His | H | Aromatic cation | Brønsted acid and base | Positive, 10% Neutral, 90% |
−3.2 | 211 | 5.9 | 155.156 | 2.26 | CAY |
| Isoleucine | Ile | I | Aliphatic | Nonpolar | Neutral | 4.5 | 131.175 | 5.49 | AUH | ||
| Leucine | Leu | L | Aliphatic | Nonpolar | Neutral | 3.8 | 131.175 | 9.68 | YUR, CUY | ||
| Lysine | Lys | K | Cation | Brønsted acid | Positive | −3.9 | 146.189 | 5.19 | AAR | ||
| Methionine | Met | M | Thioether | Nonpolar | Neutral | 1.9 | 149.208 | 2.32 | AUG | ||
| Phenylalanine | Phe | F | Aromatic | Nonpolar | Neutral | 2.8 | 257, 206, 188 | 0.2, 9.3, 60.0 | 165.192 | 3.87 | UUY |
| Proline | Pro | P | Cyclic | Nonpolar | Neutral | −1.6 | 115.132 | 5.02 | CCN | ||
| Serine | Ser | S | Hydroxylic | Polar | Neutral | −0.8 | 105.093 | 7.14 | UCN, AGY | ||
| Threonine | Thr | T | Hydroxylic | Polar | Neutral | −0.7 | 119.119 | 5.53 | ACN | ||
| Tryptophan | Trp | W | Aromatic | Nonpolar | Neutral | −0.9 | 280, 219 | 5.6, 47.0 | 204.228 | 1.25 | UGG |
| Tyrosine | Tyr | Y | Aromatic | Brønsted acid | Neutral | −1.3 | 274, 222, 193 | 1.4, 8.0, 48.0 | 181.191 | 2.91 | UAY |
| ভ্যালিন | Val | V | Aliphatic | Nonpolar | Neutral | 4.2 | 117.148 | 6.73 | GUN | ||
| দ্ব্যর্থবোধক
অ্যামিনো অ্যাসিড |
৩-অক্ষর | ১-অক্ষর | অন্তর্ভুক্ত অ্যামিনো অ্যাসিডগুলি | অন্তর্ভুক্তকডনস (Codons ) |
|---|---|---|---|---|
| Any / unknown | Xaa | X | All | NNN |
| Asparagine or aspartic acid | Asx | B | D, N | RAY |
| Glutamine or glutamic acid | Glx | Z | E, Q | SAR |
| Leucine or isoleucine | Xle | J | I, L | YTR, ATH, CTY |
| Hydrophobic | Φ | V, I, L, F, W, Y, M | NTN, TAY, TGG | |
| Aromatic | Ω | F, W, Y, H | YWY, TTY, TGG | |
| Aliphatic (non-aromatic) | Ψ | V, I, L, M | VTN, TTR | |
| Small | π | P, G, A, S | BCN, RGY, GGR | |
| Hydrophilic | ζ | S, T, H, N, Q, E, D, K, R | VAN, WCN, CGN, AGY | |
| Positively-charged | + | K, R, H | ARR, CRY, CGR | |
| Negatively-charged | − | D, E | GAN |
প্রাণ রসায়নে প্রাপ্তিতা এবং কার্যাবলী
কার্বক্সিল গ্রুপের পাশে (আলফা-) কার্বন পরমাণুর সাথে অ্যামাইন গ্রুপ যুক্ত অ্যামিনো অ্যাসিডগুলির বিশেষ গুরুত্ব রয়েছে। এগুলি 2-, আলফা- বা α-অ্যামিনো অ্যাসিড নামে পরিচিত (বেশীরভাগ ক্ষেত্রে সাধারণ সংকেত H2NCHRCOOH যেখানে R হল একটি জৈব প্রতিস্থাপক যা " পার্শ্ব চেইন " নামে পরিচিত); [২৮] তবে, প্রায়শই "অ্যামিনো অ্যাসিড" শব্দটি বিশেষভাবে এগুলোর জন্য ব্যবহৃত হয়। এর মধ্যে রয়েছে 22টি প্রোটিনোজেনিক ("প্রোটিন-বিল্ডিং") অ্যামিনো অ্যাসিড, [২৯] [৩০] [৩১] যা পেপটাইড চেইনে ("পলিপেপটাইড") একত্রিত হয়ে প্রোটিনের বিশাল বিন্যাসের গাঠনিক ব্লকসমূহ তৈরি করে। [৩২] এগুলি সবই এল - স্টেরিওইসোমার (" বাম-হাতি/ঘূর্ণী " অ্যানানশিওমার ), যদিও কিছু ডি -অ্যামিনো অ্যাসিড ("ডান-হাতি/ঘূর্ণী") ব্যাকটেরিয়গত পর্দায় (bacterial envelopes), নিউরোমোডুলেটর ( ডি - সেরিন ) হিসাবে এবং কিছু অ্যান্টিবায়োটিক পদার্থে দেখা যায়। [৩৩] টেমপ্লেট:Catecholamine and trace amine biosynthesis

- ↑ The late discovery is explained by the fact that cysteine becomes oxidized to cystine in air.
তথ্যসূত্র
[[বিষয়শ্রেণী:নাইট্রোজেন চক্র]] [[বিষয়শ্রেণী:অ্যামিনো অ্যাসিড]] [[বিষয়শ্রেণী:Category:জুইটারায়ন]]
- ↑ নেলসন, ডেভিড এল.; কক্স, মাইকেল এম. (২০০৫), Principles of Biochemistry (৪র্থ সংস্করণ), নিউ ইয়র্ক: ডব্লিউ. এইচ. ফ্রিম্যান, আইএসবিএন 0-7167-4339-6
- ↑ Flissi, Areski; Ricart, Emma (২০২০)। "Norine: update of the nonribosomal peptide resource": D465–D469। ডিওআই:10.1093/nar/gkz1000। পিএমআইডি 31691799। পিএমসি 7145658

|pmc=এর মান পরীক্ষা করুন (সাহায্য)। - ↑ Böck A, Forchhammer K, Heider J, Baron C (ডিসেম্বর ১৯৯১)। "Selenoprotein synthesis: an expansion of the genetic code": 463–7। ডিওআই:10.1016/0968-0004(91)90180-4। পিএমআইডি 1838215।
- ↑ "Nomenclature and Symbolism for Amino Acids and Peptides"। IUPAC-IUB Joint Commission on Biochemical Nomenclature। ১৯৮৩। ৯ অক্টোবর ২০০৮ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ১৭ নভেম্বর ২০০৮।
- ↑ Latham, Michael C. (১৯৯৭)। "Chapter 8. Body composition, the functions of food, metabolism and energy"। Human nutrition in the developing world। Food and Nutrition Series – No. 29। Food and Agriculture Organization of the United Nations।
- ↑ Vickery HB, Schmidt CL (১৯৩১)। "The history of the discovery of the amino acids"। Chem. Rev.। 9 (2): 169–318। ডিওআই:10.1021/cr60033a001।
- ↑ Hansen, Sabine (মে ২০১৫)। "Die Entdeckung der proteinogenen Aminosäuren von 1805 in Paris bis 1935 in Illinois" (পিডিএফ) (জার্মান ভাষায়)। Berlin। ১ ডিসেম্বর ২০১৭ তারিখে মূল (পিডিএফ) থেকে আর্কাইভ করা। অজানা প্যারামিটার
|name-list-style=উপেক্ষা করা হয়েছে (সাহায্য) - ↑ Vauquelin LN, Robiquet PJ (১৮০৬)। "The discovery of a new plant principle in Asparagus sativus"। Annales de Chimie। 57: 88–93।
- ↑ Anfinsen CB, Edsall JT, Richards FM (১৯৭২)। Advances in Protein Chemistry। New York: Academic Press। পৃষ্ঠা 99, 103। আইএসবিএন 978-0-12-034226-6।
- ↑ Wollaston WH (১৮১০)। "On cystic oxide, a new species of urinary calculus"। Philosophical Transactions of the Royal Society। 100: 223–230। এসটুসিআইডি 110151163। ডিওআই:10.1098/rstl.1810.0015।
- ↑ Baumann E (১৮৮৪)। "Über cystin und cystein"। Z Physiol Chem। 8 (4): 299–305। ১৪ মার্চ ২০১১ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২৮ মার্চ ২০১১।
- ↑ Braconnot HM (১৮২০)। "Sur la conversion des matières animales en nouvelles substances par le moyen de l'acide sulfurique"। Annales de Chimie et de Physique। 2nd Series। 13: 113–125।
- ↑ Simoni RD, Hill RL, Vaughan M (সেপ্টেম্বর ২০০২)। "The discovery of the amino acid threonine: the work of William C. Rose [classical article]"। The Journal of Biological Chemistry। 277 (37): E25। ডিওআই:10.1016/S0021-9258(20)74369-3
 । পিএমআইডি 12218068।
। পিএমআইডি 12218068।
- ↑ McCoy RH, Meyer CE, Rose WC (১৯৩৫)। "Feeding Experiments with Mixtures of Highly Purified Amino Acids. VIII. Isolation and Identification of a New Essential Amino Acid"। Journal of Biological Chemistry। 112: 283–302। ডিওআই:10.1016/S0021-9258(18)74986-7
 ।
।
- ↑ Menten, P. Dictionnaire de chimie: Une approche étymologique et historique. De Boeck, Bruxelles. link.
- ↑ Harper, Douglas। "amino-"। Online Etymology Dictionary। সংগ্রহের তারিখ ১৯ জুলাই ২০১০। অজানা প্যারামিটার
|name-list-style=উপেক্ষা করা হয়েছে (সাহায্য) - ↑ Paal C (১৮৯৪)। "Ueber die Einwirkung von Phenyl‐i‐cyanat auf organische Aminosäuren"। Berichte der Deutschen Chemischen Gesellschaft। 27: 974–979। ডিওআই:10.1002/cber.189402701205। ২০২০-০৭-২৫ তারিখে মূল থেকে আর্কাইভ করা।
- ↑ Fruton, Joseph S. (১৯৯০)। "Chapter 5- Emil Fischer and Franz Hofmeister"। Contrasts in Scientific Style: Research Groups in the Chemical and Biochemical Sciences। 191। American Philosophical Society। পৃষ্ঠা 163–165। আইএসবিএন 978-0-87169-191-0। অজানা প্যারামিটার
|name-list-style=উপেক্ষা করা হয়েছে (সাহায্য) - ↑ "Alpha amino acid"। The Merriam-Webster.com Medical Dictionary। Merriam-Webster Inc.।.
- ↑ International Union of Pure and Applied Chemistry. "Imino acids". Compendium of Chemical Terminology Internet edition.Retrieved 2 April 2012
- ↑ Creighton, Thomas H. (১৯৯৩)। "Chapter 1"। Proteins: structures and molecular properties। W. H. Freeman। আইএসবিএন 978-0-7167-7030-5।
- ↑ ক খ Cahn, R.S.; Ingold, C.K. (১৯৬৬)। "Specification of Molecular Chirality": 385–415। ডিওআই:10.1002/anie.196603851।
- ↑ Hatem, Salama Mohamed Ali (২০০৬)। "Gas chromatographic determination of Amino Acid Enantiomers in tobacco and bottled wines"। University of Giessen। ২২ জানুয়ারি ২০০৯ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ১৭ নভেম্বর ২০০৮।
- ↑ "Nomenclature and Symbolism for Amino Acids and Peptides"। IUPAC-IUB Joint Commission on Biochemical Nomenclature। ১৯৮৩। ৯ অক্টোবর ২০০৮ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ১৭ নভেম্বর ২০০৮।
- ↑ Kyte J, Doolittle RF (মে ১৯৮২)। "A simple method for displaying the hydropathic character of a protein": 105–132। ডিওআই:10.1016/0022-2836(82)90515-0। পিএমআইডি 7108955। সাইট সিয়ারX 10.1.1.458.454
 ।
।
- ↑ Kozlowski LP (জানুয়ারি ২০১৭)। "Proteome-pI: proteome isoelectric point database": D1112–D1116। ডিওআই:10.1093/nar/gkw978। পিএমআইডি 27789699। পিএমসি 5210655
 ।
।
- ↑ ক খ Hausman, Robert E.; Cooper, Geoffrey M. (২০০৪)। The cell: a molecular approach। ASM Press। পৃষ্ঠা 51। আইএসবিএন 978-0-87893-214-6।
- ↑ Clark, Jim (আগস্ট ২০০৭)। "An introduction to amino acids"। chemguide। সংগ্রহের তারিখ ৪ জুলাই ২০১৫।
- ↑ Peptides from A to Z: A Concise Encyclopedia।
- ↑ Unnatural Amino Acids: Methods and Protocols। Methods in Molecular Biology। Humana Press। ২০১২। পৃষ্ঠা v। আইএসবিএন 978-1-61779-331-8। ওসিএলসি 756512314। ডিওআই:10.1007/978-1-61779-331-8।
- ↑ Hertweck C (অক্টোবর ২০১১)। "Biosynthesis and Charging of Pyrrolysine, the 22nd Genetically Encoded Amino Acid": 9540–9541। ডিওআই:10.1002/anie.201103769। পিএমআইডি 21796749।

- ↑ "Chapter 1: Proteins are the Body's Worker Molecules"। The Structures of Life। National Institute of General Medical Sciences। ২৭ অক্টোবর ২০১১। ৭ জুন ২০১৪ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২০ মে ২০০৮।
- ↑ Biochemical Pathways: An Atlas of Biochemistry and Molecular Biology (2nd সংস্করণ)। Wiley-Blackwell। ২০১২। পৃষ্ঠা 5। আইএসবিএন 978-0-470-14684-2।