আত্মভক্ষণ: সংশোধিত সংস্করণের মধ্যে পার্থক্য
অনুবাদ |
"Autophagy" পাতাটি অনুবাদ করে তৈরি করা হয়েছে |
||
| ১ নং লাইন: | ১ নং লাইন: | ||
| ⚫ | আত্মভক্ষণ বা অটোফ্যাজি (বা অটোফ্যাগোসাইটোসিস; প্রাচীন গ্রীক αὐτόφαγος অটোফ্যাগোস থেকে, যার অর্থ "আত্ম-ভোজন" এবং κύτος kýtos, যার অর্থ "ফাঁপা" হল কোষের প্রাকৃতিক, সংরক্ষিত অবক্ষয় যা অপ্রয়োজনীয় বা বাধ্যতামূলক কাজের মাধ্যমে অপসারণ করে। লাইসোসোম-নির্ভর নিয়ন্ত্রিত প্রক্রিয়া। এটি সেলুলার উপাদানগুলির সুশৃঙ্খল অবক্ষয় এবং পুনর্ব্যবহার করার অনুমতি দেয়। যদিও প্রাথমিকভাবে অনাহার থেকে রক্ষা করার জন্য একটি আদিম অবক্ষয়ের পথ হিসাবে চিহ্নিত করা হয়েছিল, তবে এটি ক্রমবর্ধমানভাবে স্পষ্ট হয়ে উঠেছে যে অ-ক্ষুধার্ত কোষগুলির হোমিওস্ট্যাসিসে অটোফ্যাজিও একটি প্রধান ভূমিকা পালন করে। অটোফ্যাজির ত্রুটিগুলি নিউরোডিজেনারেশন এবং ক্যান্সার সহ বিভিন্ন মানব রোগের সাথে যুক্ত করা হয়েছে এবং এই রোগগুলির সম্ভাব্য চিকিত্সা হিসাবে অটোফ্যাজিকে সংশোধন করার আগ্রহ দ্রুত বৃদ্ধি পেয়েছে।অটোফ্যাজির চারটি রূপ শনাক্ত করা হয়েছে: ম্যাক্রোঅটোফ্যাগি, মাইক্রোঅটোফ্যাজি, চ্যাপেরোন-মিডিয়াটেড অটোফ্যাজি (CMA), এবং ক্রিনোফ্যাজি। ম্যাক্রোঅটোফ্যাজিতে (অটোফ্যাজির সবচেয়ে পুঙ্খানুপুঙ্খভাবে গবেষণা করা ফর্ম), সাইটোপ্লাজমিক উপাদানগুলি (মাইটোকন্ড্রিয়ার মতো) অটোফ্যাগোসোম নামে পরিচিত একটি ডাবল-মেমব্রেন ভেসিকলের মধ্যে কোষের বাকি অংশ থেকে লক্ষ্যবস্তু এবং বিচ্ছিন্ন করা হয়, যা সময়ের সাথে সাথে, একটি উপলব্ধ লাইসোসোমের সাথে ফিউজ করে, যার বর্জ্য ব্যবস্থাপনা এবং নিষ্পত্তির বিশেষ প্রক্রিয়া নিয়ে আসে; এবং অবশেষে ভেসিকলের বিষয়বস্তু (এখন এটি একটি অটোলাইসোসোম নামে পরিচিত) অবনতি এবং পুনর্ব্যবহৃত হয়। ক্রিনোফ্যাজিতে (অটোফ্যাজির সর্বনিম্ন পরিচিত এবং গবেষণাকৃত রূপ), অপ্রয়োজনীয় সিক্রেটরি গ্রানুলগুলিকে অবনমিত করে পুনর্ব্যবহার করা হয়।রোগে, অটোফ্যাজিকে মানসিক চাপের অভিযোজিত প্রতিক্রিয়া হিসাবে দেখা হয়, কোষের বেঁচে থাকার প্রচার করে; কিন্তু অন্যান্য ক্ষেত্রে, এটি কোষের মৃত্যু এবং অসুস্থতা প্রচার করে বলে মনে হয়। অনাহারের চরম ক্ষেত্রে, সেলুলার উপাদানগুলির ভাঙ্গন সেলুলার শক্তির মাত্রা বজায় রেখে সেলুলার বেঁচে থাকার প্রচার করে।"অটোফ্যাজি" শব্দটি 19 শতকের মাঝামাঝি থেকে বিদ্যমান ছিল এবং প্রায়শই ব্যবহৃত হত। এটির বর্তমান ব্যবহারে, অটোফ্যাজি শব্দটি 1963 সালে বেলজিয়ান জৈব রসায়নবিদ ক্রিশ্চিয়ান ডি ডুভ তার লাইসোসোমের কার্যাবলী আবিষ্কারের ভিত্তিতে তৈরি করেছিলেন। 1990-এর দশকে ইস্টে অটোফ্যাজি-সম্পর্কিত জিনের সনাক্তকরণ গবেষকদের অটোফ্যাজির প্রক্রিয়াগুলি বের করার অনুমতি দেয়,যা শেষ পর্যন্ত 2016 তে ফিজিওলজিতে নোবেল পুরস্কার বা পুরস্কার লাভ করে জাপানি গবেষক ইয়োশিনোরি ওহসুমির ওষুধ। |
||
[[চিত্র:Autophagy_diagram_PLoS_Biology.jpg|ডান|থাম্ব| (ক) অটোফ্যাজি প্রক্রিয়ার চিত্র, যা অটোফাগোjg, gj,gj, সোম, এপি এবং অটোলাইসোসোম, AL গঠন করে; (B) একটি ফল মাছি লার্ভার চর্বিযুক্ত শরীরে অটোফ্যাজিক স্ট্রাকচার AP এবং AL এর ইলেক্ট্রন মাইক্রোগ্রাফ; (সি) ক্ষুধার্ত ইঁদুরের লিভার কোষে ফ্লুরোসেন্টলি লেবেলযুক্ত অটোফাগোসোম এপি।]] |
|||
| ⚫ | '''অটোফ্যাজি''' (বা '''অটোফ্যাগোসাইটোসিস''' ; আত্মভক্ষণ বা অটোফ্যাজি (বা অটোফ্যাগোসাইটোসিস; প্রাচীন গ্রীক αὐτόφαγος অটোফ্যাগোস থেকে, যার অর্থ "আত্ম-ভোজন" এবং κύτος kýtos, যার অর্থ "ফাঁপা" হল কোষের প্রাকৃতিক, সংরক্ষিত অবক্ষয় যা অপ্রয়োজনীয় বা বাধ্যতামূলক কাজের মাধ্যমে অপসারণ করে। লাইসোসোম-নির্ভর নিয়ন্ত্রিত প্রক্রিয়া। এটি সেলুলার উপাদানগুলির সুশৃঙ্খল অবক্ষয় এবং পুনর্ব্যবহার করার অনুমতি দেয়। যদিও প্রাথমিকভাবে অনাহার থেকে রক্ষা করার জন্য একটি আদিম অবক্ষয়ের পথ হিসাবে চিহ্নিত করা হয়েছিল, তবে এটি ক্রমবর্ধমানভাবে স্পষ্ট হয়ে উঠেছে যে অ-ক্ষুধার্ত কোষগুলির হোমিওস্ট্যাসিসে অটোফ্যাজিও একটি প্রধান ভূমিকা পালন করে। অটোফ্যাজির ত্রুটিগুলি নিউরোডিজেনারেশন এবং ক্যান্সার সহ বিভিন্ন মানব রোগের সাথে যুক্ত করা হয়েছে এবং এই রোগগুলির সম্ভাব্য চিকিত্সা হিসাবে অটোফ্যাজিকে সংশোধন করার আগ্রহ দ্রুত বৃদ্ধি পেয়েছে।অটোফ্যাজির চারটি রূপ শনাক্ত করা হয়েছে: ম্যাক্রোঅটোফ্যাগি, মাইক্রোঅটোফ্যাজি, চ্যাপেরোন-মিডিয়াটেড অটোফ্যাজি (CMA), এবং ক্রিনোফ্যাজি। ম্যাক্রোঅটোফ্যাজিতে (অটোফ্যাজির সবচেয়ে পুঙ্খানুপুঙ্খভাবে গবেষণা করা ফর্ম), সাইটোপ্লাজমিক উপাদানগুলি (মাইটোকন্ড্রিয়ার মতো) অটোফ্যাগোসোম নামে পরিচিত একটি ডাবল-মেমব্রেন ভেসিকলের মধ্যে কোষের বাকি অংশ থেকে লক্ষ্যবস্তু এবং বিচ্ছিন্ন করা হয়, যা সময়ের সাথে সাথে, একটি উপলব্ধ লাইসোসোমের সাথে ফিউজ করে, যার বর্জ্য ব্যবস্থাপনা এবং নিষ্পত্তির বিশেষ প্রক্রিয়া নিয়ে আসে; এবং অবশেষে ভেসিকলের বিষয়বস্তু (এখন এটি একটি অটোলাইসোসোম নামে পরিচিত) অবনতি এবং পুনর্ব্যবহৃত হয়। ক্রিনোফ্যাজিতে (অটোফ্যাজির সর্বনিম্ন পরিচিত এবং গবেষণাকৃত রূপ), অপ্রয়োজনীয় সিক্রেটরি গ্রানুলগুলিকে অবনমিত করে পুনর্ব্যবহার করা হয়।রোগে, অটোফ্যাজিকে মানসিক চাপের অভিযোজিত প্রতিক্রিয়া হিসাবে দেখা হয়, কোষের বেঁচে থাকার প্রচার করে; কিন্তু অন্যান্য ক্ষেত্রে, এটি কোষের মৃত্যু এবং অসুস্থতা প্রচার করে বলে মনে হয়। অনাহারের চরম ক্ষেত্রে, সেলুলার উপাদানগুলির ভাঙ্গন সেলুলার শক্তির মাত্রা বজায় রেখে সেলুলার বেঁচে থাকার প্রচার করে।"অটোফ্যাজি" শব্দটি 19 শতকের মাঝামাঝি থেকে বিদ্যমান ছিল এবং প্রায়শই ব্যবহৃত হত। এটির বর্তমান ব্যবহারে, অটোফ্যাজি শব্দটি 1963 সালে বেলজিয়ান জৈব রসায়নবিদ ক্রিশ্চিয়ান ডি ডুভ তার লাইসোসোমের কার্যাবলী আবিষ্কারের ভিত্তিতে তৈরি করেছিলেন। 1990-এর দশকে ইস্টে অটোফ্যাজি-সম্পর্কিত জিনের সনাক্তকরণ গবেষকদের অটোফ্যাজির প্রক্রিয়াগুলি বের করার অনুমতি দেয়,যা শেষ পর্যন্ত 2016 তে ফিজিওলজিতে নোবেল পুরস্কার বা পুরস্কার লাভ করে জাপানি গবেষক ইয়োশিনোরি ওহসুমির ওষুধ। |
||
অটোফ্যাগির চারটি রূপ শনাক্ত করা হয়েছে: [[আত্মভক্ষণ|ম্যাক্রোঅটোফ্যাগি]], মাইক্রোঅটোফ্যাগি, চ্যাপেরোন - মিডিয়াটেড অটোফ্যাজি (সিএমএ), এবং ক্রিনোপ্যাগি। <ref name="pmid32620244">{{সাময়িকী উদ্ধৃতি|vauthors=Csizmadia T, Juhász G|বছর=2020|শিরোনাম=Crinophagy mechanisms and its potential role in human health and disease|পাতাসমূহ=239–255|doi=10.1016/bs.pmbts.2020.02.002|আইএসবিএন=9780128220214|pmid=32620244}}</ref> ম্যাক্রোঅটোফ্যাজিতে (অটোফ্যাজির সবচেয়ে পুঙ্খানুপুঙ্খভাবে গবেষণা করা ফর্ম), [[সাইটোপ্লাজম|সাইটোপ্লাজমিক]] উপাদানগুলি (যেমন মাইটোকন্ড্রিয়া) অটোফ্যাগোসোম নামে পরিচিত একটি ডাবল-মেমব্রেন ভেসিকলের মধ্যে কোষের বাকি অংশ থেকে লক্ষ্যবস্তু এবং বিচ্ছিন্ন করা হয়, <ref name="mizushima 2011 ARCDB review">{{সাময়িকী উদ্ধৃতি|vauthors=Mizushima N, Yoshimori T, Ohsumi Y|তারিখ=10 November 2011|শিরোনাম=The role of Atg proteins in autophagosome formation|পাতাসমূহ=107–32|doi=10.1146/annurev-cellbio-092910-154005|pmid=21801009}}</ref> <ref name="klionsky 2007 review">{{সাময়িকী উদ্ধৃতি|vauthors=Xie Z, Klionsky DJ|তারিখ=October 2007|শিরোনাম=Autophagosome formation: core machinery and adaptations|পাতাসমূহ=1102–9|doi=10.1038/ncb1007-1102|pmid=17909521}}</ref> যা সময়ের সাথে সাথে, একটি উপলব্ধ [[লাইসোসোম|লাইসোসোমের]] সাথে ফিউজ করে, বর্জ্য ব্যবস্থাপনা এবং নিষ্পত্তির বিশেষ প্রক্রিয়া নিয়ে আসে; এবং অবশেষে ভেসিকলের বিষয়বস্তু (এখন এটি একটি অটোলাইসোসোম বলা হয়) অবনমিত হয় এবং পুনর্ব্যবহৃত হয়। ক্রিনোফ্যাজিতে (অটোফ্যাজির সর্বনিম্ন সুপরিচিত এবং গবেষণাকৃত রূপ), অপ্রয়োজনীয় সিক্রেটরি গ্রানুলগুলিকে অবনমিত করা হয় এবং পুনর্ব্যবহার করা হয়। <ref name="pmid32620244" /> |
|||
রোগে, অটোফ্যাজিকে মানসিক চাপের অভিযোজিত প্রতিক্রিয়া হিসাবে দেখা হয়, কোষের বেঁচে থাকার প্রচার করে; কিন্তু অন্যান্য ক্ষেত্রে, এটি কোষের মৃত্যু এবং [[রোগ|অসুস্থতাকে]] উন্নীত করে বলে মনে হয়। অনাহারের চরম ক্ষেত্রে, সেলুলার উপাদানগুলির ভাঙ্গন সেলুলার শক্তির মাত্রা বজায় রেখে সেলুলার বেঁচে থাকার প্রচার করে। |
|||
'''''ইতিহাস :-------------------------------------------------------------------------------------------------''''' |
|||
"অটোফ্যাজি" শব্দটি 19 শতকের মাঝামাঝি থেকে বিদ্যমান ছিল এবং প্রায়শই ব্যবহৃত হত। <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Ktistakis NT|বছর=2017|শিরোনাম=In praise of M. Anselmier who first used the term "autophagie" in 1859|পাতাসমূহ=2015–2017|doi=10.1080/15548627.2017.1367473|pmc=5788564|pmid=28837378}}</ref> এটির বর্তমান ব্যবহারে, অটোফ্যাজি শব্দটি 1963 সালে বেলজিয়ান জৈব রসায়নবিদ [[ক্রিস্টিয়ান ডি দুভ|ক্রিশ্চিয়ান ডি ডুভ]] লাইসোসোমের কার্যাবলী আবিষ্কারের ভিত্তিতে তৈরি করেছিলেন। <ref name="klionsky">{{সাময়িকী উদ্ধৃতি|vauthors=Klionsky DJ|তারিখ=August 2008|শিরোনাম=Autophagy revisited: a conversation with Christian de Duve|পাতাসমূহ=740–3|doi=10.4161/auto.6398|pmid=18567941|doi-access=free}}</ref> 1990-এর দশকে ইস্টে অটোফ্যাজি-সম্পর্কিত জিনের সনাক্তকরণ গবেষকদের অটোফ্যাজির প্রক্রিয়াগুলি বের করার অনুমতি দেয়, <ref name="klionsky 1992">{{সাময়িকী উদ্ধৃতি|vauthors=Klionsky DJ, Cueva R, Yaver DS|তারিখ=October 1992|শিরোনাম=Aminopeptidase I of Saccharomyces cerevisiae is localized to the vacuole independent of the secretory pathway|পাতাসমূহ=287–99|doi=10.1083/jcb.119.2.287|pmc=2289658|pmid=1400574}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFKlionskyCuevaYaver1992">Klionsky DJ, Cueva R, Yaver DS (October 1992). [//www.ncbi.nlm.nih.gov/pmc/articles/PMC2289658 "Aminopeptidase I of Saccharomyces cerevisiae is localized to the vacuole independent of the secretory pathway"]. ''The Journal of Cell Biology''. '''119''' (2): 287–99. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:[[doi:10.1083/jcb.119.2.287|10.1083/jcb.119.2.287]]. [[পাবমেড সেন্ট্রাল|PMC]] <span class="cs1-lock-free" title="Freely accessible">[//www.ncbi.nlm.nih.gov/pmc/articles/PMC2289658 2289658]</span>. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/1400574 1400574].</cite></ref> <ref name="ohsumi 1992">{{সাময়িকী উদ্ধৃতি|vauthors=Takeshige K, Baba M, Tsuboi S, Noda T, Ohsumi Y|তারিখ=October 1992|শিরোনাম=Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction|পাতাসমূহ=301–11|doi=10.1083/jcb.119.2.301|pmc=2289660|pmid=1400575}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFTakeshigeBabaTsuboiNoda1992">Takeshige K, Baba M, Tsuboi S, Noda T, Ohsumi Y (October 1992). [//www.ncbi.nlm.nih.gov/pmc/articles/PMC2289660 "Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction"]. ''The Journal of Cell Biology''. '''119''' (2): 301–11. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:[[doi:10.1083/jcb.119.2.301|10.1083/jcb.119.2.301]]. [[পাবমেড সেন্ট্রাল|PMC]] <span class="cs1-lock-free" title="Freely accessible">[//www.ncbi.nlm.nih.gov/pmc/articles/PMC2289660 2289660]</span>. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/1400575 1400575].</cite></ref> <ref name="thumm 1994">{{সাময়িকী উদ্ধৃতি|vauthors=Thumm M, Egner R, Koch B, Schlumpberger M, Straub M, Veenhuis M, Wolf DH|তারিখ=August 1994|শিরোনাম=Isolation of autophagocytosis mutants of Saccharomyces cerevisiae|পাতাসমূহ=275–80|doi=10.1016/0014-5793(94)00672-5|pmid=8050581}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFThummEgnerKochSchlumpberger1994">Thumm M, Egner R, Koch B, Schlumpberger M, Straub M, Veenhuis M, Wolf DH (August 1994). "Isolation of autophagocytosis mutants of Saccharomyces cerevisiae". ''FEBS Letters''. '''349''' (2): 275–80. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:[[doi:10.1016/0014-5793(94)00672-5|10.1016/0014-5793(94)00672-5]]. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/8050581 8050581]. [[S2CID (শনাক্তকারী)|S2CID]] [https://api.semanticscholar.org/CorpusID:26072787 26072787].</cite></ref> <ref name="ohsumi 1993">{{সাময়িকী উদ্ধৃতি|vauthors=Tsukada M, Ohsumi Y|তারিখ=October 1993|শিরোনাম=Isolation and characterization of autophagy-defective mutants of Saccharomyces cerevisiae|পাতাসমূহ=169–74|doi=10.1016/0014-5793(93)80398-e|pmid=8224160|doi-access=free}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFTsukadaOhsumi1993">Tsukada M, Ohsumi Y (October 1993). [[doi:10.1016/0014-5793(93)80398-e|"Isolation and characterization of autophagy-defective mutants of Saccharomyces cerevisiae"]]. ''FEBS Letters''. '''333''' (1–2): 169–74. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:<span class="cs1-lock-free" title="Freely accessible">[[doi:10.1016/0014-5793(93)80398-e|10.1016/0014-5793(93)80398-e]]</span>. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/8224160 8224160]. [[S2CID (শনাক্তকারী)|S2CID]] [https://api.semanticscholar.org/CorpusID:46017791 46017791].</cite></ref> <ref name="klionsky 1995">{{সাময়িকী উদ্ধৃতি|vauthors=Harding TM, Morano KA, Scott SV, Klionsky DJ|তারিখ=November 1995|শিরোনাম=Isolation and characterization of yeast mutants in the cytoplasm to vacuole protein targeting pathway|পাতাসমূহ=591–602|doi=10.1083/jcb.131.3.591|pmc=2120622|pmid=7593182}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFHardingMoranoScottKlionsky1995">Harding TM, Morano KA, Scott SV, Klionsky DJ (November 1995). [//www.ncbi.nlm.nih.gov/pmc/articles/PMC2120622 "Isolation and characterization of yeast mutants in the cytoplasm to vacuole protein targeting pathway"]. ''The Journal of Cell Biology''. '''131''' (3): 591–602. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:[[doi:10.1083/jcb.131.3.591|10.1083/jcb.131.3.591]]. [[পাবমেড সেন্ট্রাল|PMC]] <span class="cs1-lock-free" title="Freely accessible">[//www.ncbi.nlm.nih.gov/pmc/articles/PMC2120622 2120622]</span>. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/7593182 7593182].</cite></ref> যা অবশেষে 2016 [[চিকিৎসাবিজ্ঞানে নোবেল পুরস্কার|তে ফিজিওলজিতে নোবেল পুরস্কার বা]] জাপানি গবেষক [[ইয়োশিনোরি ওসুমি|ইয়োশিনোরি ওহসুমির]] [[চিকিৎসাবিজ্ঞানে নোবেল পুরস্কার|ওষুধ]] । <ref name="nobelprize">{{ওয়েব উদ্ধৃতি|তারিখ=3 October 2016|প্রকাশক=The Nobel Foundation|শিরোনাম=The Nobel Prize in Physiology or Medicine 2016|ইউআরএল=https://www.nobelprize.org/nobel_prizes/medicine/laureates/2016/press.html|সংগ্রহের-তারিখ=3 October 2016}}<cite class="citation web cs1" data-ve-ignore="true">[https://www.nobelprize.org/nobel_prizes/medicine/laureates/2016/press.html "The Nobel Prize in Physiology or Medicine 2016"]. The Nobel Foundation. 3 October 2016<span class="reference-accessdate">. Retrieved <span class="nowrap">3 October</span> 2016</span>.</cite></ref> |
|||
| ⚫ | [[কেইথ আর পোর্টার|কিথ আর. পোর্টার]] এবং তার ছাত্র টমাস অ্যাশফোর্ড রকফেলার ইনস্টিটিউটে অটোফ্যাজি প্রথম পর্যবেক্ষণ করেছিলেন। 1962 সালের জানুয়ারিতে তারা [[গ্লুকাগন]] যোগ করার পর ইঁদুরের যকৃতের কোষে লাইসোসোমের সংখ্যা বৃদ্ধির কথা জানায় এবং কোষের কেন্দ্রের দিকে কিছু স্থানচ্যুত লাইসোসোমে [[মাইটোকন্ড্রিয়া|মাইটোকন্ড্রিয়ার]] মতো অন্যান্য কোষের অর্গানেল রয়েছে। [[ক্রিস্টিয়ান ডি দুভ|ক্রিশ্চিয়ান ডি ডুভ]] এবং অ্যালেক্স বি নোভিকফের নামানুসারে তারা এই [[স্ববিশ্লেষণ (জীববিজ্ঞান)|অটোলাইসিসকে]] বলে। তবে পোর্টার এবং অ্যাশফোর্ড ভুলভাবে তাদের ডেটাকে লাইসোসোম গঠন হিসাবে ব্যাখ্যা করেছেন (প্রাক-বিদ্যমান অর্গানেলগুলিকে উপেক্ষা করে)। লাইসোসোমগুলি কোষের অর্গানেল হতে পারে না, তবে [[সাইটোপ্লাজম|সাইটোপ্লাজমের]] অংশ যেমন [[মাইটোকন্ড্রিয়া]] এবং সেই হাইড্রোলাইটিক এনজাইমগুলি মাইক্রোবডি দ্বারা উত্পাদিত হয়েছিল। <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Ashford TP, Porter KR|তারিখ=January 1962|শিরোনাম=Cytoplasmic components in hepatic cell lysosomes|পাতাসমূহ=198–202|doi=10.1083/jcb.12.1.198|pmc=2106008|pmid=13862833}}</ref> 1963 সালে Hruban, Spargo এবং সহকর্মীরা "ফোকাল সাইটোপ্লাজমিক অবক্ষয়" এর একটি বিশদ আল্ট্রাস্ট্রাকচারাল বর্ণনা প্রকাশ করেন, যা আঘাত-প্ররোচিত সিকোয়েস্ট্রেশনের 1955 সালের জার্মান গবেষণার উল্লেখ করে। Hruban, Spargo এবং সহকর্মীরা লাইসোসোমে বিচ্ছিন্ন সাইটোপ্লাজমের পরিপক্কতার তিনটি ক্রমাগত পর্যায়কে স্বীকৃতি দিয়েছিলেন এবং এই প্রক্রিয়াটি শুধুমাত্র আঘাতের অবস্থার মধ্যেই সীমাবদ্ধ ছিল না যা "কোষীয় পদার্থের পুনঃব্যবহার" এবং পার্থক্যের সময় "অর্গানেলের নিষ্পত্তি" এর জন্য শারীরবৃত্তীয় অবস্থার অধীনে কাজ করে। . <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Hruban Z, Spargo B, Swift H, Wissler RW, Kleinfeld RG|তারিখ=June 1963|শিরোনাম=Focal cytoplasmic degradation|পাতাসমূহ=657–83|pmc=1949709|pmid=13955261}}</ref> এই আবিষ্কারের দ্বারা অনুপ্রাণিত হয়ে, ডি ডুভ ঘটনাটিকে "অটোফ্যাজি" নামকরণ করেছিলেন। পোর্টার এবং অ্যাশফোর্ডের বিপরীতে, ডি ডুভ লিভারে কোষের অবক্ষয়ের একটি প্রধান প্রবর্তক হিসাবে গ্লুকাগনের ভূমিকা বর্ণনা করার সময় লাইসোসোমাল ফাংশনের একটি অংশ হিসাবে এই শব্দটিকে কল্পনা করেছিলেন। তার ছাত্র রাসেল ডিটারের সাথে, তিনি প্রতিষ্ঠা করেছিলেন যে লাইসোসোমগুলি গ্লুকাগন-প্ররোচিত অটোফ্যাজির জন্য দায়ী। <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Deter RL, Baudhuin P, De Duve C|তারিখ=November 1967|শিরোনাম=Participation of lysosomes in cellular autophagy induced in rat liver by glucagon|পাতাসমূহ=C11–6|doi=10.1083/jcb.35.2.c11|pmc=2107130|pmid=6055998}}</ref> <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Deter RL, De Duve C|তারিখ=May 1967|শিরোনাম=Influence of glucagon, an inducer of cellular autophagy, on some physical properties of rat liver lysosomes|পাতাসমূহ=437–49|doi=10.1083/jcb.33.2.437|pmc=2108350|pmid=4292315}}</ref> এই প্রথম সত্য যে লাইসোসোমগুলি অন্তঃকোষীয় অটোফ্যাজির সাইটগুলি প্রতিষ্ঠিত হয়েছিল। <ref name="klionsky">{{সাময়িকী উদ্ধৃতি|vauthors=Klionsky DJ|তারিখ=August 2008|শিরোনাম=Autophagy revisited: a conversation with Christian de Duve|পাতাসমূহ=740–3|doi=10.4161/auto.6398|pmid=18567941|doi-access=free}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFKlionsky2008">Klionsky DJ (August 2008). [[doi:10.4161/auto.6398|"Autophagy revisited: a conversation with Christian de Duve"]]. ''Autophagy''. '''4''' (6): 740–3. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:<span class="cs1-lock-free" title="Freely accessible">[[doi:10.4161/auto.6398|10.4161/auto.6398]]</span>. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/18567941 18567941].</cite></ref> <ref>{{সাময়িকী উদ্ধৃতি|vauthors=de Duve C|তারিখ=December 1983|শিরোনাম=Lysosomes revisited|পাতাসমূহ=391–7|doi=10.1111/j.1432-1033.1983.tb07841.x|pmid=6319122|doi-access=free}}</ref> <ref>{{বই উদ্ধৃতি|শিরোনাম=Autophagy and Cancer|vauthors=Dunn WA, Schroder LA, Aris JP|veditors=Wang HG|অধ্যায়ের-ইউআরএল=https://books.google.com/books?id=nXpDAAAAQBAJ|বছর=2013|প্রকাশক=Springer|পাতাসমূহ=3–4|অধ্যায়=Historical overview of autophagy|আইএসবিএন=9781461465614}}</ref> |
||
1990-এর দশকে বিজ্ঞানীদের কয়েকটি দল স্বাধীনভাবে [[ঈস্ট|উদীয়মান খামির]] ব্যবহার করে অটোফ্যাজি-সম্পর্কিত জিন আবিষ্কার করেছিল। উল্লেখযোগ্যভাবে, [[ইয়োশিনোরি ওসুমি|ইয়োশিনোরি]] ওহসুমি এবং মাইকেল থাম অনাহার-প্ররোচিত অ-নির্বাচিত অটোফ্যাজি পরীক্ষা করেছেন; <ref name="ohsumi 1992">{{সাময়িকী উদ্ধৃতি|vauthors=Takeshige K, Baba M, Tsuboi S, Noda T, Ohsumi Y|তারিখ=October 1992|শিরোনাম=Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction|পাতাসমূহ=301–11|doi=10.1083/jcb.119.2.301|pmc=2289660|pmid=1400575}}</ref> <ref name="thumm 1994">{{সাময়িকী উদ্ধৃতি|vauthors=Thumm M, Egner R, Koch B, Schlumpberger M, Straub M, Veenhuis M, Wolf DH|তারিখ=August 1994|শিরোনাম=Isolation of autophagocytosis mutants of Saccharomyces cerevisiae|পাতাসমূহ=275–80|doi=10.1016/0014-5793(94)00672-5|pmid=8050581}}</ref> <ref name="ohsumi 1993">{{সাময়িকী উদ্ধৃতি|vauthors=Tsukada M, Ohsumi Y|তারিখ=October 1993|শিরোনাম=Isolation and characterization of autophagy-defective mutants of Saccharomyces cerevisiae|পাতাসমূহ=169–74|doi=10.1016/0014-5793(93)80398-e|pmid=8224160|doi-access=free}}</ref> এরই মধ্যে, ড্যানিয়েল জে. ক্লিয়নস্কি সাইটোপ্লাজম-টু-ভ্যাক্যুল টার্গেটিং (সিভিটি) পথ আবিষ্কার করেন, যা নির্বাচনী অটোফ্যাজির একটি রূপ। <ref name="klionsky 1992">{{সাময়িকী উদ্ধৃতি|vauthors=Klionsky DJ, Cueva R, Yaver DS|তারিখ=October 1992|শিরোনাম=Aminopeptidase I of Saccharomyces cerevisiae is localized to the vacuole independent of the secretory pathway|পাতাসমূহ=287–99|doi=10.1083/jcb.119.2.287|pmc=2289658|pmid=1400574}}</ref> <ref name="klionsky 1995">{{সাময়িকী উদ্ধৃতি|vauthors=Harding TM, Morano KA, Scott SV, Klionsky DJ|তারিখ=November 1995|শিরোনাম=Isolation and characterization of yeast mutants in the cytoplasm to vacuole protein targeting pathway|পাতাসমূহ=591–602|doi=10.1083/jcb.131.3.591|pmc=2120622|pmid=7593182}}</ref> তারা শীঘ্রই দেখতে পেল যে তারা আসলে একই পথ দেখছে, শুধু ভিন্ন কোণ থেকে। <ref name="klionksy 1996 jbc">{{সাময়িকী উদ্ধৃতি|vauthors=Harding TM, Hefner-Gravink A, Thumm M, Klionsky DJ|তারিখ=July 1996|শিরোনাম=Genetic and phenotypic overlap between autophagy and the cytoplasm to vacuole protein targeting pathway|পাতাসমূহ=17621–4|doi=10.1074/jbc.271.30.17621|pmid=8663607|doi-access=free}}</ref> <ref name="klionsky 1996 pnas">{{সাময়িকী উদ্ধৃতি|vauthors=Scott SV, Hefner-Gravink A, Morano KA, Noda T, Ohsumi Y, Klionsky DJ|তারিখ=October 1996|শিরোনাম=Cytoplasm-to-vacuole targeting and autophagy employ the same machinery to deliver proteins to the yeast vacuole|পাতাসমূহ=12304–8|doi=10.1073/pnas.93.22.12304|pmc=37986|pmid=8901576|doi-access=free}}</ref> প্রাথমিকভাবে, এই এবং অন্যান্য খামির গ্রুপগুলির দ্বারা আবিষ্কৃত জিনগুলিকে বিভিন্ন নাম দেওয়া হয়েছিল (APG, AUT, CVT, GSA, PAG, PAZ, এবং PDD)। 2003 সালে খামির গবেষকরা অটোফ্যাজি জিন বোঝাতে ATG ব্যবহার করার জন্য একটি ঐক্যবদ্ধ নামকরণের পক্ষে ছিলেন। <ref name="klionsky 2003 dc">{{সাময়িকী উদ্ধৃতি|vauthors=Klionsky DJ, Cregg JM, Dunn WA, Emr SD, Sakai Y, Sandoval IV, Sibirny A, Subramani S, Thumm M, Veenhuis M, Ohsumi Y|তারিখ=October 2003|শিরোনাম=A unified nomenclature for yeast autophagy-related genes|ইউআরএল=https://www.rug.nl/research/portal/en/publications/a-unified-nomenclature-for-yeast-autophagyrelated-genes(221542fb-cff5-4604-a588-49ee7a7c84fb).html|পাতাসমূহ=539–45|doi=10.1016/s1534-5807(03)00296-x|pmid=14536056|hdl-access=free}}</ref> 2016 সালের ফিজিওলজি বা মেডিসিনে নোবেল পুরস্কারটি ইয়োশিনোরি ওহসুমিকে দেওয়া হয়েছিল, <ref name="nobelprize">{{ওয়েব উদ্ধৃতি|তারিখ=3 October 2016|প্রকাশক=The Nobel Foundation|শিরোনাম=The Nobel Prize in Physiology or Medicine 2016|ইউআরএল=https://www.nobelprize.org/nobel_prizes/medicine/laureates/2016/press.html|সংগ্রহের-তারিখ=3 October 2016}}</ref> যদিও কেউ কেউ উল্লেখ করেছেন যে পুরস্কারটি আরও অন্তর্ভুক্ত হতে পারত। <ref name="nature news">{{সাময়িকী উদ্ধৃতি|vauthors=Van Noorden R, Ledford H|তারিখ=October 2016|শিরোনাম=Medicine Nobel for research on how cells 'eat themselves'|পাতাসমূহ=18–19|doi=10.1038/nature.2016.20721|pmid=27708326|doi-access=free}}</ref> |
|||
| ⚫ | |||
1990-এর দশকে বিজ্ঞানীদের কয়েকটি দল স্বাধীনভাবে উদীয়মান খামির ব্যবহার করে অটোফ্যাজি-সম্পর্কিত জিন আবিষ্কার করেছিল। উল্লেখযোগ্যভাবে, ইয়োশিনোরি ওহসুমি এবং মাইকেল থাম ক্ষুধা-প্ররোচিত অ-নির্বাচিত অটোফ্যাজি পরীক্ষা করেছেন;ইতিমধ্যে, ড্যানিয়েল জে. ক্লিয়নস্কি সাইটোপ্লাজম-টু-ভ্যাক্যুল টার্গেটিং (CVT) পথ আবিষ্কার করেছেন, যা একটি ফর্ম নির্বাচনী অটোফ্যাজি। তারা শীঘ্রই দেখতে পেল যে তারা আসলে একই পথের দিকে তাকিয়ে আছে, শুধু ভিন্ন কোণ থেকে। প্রাথমিকভাবে, এই এবং অন্যান্য খামির গ্রুপগুলির দ্বারা আবিষ্কৃত জিনগুলিকে বিভিন্ন নাম দেওয়া হয়েছিল (APG, AUT, CVT, GSA, PAG, PAZ, এবং PDD)। 2003 সালে খামির গবেষকরা অটোফ্যাজি জিন বোঝাতে ATG ব্যবহার করার জন্য একটি একীভূত নামকরণের পক্ষে ছিলেন। 2016 ফিজিওলজি বা মেডিসিনে নোবেল পুরস্কার ইয়োশিনোরি ওহসুমিকে দেওয়া হয়েছিল,যদিও কেউ কেউ উল্লেখ করেছেন যে পুরস্কারটি আরও অন্তর্ভুক্ত হতে পারত। |
|||
| ⚫ | সমসাময়িক সাহিত্যে, ব্রাজিলিয়ান লেখক লিওনিড আর বোজিও অটোফ্যাজিকে একটি অস্তিত্বের প্রশ্ন হিসাবে প্রকাশ করেছেন। ''টেম্পোস সোমব্রিওস'' <ref>BÓZIO, Leonid. ''Autofagia: livro I Tempos Sombrios''. Brasília: Amazon, 2018. {{আইএসবিএন|978-85-923882-1-8}}</ref> বইয়ের মনস্তাত্ত্বিক নাটকে এমন চরিত্রের কথা বলা হয়েছে যারা তাদের নিজেদের জীবনকে অপ্রমাণিত অস্তিত্বে গ্রাস করে। |
||
অটোফ্যাজি গবেষণার ক্ষেত্রটি 21 শতকের শুরুতে ত্বরান্বিত বৃদ্ধি পেয়েছে। ATG জিনের জ্ঞান বিজ্ঞানীদের মানব স্বাস্থ্য এবং রোগে অটোফ্যাজির কার্যাবলী ব্যবচ্ছেদ করার জন্য আরও সুবিধাজনক সরঞ্জাম সরবরাহ করেছে। 1999 সালে, ক্যান্সারের সাথে অটোফ্যাজি সংযোগকারী একটি যুগান্তকারী আবিষ্কার বেথ লেভিনের গ্রুপ দ্বারা প্রকাশিত হয়েছিল। এই তারিখ পর্যন্ত, ক্যান্সার এবং অটোফ্যাজির মধ্যে সম্পর্ক অটোফ্যাজি গবেষণার একটি প্রধান থিম হয়ে চলেছে। নিউরোডিজেনারেশন এবং ইমিউন ডিফেন্সে অটোফ্যাজির ভূমিকাও যথেষ্ট মনোযোগ পেয়েছে। 2003 সালে, ওয়াটারভিলে অটোফ্যাজির উপর প্রথম গর্ডন গবেষণা সম্মেলন অনুষ্ঠিত হয়। 2005 সালে, ড্যানিয়েল জে ক্লিয়নস্কি এই ক্ষেত্রে নিবেদিত একটি বৈজ্ঞানিক জার্নাল অটোফেজি চালু করেন। অটোফ্যাজির উপর প্রথম কীস্টোন সিম্পোজিয়া সম্মেলন মন্টেরে 2007 সালে অনুষ্ঠিত হয়েছিল। 2008 সালে, ক্যারল এ মার্সার একটি বিএইচএমটি ফিউশন প্রোটিন (জিএসটি-বিএইচএমটি) তৈরি করেছিল, যা কোষের লাইনে অনাহার-প্ররোচিত সাইট-নির্দিষ্ট বিভক্ততা দেখায়। স্তন্যপায়ী কোষে অটোফ্যাজি ফ্লাক্স নির্ণয় করতে বিটাইন হোমোসিস্টাইন মিথাইলট্রান্সফেরেজ (বিএইচএমটি), একটি বিপাকীয় এনজাইমের অবক্ষয় ব্যবহার করা যেতে পারে। |
|||
ম্যাক্রো, মাইক্রো এবং চ্যাপেরোন মধ্যস্থতাকারী অটোফ্যাজি অটোফ্যাজি-সম্পর্কিত জিন এবং তাদের সংশ্লিষ্ট এনজাইম দ্বারা মধ্যস্থতা করা হয়। <ref name="mizushima 2011 ARCDB review">{{সাময়িকী উদ্ধৃতি|vauthors=Mizushima N, Yoshimori T, Ohsumi Y|তারিখ=10 November 2011|শিরোনাম=The role of Atg proteins in autophagosome formation|পাতাসমূহ=107–32|doi=10.1146/annurev-cellbio-092910-154005|pmid=21801009}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFMizushimaYoshimoriOhsumi2011">Mizushima N, Yoshimori T, Ohsumi Y (10 November 2011). "The role of Atg proteins in autophagosome formation". ''Annual Review of Cell and Developmental Biology''. '''27''' (1): 107–32. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:[[doi:10.1146/annurev-cellbio-092910-154005|10.1146/annurev-cellbio-092910-154005]]. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/21801009 21801009].</cite></ref> <ref name="klionsky 2007 review">{{সাময়িকী উদ্ধৃতি|vauthors=Xie Z, Klionsky DJ|তারিখ=October 2007|শিরোনাম=Autophagosome formation: core machinery and adaptations|পাতাসমূহ=1102–9|doi=10.1038/ncb1007-1102|pmid=17909521}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFXieKlionsky2007">Xie Z, Klionsky DJ (October 2007). "Autophagosome formation: core machinery and adaptations". ''Nature Cell Biology''. '''9''' (10): 1102–9. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:[[doi:10.1038/ncb1007-1102|10.1038/ncb1007-1102]]. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/17909521 17909521]. [[S2CID (শনাক্তকারী)|S2CID]] [https://api.semanticscholar.org/CorpusID:26402002 26402002].</cite></ref> <ref name="Lee12">{{সাময়িকী উদ্ধৃতি|vauthors=Lee J, Giordano S, Zhang J|তারিখ=January 2012|শিরোনাম=Autophagy, mitochondria and oxidative stress: cross-talk and redox signalling|পাতাসমূহ=523–40|doi=10.1042/BJ20111451|pmc=3258656|pmid=22187934}}</ref> <ref name="Yoshimori2002">{{সাময়িকী উদ্ধৃতি|vauthors=Mizushima N, Ohsumi Y, Yoshimori T|তারিখ=December 2002|শিরোনাম=Autophagosome formation in mammalian cells|পাতাসমূহ=421–9|doi=10.1247/csf.27.421|pmid=12576635|doi-access=free}}</ref> <ref name="auto">{{সাময়িকী উদ্ধৃতি|vauthors=Youle RJ, Narendra DP|তারিখ=January 2011|শিরোনাম=Mechanisms of mitophagy|পাতাসমূহ=9–14|doi=10.1038/nrm3028|pmc=4780047|pmid=21179058}}</ref> ম্যাক্রোঅটোফ্যাজি তখন বাল্ক এবং সিলেক্টিভ অটোফ্যাজিতে বিভক্ত। নির্বাচনী অটোফ্যাজিতে অর্গানেলের অটোফ্যাজি হয়; মাইটোফ্যাজি, <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Ding WX, Yin XM|তারিখ=July 2012|শিরোনাম=Mitophagy: mechanisms, pathophysiological roles, and analysis|পাতাসমূহ=547–64|doi=10.1515/hsz-2012-0119|pmc=3630798|pmid=22944659}}</ref> লিপোফ্যাজি, <ref name=":1">{{সাময়িকী উদ্ধৃতি|vauthors=Liu K, Czaja MJ|তারিখ=January 2013|শিরোনাম=Regulation of lipid stores and metabolism by lipophagy|পাতাসমূহ=3–11|doi=10.1038/cdd.2012.63|pmc=3524634|pmid=22595754}}</ref> পেক্সোফ্যাজি, <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Till A, Lakhani R, Burnett SF, Subramani S|তারিখ=2012|শিরোনাম=Pexophagy: the selective degradation of peroxisomes|পাতাসমূহ=512721|doi=10.1155/2012/512721|pmc=3320016|pmid=22536249|doi-access=free}}</ref> ক্লোরোফ্যাজি, <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Lei L|তারিখ=March 2017|শিরোনাম=Chlorophagy: Preventing sunburn|পাতাসমূহ=17026|doi=10.1038/nplants.2017.26|pmid=28248315|doi-access=free}}</ref> রিবোফ্যাজি <ref>{{সাময়িকী উদ্ধৃতি|vauthors=An H, Harper JW|তারিখ=February 2018|শিরোনাম=Systematic analysis of ribophagy in human cells reveals bystander flux during selective autophagy|পাতাসমূহ=135–143|doi=10.1038/s41556-017-0007-x|pmc=5786475|pmid=29230017}}</ref> এবং অন্যান্য। |
|||
| ⚫ | |||
'''ম্যাক্রোঅটোফ্যাজি''' হল প্রধান পথ, যা প্রাথমিকভাবে ক্ষতিগ্রস্ত কোষের [[অঙ্গাণু|অর্গানেল]] বা অব্যবহৃত [[প্রোটিন]] নির্মূল করতে ব্যবহৃত হয়। <ref name="Levine11">{{সাময়িকী উদ্ধৃতি|vauthors=Levine B, Mizushima N, Virgin HW|তারিখ=January 2011|শিরোনাম=Autophagy in immunity and inflammation|পাতাসমূহ=323–35|doi=10.1038/nature09782|pmc=3131688|pmid=21248839}}</ref> প্রথমে ফাগোফোর এমন উপাদানকে আচ্ছন্ন করে যাকে অবনমিত করতে হয়, যা ধ্বংসের জন্য চিহ্নিত অর্গানেলের চারপাশে অটোফাগোসোম নামে পরিচিত একটি দ্বিগুণ ঝিল্লি তৈরি করে। <ref name="Yoshimori2002">{{সাময়িকী উদ্ধৃতি|vauthors=Mizushima N, Ohsumi Y, Yoshimori T|তারিখ=December 2002|শিরোনাম=Autophagosome formation in mammalian cells|পাতাসমূহ=421–9|doi=10.1247/csf.27.421|pmid=12576635|doi-access=free}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFMizushimaOhsumiYoshimori2002">Mizushima N, Ohsumi Y, Yoshimori T (December 2002). [[doi:10.1247/csf.27.421|"Autophagosome formation in mammalian cells"]]. ''Cell Structure and Function''. '''27''' (6): 421–9. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:<span class="cs1-lock-free" title="Freely accessible">[[doi:10.1247/csf.27.421|10.1247/csf.27.421]]</span>. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/12576635 12576635].</cite></ref> <ref name="Pegan12">{{সাময়িকী উদ্ধৃতি|vauthors=Česen MH, Pegan K, Spes A, Turk B|তারিখ=July 2012|শিরোনাম=Lysosomal pathways to cell death and their therapeutic applications|পাতাসমূহ=1245–51|doi=10.1016/j.yexcr.2012.03.005|pmid=22465226}}{{অকার্যকর সংযোগ|date=April 2020}}</ref> অটোফ্যাগোসোম তারপর কোষের সাইটোপ্লাজমের মধ্য দিয়ে স্তন্যপায়ী প্রাণীর একটি লাইসোসোমে বা খামির ও উদ্ভিদের ভ্যাকুয়ালে যায় <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Avin-Wittenberg T, Honig A, Galili G|তারিখ=April 2012|শিরোনাম=Variations on a theme: plant autophagy in comparison to yeast and mammals|পাতাসমূহ=285–99|doi=10.1007/s00709-011-0296-z|pmid=21660427}}</ref> এবং দুটি অর্গানেল একত্রিত হয়। <ref name="Yoshimori2002" /> লাইসোসোম/ভ্যাকুওলের মধ্যে, অটোফাগোসোমের বিষয়বস্তু অ্যাসিডিক লাইসোসোমাল হাইড্রোলেজের মাধ্যমে ক্ষয়প্রাপ্ত হয়। <ref name="Homma2011">{{সাময়িকী উদ্ধৃতি|vauthors=Homma KS|বছর=2011|শিরোনাম=List of autophagy-related proteins and 3D structures|ইউআরএল=http://tp-apg.genes.nig.ac.jp/autophagy/list/GeneList.html|আর্কাইভের-ইউআরএল=https://web.archive.org/web/20120801130843/http://tp-apg.genes.nig.ac.jp/autophagy/list/GeneList.html|আর্কাইভের-তারিখ=2012-08-01|সংগ্রহের-তারিখ=2012-10-08}}</ref> |
|||
ম্যাক্রো, মাইক্রো এবং চ্যাপেরোন মধ্যস্থতাকারী অটোফ্যাজি অটোফ্যাজি-সম্পর্কিত জিন এবং তাদের সংশ্লিষ্ট এনজাইম দ্বারা মধ্যস্থতা করা হয়ম্যাক্রোঅটোফ্যাজি তখন বাল্ক এবং সিলেক্টিভ অটোফ্যাজিতে বিভক্ত। নির্বাচনী অটোফ্যাজিতে অর্গানেলের অটোফ্যাজি হয়; মাইটোফ্যাজি, লিপোফ্যাজি, পেক্সোফ্যাজি,ক্লোরোফ্যাজি, রিবোফ্যাজি এবং অন্যান্য। |
|||
অন্যদিকে, মাইক্রোঅটোফ্যাজি লাইসোসোমে সাইটোপ্লাজমিক উপাদানের সরাসরি '''আবদ্ধতাকে''' জড়িত করে। <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Castro-Obregon S|বছর=2010|শিরোনাম=The Discovery of Lysosomes and Autophagy|ইউআরএল=https://www.nature.com/scitable/topicpage/the-discovery-of-lysosomes-and-autophagy-14199828|পাতা=49}}</ref> এটি ইনভাজিনেশনের মাধ্যমে ঘটে, যার অর্থ লাইসোসোমাল ঝিল্লির অভ্যন্তরীণ ভাঁজ, বা সেলুলার প্রোট্রুশন। <ref name="Pegan12">{{সাময়িকী উদ্ধৃতি|vauthors=Česen MH, Pegan K, Spes A, Turk B|তারিখ=July 2012|শিরোনাম=Lysosomal pathways to cell death and their therapeutic applications|পাতাসমূহ=1245–51|doi=10.1016/j.yexcr.2012.03.005|pmid=22465226}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFČesenPeganSpesTurk2012">Česen MH, Pegan K, Spes A, Turk B (July 2012). "Lysosomal pathways to cell death and their therapeutic applications". ''Experimental Cell Research''. '''318''' (11): 1245–51. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:[[doi:10.1016/j.yexcr.2012.03.005|10.1016/j.yexcr.2012.03.005]]. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/22465226 22465226].</cite>{{অকার্যকর সংযোগ|date=April 2020}} |
|||
Macroautophagy হল প্রধান পথ, যা প্রাথমিকভাবে ক্ষতিগ্রস্ত কোষের অর্গানেল বা অব্যবহৃত প্রোটিন নির্মূল করতে ব্যবহৃত হয়। প্রথমে ফ্যাগোফোর এমন উপাদানকে আচ্ছন্ন করে ফেলে যা অবক্ষয়ের প্রয়োজন হয়, যা ধ্বংসের জন্য চিহ্নিত অর্গানেলের চারপাশে অটোফাগোসোম নামে পরিচিত একটি ডবল মেমব্রেন তৈরি করে। অটোফ্যাগোসোম তারপর কোষের সাইটোপ্লাজমের মধ্য দিয়ে স্তন্যপায়ী প্রাণীর একটি লাইসোসোমে বা খামির এবং উদ্ভিদের শূন্যস্থানে ভ্রমণ করে,এবং দুটি অর্গানেল ফিউজ করে। লাইসোসোম/ভ্যাকুওলের মধ্যে, অটোফ্যাগোসোমের বিষয়বস্তু অ্যাসিডিক লাইসোসোমাল হাইড্রোলেজের মাধ্যমে ক্ষয়প্রাপ্ত হয়। |
|||
[[Category:Articles with dead external links from April 2020]] |
|||
[[Category:Articles with permanently dead external links]] |
|||
<sup class="noprint Inline-Template" data-ve-ignore="true"><span style="white-space: nowrap;">[''[[উইকিপিডিয়া:অকার্যকর সংযোগ|<span title=" Dead link tagged April 2020">permanent dead link</span>]]'']</span></sup></ref> |
|||
'''চ্যাপেরোন''' -মিডিয়াটেড অটোফ্যাজি, বা সিএমএ, একটি অত্যন্ত জটিল এবং নির্দিষ্ট পথ, যা hsc70- ধারণকারী কমপ্লেক্স দ্বারা স্বীকৃতি জড়িত। <ref name="Cuervo2008">{{সাময়িকী উদ্ধৃতি|vauthors=Bandyopadhyay U, Kaushik S, Varticovski L, Cuervo AM|তারিখ=September 2008|শিরোনাম=The chaperone-mediated autophagy receptor organizes in dynamic protein complexes at the lysosomal membrane|পাতাসমূহ=5747–63|doi=10.1128/MCB.02070-07|pmc=2546938|pmid=18644871}}</ref> এর মানে হল যে একটি প্রোটিনে অবশ্যই এই hsc70 কমপ্লেক্সের স্বীকৃতির স্থান থাকতে হবে যা এটিকে এই চ্যাপেরোনের সাথে আবদ্ধ হতে দেয়, যা CMA- সাবস্ট্রেট/চ্যাপেরোন কমপ্লেক্স গঠন করে। <ref name="Homma2011">{{সাময়িকী উদ্ধৃতি|vauthors=Homma KS|বছর=2011|শিরোনাম=List of autophagy-related proteins and 3D structures|ইউআরএল=http://tp-apg.genes.nig.ac.jp/autophagy/list/GeneList.html|আর্কাইভের-ইউআরএল=https://web.archive.org/web/20120801130843/http://tp-apg.genes.nig.ac.jp/autophagy/list/GeneList.html|আর্কাইভের-তারিখ=2012-08-01|সংগ্রহের-তারিখ=2012-10-08}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFHomma2011">Homma KS (2011). [https://web.archive.org/web/20120801130843/http://tp-apg.genes.nig.ac.jp/autophagy/list/GeneList.html "List of autophagy-related proteins and 3D structures"]. ''Autophagy Database''. '''290'''. Archived from [http://tp-apg.genes.nig.ac.jp/autophagy/list/GeneList.html the original] on 2012-08-01<span class="reference-accessdate">. Retrieved <span class="nowrap">2012-10-08</span></span>.</cite></ref> এই কমপ্লেক্সটি তারপর লাইসোসোমাল মেমব্রেন-বাউন্ড প্রোটিনে চলে যায় যা CMA রিসেপ্টরের সাথে চিনবে এবং আবদ্ধ করবে। স্বীকৃতির পরে, সাবস্ট্রেট প্রোটিনটি উন্মোচিত হয় এবং এটি লাইসোসোমাল hsc70 চ্যাপেরোনের সহায়তায় লাইসোসোম ঝিল্লি জুড়ে স্থানান্তরিত হয়। <ref name="Lee12">{{সাময়িকী উদ্ধৃতি|vauthors=Lee J, Giordano S, Zhang J|তারিখ=January 2012|শিরোনাম=Autophagy, mitochondria and oxidative stress: cross-talk and redox signalling|পাতাসমূহ=523–40|doi=10.1042/BJ20111451|pmc=3258656|pmid=22187934}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFLeeGiordanoZhang2012">Lee J, Giordano S, Zhang J (January 2012). [//www.ncbi.nlm.nih.gov/pmc/articles/PMC3258656 "Autophagy, mitochondria and oxidative stress: cross-talk and redox signalling"]. ''The Biochemical Journal''. '''441''' (2): 523–40. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:[[doi:10.1042/BJ20111451|10.1042/BJ20111451]]. [[পাবমেড সেন্ট্রাল|PMC]] <span class="cs1-lock-free" title="Freely accessible">[//www.ncbi.nlm.nih.gov/pmc/articles/PMC3258656 3258656]</span>. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/22187934 22187934].</cite></ref> <ref name="Yoshimori2002">{{সাময়িকী উদ্ধৃতি|vauthors=Mizushima N, Ohsumi Y, Yoshimori T|তারিখ=December 2002|শিরোনাম=Autophagosome formation in mammalian cells|পাতাসমূহ=421–9|doi=10.1247/csf.27.421|pmid=12576635|doi-access=free}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFMizushimaOhsumiYoshimori2002">Mizushima N, Ohsumi Y, Yoshimori T (December 2002). [[doi:10.1247/csf.27.421|"Autophagosome formation in mammalian cells"]]. ''Cell Structure and Function''. '''27''' (6): 421–9. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:<span class="cs1-lock-free" title="Freely accessible">[[doi:10.1247/csf.27.421|10.1247/csf.27.421]]</span>. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/12576635 12576635].</cite></ref> CMA অন্যান্য ধরনের অটোফ্যাজি থেকে উল্লেখযোগ্যভাবে আলাদা কারণ এটি প্রোটিন উপাদানকে একে একে স্থানান্তর করে এবং কোন উপাদান লাইসোসোমাল বাধা অতিক্রম করে সে সম্পর্কে এটি অত্যন্ত নির্বাচনী। <ref name="Levine11">{{সাময়িকী উদ্ধৃতি|vauthors=Levine B, Mizushima N, Virgin HW|তারিখ=January 2011|শিরোনাম=Autophagy in immunity and inflammation|পাতাসমূহ=323–35|doi=10.1038/nature09782|pmc=3131688|pmid=21248839}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFLevineMizushimaVirgin2011">Levine B, Mizushima N, Virgin HW (January 2011). [//www.ncbi.nlm.nih.gov/pmc/articles/PMC3131688 "Autophagy in immunity and inflammation"]. ''Nature''. '''469''' (7330): 323–35. [[বিবকোড|Bibcode]]:[https://ui.adsabs.harvard.edu/abs/2011Natur.469..323L 2011Natur.469..323L]. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:[[doi:10.1038/nature09782|10.1038/nature09782]]. [[পাবমেড সেন্ট্রাল|PMC]] <span class="cs1-lock-free" title="Freely accessible">[//www.ncbi.nlm.nih.gov/pmc/articles/PMC3131688 3131688]</span>. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/21248839 21248839].</cite></ref> |
|||
অন্যদিকে, মাইক্রোঅটোফ্যাজি লাইসোসোমে সাইটোপ্লাজমিক উপাদানের সরাসরি আবদ্ধতা জড়িত। এটি invagination দ্বারা ঘটে, যার অর্থ লাইসোসোমাল ঝিল্লির অভ্যন্তরীণ ভাঁজ, বা সেলুলার প্রোট্রুশন। |
|||
| ⚫ | '''[[মাইটোফেজি|মাইটোফ্যাজি]]''' হল অটোফ্যাজি দ্বারা [[মাইটোকন্ড্রিয়া|মাইটোকন্ড্রিয়ার]] নির্বাচনী অবক্ষয়। এটি প্রায়ই ক্ষতি বা চাপের পরে ত্রুটিপূর্ণ মাইটোকন্ড্রিয়ায় ঘটে। মাইটোফ্যাগি মাইটোকন্ড্রিয়ার টার্নওভারকে উৎসাহিত করে এবং অকার্যকর মাইটোকন্ড্রিয়া জমা হতে বাধা দেয় যা সেলুলার অবক্ষয়ের দিকে পরিচালিত করতে পারে। এটি স্তন্যপায়ী প্রাণীদের মধ্যে Atg32 (খামিরে) এবং NIX এবং এর নিয়ন্ত্রক BNIP3 দ্বারা মধ্যস্থতা করা হয়। মাইটোফ্যাজি PINK1 এবং পার্কিন প্রোটিন দ্বারা নিয়ন্ত্রিত হয়। মাইটোফ্যাজির ঘটনা শুধুমাত্র ক্ষতিগ্রস্ত মাইটোকন্ড্রিয়াতেই সীমাবদ্ধ নয় বরং এর সাথে ক্ষতিগ্রস্থদেরও জড়িত। <ref name="auto">{{সাময়িকী উদ্ধৃতি|vauthors=Youle RJ, Narendra DP|তারিখ=January 2011|শিরোনাম=Mechanisms of mitophagy|পাতাসমূহ=9–14|doi=10.1038/nrm3028|pmc=4780047|pmid=21179058}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFYouleNarendra2011">Youle RJ, Narendra DP (January 2011). [//www.ncbi.nlm.nih.gov/pmc/articles/PMC4780047 "Mechanisms of mitophagy"]. ''Nature Reviews Molecular Cell Biology''. '''12''' (1): 9–14. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:[[doi:10.1038/nrm3028|10.1038/nrm3028]]. [[পাবমেড সেন্ট্রাল|PMC]] <span class="cs1-lock-free" title="Freely accessible">[//www.ncbi.nlm.nih.gov/pmc/articles/PMC4780047 4780047]</span>. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/21179058 21179058].</cite></ref> |
||
চ্যাপেরোন-মধ্যস্থ অটোফ্যাজি, বা CMA, একটি অত্যন্ত জটিল এবং নির্দিষ্ট পথ, যা hsc70-ধারণকারী কমপ্লেক্স দ্বারা স্বীকৃতি জড়িত। এর মানে হল যে একটি প্রোটিনে অবশ্যই এই hsc70 কমপ্লেক্সের স্বীকৃতির স্থান থাকতে হবে যা এটিকে CMA- সাবস্ট্রেট/চ্যাপেরোন কমপ্লেক্স গঠন করে এই চ্যাপেরোনের সাথে আবদ্ধ হতে দেয়। এই কমপ্লেক্সটি তখন লাইসোসোমাল মেমব্রেন-বাউন্ড প্রোটিনে চলে যায় যা CMA রিসেপ্টরকে চিনবে এবং আবদ্ধ করবে। স্বীকৃতির পর, সাবস্ট্রেট প্রোটিন উন্মোচিত হয় এবং এটি লাইসোসোমাল hsc70 চ্যাপেরোনের সহায়তায় লাইসোসোম ঝিল্লি জুড়ে স্থানান্তরিত হয়। CMA অন্যান্য ধরনের অটোফ্যাজি থেকে উল্লেখযোগ্যভাবে আলাদা কারণ এটি প্রোটিন উপাদানকে একের পর এক করে স্থানান্তরিত করে এবং কোন উপাদান লাইসোসোমাল বাধা অতিক্রম করে সে সম্পর্কে এটি অত্যন্ত নির্বাচনী। |
|||
'''Lipophagy''' হল অটোফ্যাজি দ্বারা লিপিডের অবক্ষয়, <ref name=":1">{{সাময়িকী উদ্ধৃতি|vauthors=Liu K, Czaja MJ|তারিখ=January 2013|শিরোনাম=Regulation of lipid stores and metabolism by lipophagy|পাতাসমূহ=3–11|doi=10.1038/cdd.2012.63|pmc=3524634|pmid=22595754}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFLiuCzaja2013">Liu K, Czaja MJ (January 2013). [//www.ncbi.nlm.nih.gov/pmc/articles/PMC3524634 "Regulation of lipid stores and metabolism by lipophagy"]. ''Cell Death and Differentiation''. '''20''' (1): 3–11. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:[[doi:10.1038/cdd.2012.63|10.1038/cdd.2012.63]]. [[পাবমেড সেন্ট্রাল|PMC]] <span class="cs1-lock-free" title="Freely accessible">[//www.ncbi.nlm.nih.gov/pmc/articles/PMC3524634 3524634]</span>. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/22595754 22595754].</cite></ref> এমন একটি ফাংশন যা প্রাণী এবং ছত্রাক উভয় কোষেই বিদ্যমান বলে প্রমাণিত হয়েছে। <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Ward C, Martinez-Lopez N, Otten EG, Carroll B, Maetzel D, Singh R, Sarkar S, Korolchuk VI|তারিখ=April 2016|শিরোনাম=Autophagy, lipophagy and lysosomal lipid storage disorders|পাতাসমূহ=269–84|doi=10.1016/j.bbalip.2016.01.006|pmid=26778751|doi-access=free}}</ref> উদ্ভিদ কোষে লাইপোফ্যাগির ভূমিকা অবশ্য অধরা থেকে যায়। <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Elander PH, Minina EA, Bozhkov PV|তারিখ=March 2018|শিরোনাম=Autophagy in turnover of lipid stores: trans-kingdom comparison|পাতাসমূহ=1301–1311|doi=10.1093/jxb/erx433|pmid=29309625|doi-access=free}}</ref> লিপোফ্যাজিতে লক্ষ্যবস্তু হল লিপিড কাঠামো যাকে লিপিড ড্রপলেট (LDs), গোলাকার "অর্গানেলস" বলা হয় যা প্রধানত ট্রায়াসিলগ্লিসারল ( [[ট্রাইগ্লিসেরাইড|TAGs]] ) এবং [[ফসফোলিপিড]] এবং মেমব্রেন প্রোটিনের এক স্তর বিশিষ্ট। প্রাণী কোষে প্রধান লাইপোফ্যাজিক পথ হল ফ্যাগোফোর, ম্যাক্রোঅটোফ্যাজি দ্বারা এলডি-র আবদ্ধ হওয়ার মাধ্যমে। অন্যদিকে ছত্রাকের কোষগুলিতে মাইক্রোপ্লিপোফ্যাজি প্রধান পথ তৈরি করে এবং বিশেষ করে উদীয়মান খামির ''স্যাকারোমাইসিস সেরেভিসিয়াতে'' ভালভাবে অধ্যয়ন করা হয় <ref>{{সাময়িকী উদ্ধৃতি|vauthors=van Zutphen T, Todde V, de Boer R, Kreim M, Hofbauer HF, Wolinski H, Veenhuis M, van der Klei IJ, Kohlwein SD|তারিখ=January 2014|শিরোনাম=Lipid droplet autophagy in the yeast Saccharomyces cerevisiae|পাতাসমূহ=290–301|doi=10.1091/mbc.E13-08-0448|pmc=3890349|pmid=24258026}}</ref> ''।'' Lipophagy প্রথম ইঁদুরের মধ্যে আবিষ্কৃত হয়েছিল এবং 2009 সালে প্রকাশিত হয়েছিল। <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Singh R, Kaushik S, Wang Y, Xiang Y, Novak I, Komatsu M, Tanaka K, Cuervo AM, Czaja MJ|তারিখ=April 2009|শিরোনাম=Autophagy regulates lipid metabolism|পাতাসমূহ=1131–5|doi=10.1038/nature07976|pmc=2676208|pmid=19339967}}</ref> |
|||
| ⚫ | মাইটোফ্যাজি হল অটোফ্যাজি দ্বারা মাইটোকন্ড্রিয়ার নির্বাচনী অবক্ষয়। এটি প্রায়ই ক্ষতি বা চাপের পরে ত্রুটিপূর্ণ মাইটোকন্ড্রিয়ায় ঘটে। মাইটোফ্যাগি মাইটোকন্ড্রিয়ার টার্নওভারকে উৎসাহিত করে এবং অকার্যকর মাইটোকন্ড্রিয়া জমা হতে বাধা দেয় যা সেলুলার অবক্ষয়ের দিকে পরিচালিত করতে পারে। এটি স্তন্যপায়ী প্রাণীদের মধ্যে Atg32 (খামিরে) এবং NIX এবং এর নিয়ন্ত্রক BNIP3 দ্বারা মধ্যস্থতা করা হয়। মাইটোফ্যাজি PINK1 এবং পার্কিন প্রোটিন দ্বারা নিয়ন্ত্রিত হয়। মাইটোফ্যাজির ঘটনা শুধুমাত্র |
||
| ⚫ | অটোফ্যাজি জিনাস-নির্দিষ্ট প্রোটিনকে লক্ষ্য করে, তাই অর্থলগাস প্রোটিন যা একে অপরের সাথে সিকোয়েন্স হোমোলজি শেয়ার করে একটি নির্দিষ্ট অটোফ্যাজি টার্গেটিং প্রোটিন দ্বারা সাবস্ট্রেট হিসাবে স্বীকৃত হয়। অটোফ্যাজি টার্গেটিং প্রোটিনের একটি পরিপূরকতা বিদ্যমান যা মিউটেশনের পরে সম্ভাব্য সংক্রমণের ঝুঁকি বাড়ায়। 3টি অটোফ্যাজি প্রোটিনের লক্ষ্যগুলির মধ্যে ওভারল্যাপের অভাব এবং জেনারার পরিপ্রেক্ষিতে বড় ওভারল্যাপ দেখায় যে অটোফ্যাজি একই প্যাথোজেন থেকে ব্যাকটেরিয়া প্রোটিনের বিভিন্ন সেটকে লক্ষ্য করতে পারে। একদিকে, একই জেনারে টার্গেট করার অপ্রয়োজনীয়তা শক্তিশালী প্যাথোজেন স্বীকৃতির জন্য উপকারী। কিন্তু, অন্যদিকে, নির্দিষ্ট ব্যাকটেরিয়া প্রোটিনের পরিপূরকতা হোস্টকে দীর্ঘস্থায়ী ব্যাধি এবং সংক্রমণের জন্য আরও সংবেদনশীল করে তুলতে পারে যদি অটোফ্যাজি টার্গেটিং প্রোটিনগুলির মধ্যে একটির এনকোডিং জিন পরিবর্তিত হয়ে যায়, এবং অটোফ্যাজি সিস্টেমটি ওভারলোড হয় বা অন্যান্য ত্রুটির শিকার হয়। তাছাড়া, অটোফ্যাজি টার্গেট করে ভাইরুলেন্স ফ্যাক্টর এবং ভাইরাসজনিত ফ্যাক্টরগুলি আরও সাধারণ ফাংশনের জন্য দায়ী যেমন পুষ্টি অধিগ্রহণ এবং গতিশীলতা একাধিক অটোফ্যাজি টার্গেটিং প্রোটিন দ্বারা স্বীকৃত হয়। এবং অটোলাইসিন এবং আয়রন সিকোয়েস্টারিং প্রোটিনের মতো বিশেষ ভাইরাসজনিত কারণগুলি একটি একক অটোফ্যাজি টার্গেটিং প্রোটিন দ্বারা সম্ভাব্যভাবে স্বীকৃত হয়। অটোফ্যাজি প্রোটিন CALCOCO2/NDP52 এবং MAP1LC3/LC3 বিশেষভাবে প্যাথোজেন বা প্যাথোজেনিক প্রোটিনকে অটোফ্যাজিক অবক্ষয়ের লক্ষ্যে বিবর্তিত হতে পারে। যদিও SQSTM1/p62 আরও জেনেরিক ব্যাকটেরিয়া প্রোটিনকে লক্ষ্য করে যাতে একটি টার্গেট মোটিফ থাকে কিন্তু ভাইরাসের সাথে সম্পর্কিত নয়। <ref name=":5">{{সাময়িকী উদ্ধৃতি|vauthors=Sudhakar P, Jacomin AC, Hautefort I, Samavedam S, Fatemian K, Ari E, Gul L, Demeter A, Jones E, Korcsmaros T, Nezis IP|তারিখ=September 2019|শিরোনাম=Targeted interplay between bacterial pathogens and host autophagy|পাতাসমূহ=1620–1633|doi=10.1080/15548627.2019.1590519|pmc=6693458|pmid=30909843}} [[File:CC-BY_icon.svg|50x50পিক্সেল]] Text was copied from this source, which is available under a [[creativecommons:by/4.0/|Creative Commons Attribution 4.0 International License]].</ref> |
||
Lipophagy হল অটোফ্যাজি দ্বারা লিপিডের অবক্ষয়, একটি ফাংশন যা প্রাণী এবং ছত্রাক উভয় কোষেই বিদ্যমান। উদ্ভিদ কোষে লিপোফ্যাজির ভূমিকা অবশ্য অধরা থেকে যায়। লিপোফ্যাজিতে লক্ষ্যবস্তু হল লিপিড কাঠামো যাকে লিপিড ড্রপলেট (LDs), গোলাকার "অর্গানেলস" বলা হয় যার একটি কোর প্রধানত ট্রায়াসিলগ্লিসারল (TAGs) এবং ফসফোলিপিড এবং মেমব্রেন প্রোটিনের এক স্তর। প্রাণী কোষে প্রধান লাইপোফ্যাজিক পথ হল ফ্যাগোফোর, ম্যাক্রোঅটোফ্যাজি দ্বারা এলডি-এর আচ্ছন্নতার মাধ্যমে। অন্যদিকে ছত্রাক কোষে মাইক্রোপ্লিপোফ্যাজি প্রধান পথ তৈরি করে এবং বিশেষ করে উদীয়মান খামির স্যাকারোমাইসিস সেরেভিসিয়াতে ভালভাবে অধ্যয়ন করা হয়। Lipophagy প্রথম ইঁদুর মধ্যে আবিষ্কৃত এবং 2009 প্রকাশিত হয়. |
|||
| ⚫ | অন্যদিকে, বিভিন্ন প্যাথোজেনিক জেনার থেকে ব্যাকটেরিয়া প্রোটিনগুলিও অটোফ্যাজিকে সংশোধন করতে সক্ষম। অটোফ্যাজির পর্যায়গুলিতে জিনাস-নির্দিষ্ট নিদর্শন রয়েছে যা সম্ভাব্যভাবে একটি প্রদত্ত প্যাথোজেন গ্রুপ দ্বারা নিয়ন্ত্রিত হয়। কিছু অটোফ্যাজি পর্যায়গুলি শুধুমাত্র নির্দিষ্ট প্যাথোজেন দ্বারা সংশোধিত হতে পারে, যখন কিছু পর্যায় একাধিক প্যাথোজেন জেনার দ্বারা সংশোধিত হয়। ইন্টারপ্লে-সম্পর্কিত কিছু ব্যাকটেরিয়া প্রোটিনের প্রোটিওলাইটিক এবং পোস্ট-ট্রান্সলেশনাল ক্রিয়াকলাপ যেমন ফসফোরিলেশন এবং সর্বব্যাপী এবং অটোফ্যাজি প্রোটিনের কার্যকলাপে হস্তক্ষেপ করতে পারে। <ref name=":5">{{সাময়িকী উদ্ধৃতি|vauthors=Sudhakar P, Jacomin AC, Hautefort I, Samavedam S, Fatemian K, Ari E, Gul L, Demeter A, Jones E, Korcsmaros T, Nezis IP|তারিখ=September 2019|শিরোনাম=Targeted interplay between bacterial pathogens and host autophagy|পাতাসমূহ=1620–1633|doi=10.1080/15548627.2019.1590519|pmc=6693458|pmid=30909843}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFSudhakarJacominHautefortSamavedam2019">Sudhakar P, Jacomin AC, Hautefort I, Samavedam S, Fatemian K, Ari E, et al. (September 2019). [//www.ncbi.nlm.nih.gov/pmc/articles/PMC6693458 "Targeted interplay between bacterial pathogens and host autophagy"]. ''Autophagy''. '''15''' (9): 1620–1633. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:[[doi:10.1080/15548627.2019.1590519|10.1080/15548627.2019.1590519]]. [[পাবমেড সেন্ট্রাল|PMC]] <span class="cs1-lock-free" title="Freely accessible">[//www.ncbi.nlm.nih.gov/pmc/articles/PMC6693458 6693458]</span>. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/30909843 30909843].</cite> [[File:CC-BY_icon.svg|50x50পিক্সেল]] Text was copied from this source, which is available under a [[creativecommons:by/4.0/|Creative Commons Attribution 4.0 International License]].</ref> |
||
| ⚫ | অটোফ্যাজি অটোফ্যাজি-সম্পর্কিত (এটিজি) জিন দ্বারা কার্যকর করা হয়। 2003 সালের আগে, দশ বা ততোধিক নাম ব্যবহার করা হয়েছিল, কিন্তু এই বিন্দুর পরে ছত্রাক অটোফ্যাজি গবেষকদের দ্বারা একটি একীভূত নামকরণ তৈরি করা হয়েছিল। <ref name=":2">{{সাময়িকী উদ্ধৃতি|vauthors=Klionsky DJ|তারিখ=September 2012|শিরোনাম=Look people, "Atg" is an abbreviation for "autophagy-related." That's it|পাতাসমূহ=1281–2|doi=10.4161/auto.21812|pmc=3442874|pmid=22889836}}</ref> Atg বা ATG মানে অটোফ্যাজি সম্পর্কিত। এটি জিন বা প্রোটিন নির্দিষ্ট করে না। <ref name=":2" /> |
||
'''''ব্যাকটেরিয়া প্যাথোজেন এবং হোস্ট অটোফ্যাজির মধ্যে লক্ষ্যযুক্ত ইন্টারপ্লে :''''' |
|||
''স্যাকারোমাইসিস সেরেভিসিয়াতে'' পরিচালিত জেনেটিক স্ক্রিন দ্বারা প্রথম অটোফ্যাজি জিনগুলি সনাক্ত করা হয়েছিল। <ref name="klionsky 1992">{{সাময়িকী উদ্ধৃতি|vauthors=Klionsky DJ, Cueva R, Yaver DS|তারিখ=October 1992|শিরোনাম=Aminopeptidase I of Saccharomyces cerevisiae is localized to the vacuole independent of the secretory pathway|পাতাসমূহ=287–99|doi=10.1083/jcb.119.2.287|pmc=2289658|pmid=1400574}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFKlionskyCuevaYaver1992">Klionsky DJ, Cueva R, Yaver DS (October 1992). [//www.ncbi.nlm.nih.gov/pmc/articles/PMC2289658 "Aminopeptidase I of Saccharomyces cerevisiae is localized to the vacuole independent of the secretory pathway"]. ''The Journal of Cell Biology''. '''119''' (2): 287–99. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:[[doi:10.1083/jcb.119.2.287|10.1083/jcb.119.2.287]]. [[পাবমেড সেন্ট্রাল|PMC]] <span class="cs1-lock-free" title="Freely accessible">[//www.ncbi.nlm.nih.gov/pmc/articles/PMC2289658 2289658]</span>. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/1400574 1400574].</cite></ref> <ref name="ohsumi 1992">{{সাময়িকী উদ্ধৃতি|vauthors=Takeshige K, Baba M, Tsuboi S, Noda T, Ohsumi Y|তারিখ=October 1992|শিরোনাম=Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction|পাতাসমূহ=301–11|doi=10.1083/jcb.119.2.301|pmc=2289660|pmid=1400575}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFTakeshigeBabaTsuboiNoda1992">Takeshige K, Baba M, Tsuboi S, Noda T, Ohsumi Y (October 1992). [//www.ncbi.nlm.nih.gov/pmc/articles/PMC2289660 "Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction"]. ''The Journal of Cell Biology''. '''119''' (2): 301–11. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:[[doi:10.1083/jcb.119.2.301|10.1083/jcb.119.2.301]]. [[পাবমেড সেন্ট্রাল|PMC]] <span class="cs1-lock-free" title="Freely accessible">[//www.ncbi.nlm.nih.gov/pmc/articles/PMC2289660 2289660]</span>. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/1400575 1400575].</cite></ref> <ref name="thumm 1994">{{সাময়িকী উদ্ধৃতি|vauthors=Thumm M, Egner R, Koch B, Schlumpberger M, Straub M, Veenhuis M, Wolf DH|তারিখ=August 1994|শিরোনাম=Isolation of autophagocytosis mutants of Saccharomyces cerevisiae|পাতাসমূহ=275–80|doi=10.1016/0014-5793(94)00672-5|pmid=8050581}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFThummEgnerKochSchlumpberger1994">Thumm M, Egner R, Koch B, Schlumpberger M, Straub M, Veenhuis M, Wolf DH (August 1994). "Isolation of autophagocytosis mutants of Saccharomyces cerevisiae". ''FEBS Letters''. '''349''' (2): 275–80. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:[[doi:10.1016/0014-5793(94)00672-5|10.1016/0014-5793(94)00672-5]]. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/8050581 8050581]. [[S2CID (শনাক্তকারী)|S2CID]] [https://api.semanticscholar.org/CorpusID:26072787 26072787].</cite></ref> <ref name="ohsumi 1993">{{সাময়িকী উদ্ধৃতি|vauthors=Tsukada M, Ohsumi Y|তারিখ=October 1993|শিরোনাম=Isolation and characterization of autophagy-defective mutants of Saccharomyces cerevisiae|পাতাসমূহ=169–74|doi=10.1016/0014-5793(93)80398-e|pmid=8224160|doi-access=free}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFTsukadaOhsumi1993">Tsukada M, Ohsumi Y (October 1993). [[doi:10.1016/0014-5793(93)80398-e|"Isolation and characterization of autophagy-defective mutants of Saccharomyces cerevisiae"]]. ''FEBS Letters''. '''333''' (1–2): 169–74. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:<span class="cs1-lock-free" title="Freely accessible">[[doi:10.1016/0014-5793(93)80398-e|10.1016/0014-5793(93)80398-e]]</span>. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/8224160 8224160]. [[S2CID (শনাক্তকারী)|S2CID]] [https://api.semanticscholar.org/CorpusID:46017791 46017791].</cite></ref> <ref name="klionsky 1995">{{সাময়িকী উদ্ধৃতি|vauthors=Harding TM, Morano KA, Scott SV, Klionsky DJ|তারিখ=November 1995|শিরোনাম=Isolation and characterization of yeast mutants in the cytoplasm to vacuole protein targeting pathway|পাতাসমূহ=591–602|doi=10.1083/jcb.131.3.591|pmc=2120622|pmid=7593182}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFHardingMoranoScottKlionsky1995">Harding TM, Morano KA, Scott SV, Klionsky DJ (November 1995). [//www.ncbi.nlm.nih.gov/pmc/articles/PMC2120622 "Isolation and characterization of yeast mutants in the cytoplasm to vacuole protein targeting pathway"]. ''The Journal of Cell Biology''. '''131''' (3): 591–602. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:[[doi:10.1083/jcb.131.3.591|10.1083/jcb.131.3.591]]. [[পাবমেড সেন্ট্রাল|PMC]] <span class="cs1-lock-free" title="Freely accessible">[//www.ncbi.nlm.nih.gov/pmc/articles/PMC2120622 2120622]</span>. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/7593182 7593182].</cite></ref> তাদের সনাক্তকরণের পরে সেই জিনগুলি কার্যকরীভাবে চিহ্নিত করা হয়েছিল এবং বিভিন্ন ধরণের জীবের মধ্যে তাদের অর্থলগগুলি সনাক্ত করা হয়েছিল এবং অধ্যয়ন করা হয়েছিল। <ref name="mizushima 2011 ARCDB review">{{সাময়িকী উদ্ধৃতি|vauthors=Mizushima N, Yoshimori T, Ohsumi Y|তারিখ=10 November 2011|শিরোনাম=The role of Atg proteins in autophagosome formation|পাতাসমূহ=107–32|doi=10.1146/annurev-cellbio-092910-154005|pmid=21801009}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFMizushimaYoshimoriOhsumi2011">Mizushima N, Yoshimori T, Ohsumi Y (10 November 2011). "The role of Atg proteins in autophagosome formation". ''Annual Review of Cell and Developmental Biology''. '''27''' (1): 107–32. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:[[doi:10.1146/annurev-cellbio-092910-154005|10.1146/annurev-cellbio-092910-154005]]. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/21801009 21801009].</cite></ref> <ref name="A. Lamb, T. Yoshimori 2013">{{সাময়িকী উদ্ধৃতি|vauthors=Lamb CA, Yoshimori T, Tooze SA|তারিখ=December 2013|শিরোনাম=The autophagosome: origins unknown, biogenesis complex|পাতাসমূহ=759–74|doi=10.1038/nrm3696|pmid=24201109}}</ref> আজ, ছত্রিশটি এটিজি প্রোটিনকে অটোফ্যাজির জন্য বিশেষভাবে গুরুত্বপূর্ণ হিসাবে শ্রেণীবদ্ধ করা হয়েছে, যার মধ্যে 18টি মূল যন্ত্রপাতির অন্তর্গত <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Suzuki H, Osawa T, Fujioka Y, Noda NN|তারিখ=April 2017|শিরোনাম=Structural biology of the core autophagy machinery|পাতাসমূহ=10–17|doi=10.1016/j.sbi.2016.09.010|pmid=27723509|doi-access=free}}</ref> |
|||
স্তন্যপায়ী প্রাণীদের মধ্যে, [[অ্যামিনো অ্যাসিড]] সংবেদন এবং অতিরিক্ত সংকেত যেমন বৃদ্ধির কারণ এবং প্রতিক্রিয়াশীল অক্সিজেন প্রজাতি প্রোটিন কাইনেস এমটিওআর এবং এএমপিকে এর কার্যকলাপ নিয়ন্ত্রণ করে। <ref name="A. Lamb, T. Yoshimori 2013">{{সাময়িকী উদ্ধৃতি|vauthors=Lamb CA, Yoshimori T, Tooze SA|তারিখ=December 2013|শিরোনাম=The autophagosome: origins unknown, biogenesis complex|পাতাসমূহ=759–74|doi=10.1038/nrm3696|pmid=24201109}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFLambYoshimoriTooze2013">Lamb CA, Yoshimori T, Tooze SA (December 2013). "The autophagosome: origins unknown, biogenesis complex". ''Nature Reviews. Molecular Cell Biology''. '''14''' (12): 759–74. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:[[doi:10.1038/nrm3696|10.1038/nrm3696]]. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/24201109 24201109]. [[S2CID (শনাক্তকারী)|S2CID]] [https://api.semanticscholar.org/CorpusID:24083190 24083190].</cite></ref> <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Russell RC, Yuan HX, Guan KL|তারিখ=January 2014|শিরোনাম=Autophagy regulation by nutrient signaling|পাতাসমূহ=42–57|doi=10.1038/cr.2013.166|pmc=3879708|pmid=24343578}}</ref> এই দুটি কাইনেস Unc-51-এর মতো কাইনেস ULK1 এবং ULK2 (Atg1-এর স্তন্যপায়ী হোমোলগ) এর ইনহিবিটরি ফসফোরিলেশনের মাধ্যমে অটোফ্যাজি নিয়ন্ত্রণ করে। <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Chan EY|তারিখ=September 2012|শিরোনাম=Regulation and function of uncoordinated-51 like kinase proteins|পাতাসমূহ=775–85|doi=10.1089/ars.2011.4396|pmid=22074133}}</ref> অটোফ্যাজি আনয়নের ফলে ডিফসফোরিলেশন এবং ইউএলকে কাইনেস সক্রিয় হয়। ULK হল একটি প্রোটিন কমপ্লেক্সের অংশ যেখানে Atg13, Atg101 এবং FIP200 রয়েছে । ULK ফসফরিলেট এবং সক্রিয় করে বেক্লিন -1 (Atg6 এর স্তন্যপায়ী হোমোলগ ), <ref name="Russell_2013">{{সাময়িকী উদ্ধৃতি|vauthors=Russell RC, Tian Y, Yuan H, Park HW, Chang YY, Kim J, Kim H, Neufeld TP, Dillin A, Guan KL|তারিখ=July 2013|শিরোনাম=ULK1 induces autophagy by phosphorylating Beclin-1 and activating VPS34 lipid kinase|পাতাসমূহ=741–50|doi=10.1038/ncb2757|pmc=3885611|pmid=23685627}}</ref> যা একটি প্রোটিন কমপ্লেক্সেরও অংশ। অটোফ্যাজি-ইনডিউসিবল বেক্লিন-1 কমপ্লেক্স <ref name="Itakura_2008">{{সাময়িকী উদ্ধৃতি|vauthors=Itakura E, Kishi C, Inoue K, Mizushima N|তারিখ=December 2008|শিরোনাম=Beclin 1 forms two distinct phosphatidylinositol 3-kinase complexes with mammalian Atg14 and UVRAG|পাতাসমূহ=5360–72|doi=10.1091/mbc.E08-01-0080|pmc=2592660|pmid=18843052}}</ref> প্রোটিন PIK3R4 (p150), Atg14L এবং ক্লাস III ফসফেটিডাইলিনোসিটল 3-ফসফেট কিনেস (PI(3)K) Vps34 ধারণ করে । <ref name="Kang_2011">{{সাময়িকী উদ্ধৃতি|vauthors=Kang R, Zeh HJ, Lotze MT, Tang D|তারিখ=April 2011|শিরোনাম=The Beclin 1 network regulates autophagy and apoptosis|পাতাসমূহ=571–80|doi=10.1038/cdd.2010.191|pmc=3131912|pmid=21311563}}</ref> সক্রিয় ULK এবং Beclin-1 কমপ্লেক্সগুলি অটোফ্যাগোসোম সূচনার স্থান, ফাগোফোরে পুনরায় স্থানীয়করণ করে, যেখানে তারা উভয়ই ডাউনস্ট্রিম অটোফ্যাজি উপাদানগুলির সক্রিয়করণে অবদান রাখে। <ref name="Di_Bartolomeo_2010">{{সাময়িকী উদ্ধৃতি|vauthors=Di Bartolomeo S, Corazzari M, Nazio F, Oliverio S, Lisi G, Antonioli M, Pagliarini V, Matteoni S, Fuoco C, Giunta L, D'Amelio M, Nardacci R, Romagnoli A, Piacentini M, Cecconi F, Fimia GM|তারিখ=October 2010|শিরোনাম=The dynamic interaction of AMBRA1 with the dynein motor complex regulates mammalian autophagy|পাতাসমূহ=155–68|doi=10.1083/jcb.201002100|pmc=2953445|pmid=20921139}}</ref> <ref name="Hara_2008">{{সাময়িকী উদ্ধৃতি|vauthors=Hara T, Takamura A, Kishi C, Iemura S, Natsume T, Guan JL, Mizushima N|তারিখ=May 2008|শিরোনাম=FIP200, a ULK-interacting protein, is required for autophagosome formation in mammalian cells|পাতাসমূহ=497–510|doi=10.1083/jcb.200712064|pmc=2364687|pmid=18443221}}</ref> |
|||
| ⚫ | অটোফ্যাজি জিনাস-নির্দিষ্ট প্রোটিনকে লক্ষ্য করে, তাই অর্থলগাস প্রোটিন যা একে অপরের সাথে সিকোয়েন্স হোমোলজি শেয়ার করে একটি নির্দিষ্ট অটোফ্যাজি টার্গেটিং প্রোটিন দ্বারা সাবস্ট্রেট হিসাবে স্বীকৃত হয়। অটোফ্যাজি টার্গেটিং প্রোটিনের একটি পরিপূরকতা বিদ্যমান যা মিউটেশনের পরে সম্ভাব্য সংক্রমণের ঝুঁকি বাড়ায়। 3টি অটোফ্যাজি প্রোটিনের লক্ষ্যগুলির মধ্যে ওভারল্যাপের অভাব এবং জেনারার পরিপ্রেক্ষিতে বড় ওভারল্যাপ দেখায় যে অটোফ্যাজি একই প্যাথোজেন থেকে ব্যাকটেরিয়া প্রোটিনের বিভিন্ন সেটকে লক্ষ্য করতে পারে। একদিকে, একই জেনারে টার্গেট করার অপ্রয়োজনীয়তা শক্তিশালী প্যাথোজেন স্বীকৃতির জন্য উপকারী। কিন্তু, অন্যদিকে, নির্দিষ্ট ব্যাকটেরিয়া প্রোটিনের পরিপূরকতা হোস্টকে দীর্ঘস্থায়ী ব্যাধি এবং সংক্রমণের জন্য আরও সংবেদনশীল করে তুলতে পারে যদি অটোফ্যাজি টার্গেটিং প্রোটিনগুলির মধ্যে একটির এনকোডিং জিন পরিবর্তিত হয়ে যায়, এবং অটোফ্যাজি সিস্টেমটি ওভারলোড হয় বা অন্যান্য ত্রুটির শিকার হয়। তাছাড়া, অটোফ্যাজি টার্গেট করে ভাইরুলেন্স ফ্যাক্টর এবং ভাইরাসজনিত ফ্যাক্টরগুলি আরও সাধারণ ফাংশনের জন্য দায়ী যেমন পুষ্টি অধিগ্রহণ এবং গতিশীলতা একাধিক অটোফ্যাজি টার্গেটিং প্রোটিন দ্বারা স্বীকৃত হয়। এবং অটোলাইসিন এবং আয়রন সিকোয়েস্টারিং প্রোটিনের মতো বিশেষ ভাইরাসজনিত কারণগুলি একটি একক অটোফ্যাজি টার্গেটিং প্রোটিন দ্বারা সম্ভাব্যভাবে স্বীকৃত হয়। অটোফ্যাজি প্রোটিন CALCOCO2/NDP52 এবং MAP1LC3/LC3 |
||
| ⚫ | একবার সক্রিয় হলে, VPS34 ফসফরিলেট করে [[লিপিড]] ফসফ্যাটিডাইলিনোসিটলকে ফ্যাগোফোরের পৃষ্ঠে ফসফ্যাটিডিলিনোসিটল 3-ফসফেট (PtdIns(3)P) তৈরি করতে। উৎপন্ন PtdIns(3)P একটি PtdIns(3)P বাঁধাই মোটিফকে আশ্রয়কারী প্রোটিনের জন্য ডকিং পয়েন্ট হিসাবে ব্যবহৃত হয়। WIPI2, WIPI (WD-রিপিট প্রোটিন ফসফাইনোসাইটাইডের সাথে ইন্টারঅ্যাক্ট করে) প্রোটিন পরিবারের একটি PtdIns(3)P বাইন্ডিং প্রোটিন, সম্প্রতি Atg16L1 কে শারীরিকভাবে আবদ্ধ দেখানো হয়েছে। <ref>T. Proikas-Cézanne, Z. Takacs, P. Donnes, and O. Kohlbacher, 'Wipi Proteins: Essential Ptdins3p Effectors at the Nascent Autophagosome', J Cell Sci, 128 (2015), 207-17</ref> Atg16L1 হল একটি E3-এর মতো প্রোটিন কমপ্লেক্সের সদস্য যা অটোফ্যাগোসোম গঠনের জন্য প্রয়োজনীয় দুটি ইউবিকুইটিনের মতো কনজুগেশন সিস্টেমের একটিতে জড়িত। FIP200 cis-Golgi- থেকে প্রাপ্ত ঝিল্লি ATG16L1-পজিটিভ এন্ডোসোমাল ঝিল্লির সাথে ফিউজ করে হাইপাস (হাইব্রিড প্রি-অটোফ্যাগোসোমাল স্ট্রাকচার) নামক প্রোফাগোফোর গঠন করে। <ref name=":6">{{সাময়িকী উদ্ধৃতি|শেষাংশ=Kumar|প্রথমাংশ=Suresh|শেষাংশ২=Javed|প্রথমাংশ২=Ruheena|তারিখ=November 2021|শিরোনাম=Mammalian hybrid pre-autophagosomal structure HyPAS generates autophagosomes|ইউআরএল=https://linkinghub.elsevier.com/retrieve/pii/S0092867421012332|পাতাসমূহ=5950–5969.e22|ভাষা=en|doi=10.1016/j.cell.2021.10.017|pmc=8616855|pmid=34741801}}</ref> ATG16L1 WIPI2 <ref name="pmid24954904">{{সাময়িকী উদ্ধৃতি|vauthors=Dooley HC, Razi M, Polson HE, Girardin SE, Wilson MI, Tooze SA|তারিখ=July 2014|শিরোনাম=WIPI2 links LC3 conjugation with PI3P, autophagosome formation, and pathogen clearance by recruiting Atg12-5-16L1|পাতাসমূহ=238–52|doi=10.1016/j.molcel.2014.05.021|pmc=4104028|pmid=24954904}}</ref> এর সাথে আবদ্ধ হওয়া ATG16L1 এর কার্যকলাপের মধ্যস্থতা করে। এটি একটি ইউবিকুইটিন-সদৃশ কনজুগেশন সিস্টেমের মাধ্যমে প্রোফাগোফোরকে ATG8-পজিটিভ ফ্যাগোফোর <ref name=":6" /> -এ রূপান্তরিত করে। |
||
| ⚫ | অন্যদিকে, বিভিন্ন প্যাথোজেনিক জেনার থেকে ব্যাকটেরিয়া প্রোটিনগুলিও অটোফ্যাজিকে সংশোধন করতে সক্ষম। অটোফ্যাজির পর্যায়গুলিতে |
||
[[সমযোজী বন্ধন|অটোফ্যাজিতে]] জড়িত দুটি ইউবিকুইটিন-সদৃশ সংযোগ ব্যবস্থার মধ্যে প্রথমটি ইউবিকুইটিনের মতো প্রোটিন Atg12 কে Atg5 এর সাথে সংযুক্ত করে। ফলস্বরূপ কনজুগেট প্রোটিনটি তখন Atg16L1 কে একটি E3-এর মতো কমপ্লেক্স তৈরি করতে আবদ্ধ করে যা দ্বিতীয় ইউবিকিটিন-সদৃশ সংযোগ ব্যবস্থার অংশ হিসাবে কাজ করে। <ref name="pmid17986448">{{সাময়িকী উদ্ধৃতি|vauthors=Hanada T, Noda NN, Satomi Y, Ichimura Y, Fujioka Y, Takao T, Inagaki F, Ohsumi Y|তারিখ=December 2007|শিরোনাম=The Atg12-Atg5 conjugate has a novel E3-like activity for protein lipidation in autophagy|পাতাসমূহ=37298–302|doi=10.1074/jbc.C700195200|pmid=17986448|doi-access=free}}</ref> এই জটিলটি Atg3 কে আবদ্ধ করে এবং সক্রিয় করে, যা স্তন্যপায়ী হোমোলগগুলিকে ইউবিকুইটিন-সদৃশ ইস্ট প্রোটিন ATG8 ( LC3A-C, GATE16, এবং GABARAPL1-3) সংযুক্ত করে, যা সবচেয়ে বেশি অধ্যয়ন করা হয় LC3 প্রোটিন, পৃষ্ঠের লিপিড ফসফ্যাটিডাইলেথানোলামিনের সাথে। অটোফ্যাগোসোমের। <ref name="pmid15169837">{{সাময়িকী উদ্ধৃতি|vauthors=Kabeya Y, Mizushima N, Yamamoto A, Oshitani-Okamoto S, Ohsumi Y, Yoshimori T|তারিখ=June 2004|শিরোনাম=LC3, GABARAP and GATE16 localize to autophagosomal membrane depending on form-II formation|পাতাসমূহ=2805–12|doi=10.1242/jcs.01131|pmid=15169837|doi-access=free}}</ref> লিপিডেটেড LC3 অটোফাগোসোম বন্ধ করতে অবদান রাখে, <ref name="pmid18768752">{{সাময়িকী উদ্ধৃতি|vauthors=Fujita N, Hayashi-Nishino M, Fukumoto H, Omori H, Yamamoto A, Noda T, Yoshimori T|তারিখ=November 2008|শিরোনাম=An Atg4B mutant hampers the lipidation of LC3 paralogues and causes defects in autophagosome closure|পাতাসমূহ=4651–9|doi=10.1091/mbc.e08-03-0312|pmc=2575160|pmid=18768752}}</ref> এবং নির্দিষ্ট কার্গোস এবং অ্যাডাপ্টার প্রোটিন যেমন Sequestosome-1/ p62 এর ডকিং সক্ষম করে। <ref name="pmid25483962">{{সাময়িকী উদ্ধৃতি|vauthors=Park S, Choi SG, Yoo SM, Son JH, Jung YK|তারিখ=2014|শিরোনাম=Choline dehydrogenase interacts with SQSTM1/p62 to recruit LC3 and stimulate mitophagy|পাতাসমূহ=1906–20|doi=10.4161/auto.32177|pmc=4502719|pmid=25483962}}</ref> সম্পূর্ণ অটোফ্যাগোসোম তারপর SNAREs <ref name="pmid19781582">{{সাময়িকী উদ্ধৃতি|vauthors=Fader CM, Sánchez DG, Mestre MB, Colombo MI|তারিখ=December 2009|শিরোনাম=TI-VAMP/VAMP7 and VAMP3/cellubrevin: two v-SNARE proteins involved in specific steps of the autophagy/multivesicular body pathways|পাতাসমূহ=1901–16|doi=10.1016/j.bbamcr.2009.09.011|pmid=19781582|doi-access=free}}</ref> <ref name="pmid20089838">{{সাময়িকী উদ্ধৃতি|vauthors=Furuta N, Fujita N, Noda T, Yoshimori T, Amano A|তারিখ=March 2010|শিরোনাম=Combinational soluble N-ethylmaleimide-sensitive factor attachment protein receptor proteins VAMP8 and Vti1b mediate fusion of antimicrobial and canonical autophagosomes with lysosomes|পাতাসমূহ=1001–10|doi=10.1091/mbc.e09-08-0693|pmc=2836953|pmid=20089838}}</ref> এবং UVRAG সহ একাধিক প্রোটিনের ক্রিয়াকলাপের মাধ্যমে একটি [[লাইসোসোম|লাইসোসোমের]] সাথে ফিউজ হয়ে যায়। <ref name="pmid25533187">{{সাময়িকী উদ্ধৃতি|vauthors=Kim YM, Jung CH, Seo M, Kim EK, Park JM, Bae SS, Kim DH|তারিখ=January 2015|শিরোনাম=mTORC1 phosphorylates UVRAG to negatively regulate autophagosome and endosome maturation|পাতাসমূহ=207–18|doi=10.1016/j.molcel.2014.11.013|pmc=4304967|pmid=25533187}}</ref> ফিউশন অনুসরণ করে LC3 ভেসিকলের ভিতরের দিকে ধরে রাখা হয় এবং কার্গোর সাথে সাথে ক্ষয়প্রাপ্ত হয়, যখন বাইরের দিকে সংযুক্ত LC3 অণুগুলি Atg4 দ্বারা ক্লিভড হয় এবং পুনর্ব্যবহৃত হয়। <ref name="pmid19322194">{{সাময়িকী উদ্ধৃতি|vauthors=Satoo K, Noda NN, Kumeta H, Fujioka Y, Mizushima N, Ohsumi Y, Inagaki F|তারিখ=May 2009|শিরোনাম=The structure of Atg4B-LC3 complex reveals the mechanism of LC3 processing and delipidation during autophagy|পাতাসমূহ=1341–50|doi=10.1038/emboj.2009.80|pmc=2683054|pmid=19322194}}</ref> অটোলাইসোসোমের বিষয়বস্তু পরবর্তীকালে ক্ষয়প্রাপ্ত হয় এবং তাদের বিল্ডিং ব্লকগুলি ভেসিকল থেকে পারমিজের ক্রিয়াকলাপের মাধ্যমে মুক্তি পায়। <ref name="pmid17021250">{{সাময়িকী উদ্ধৃতি|vauthors=Yang Z, Huang J, Geng J, Nair U, Klionsky DJ|তারিখ=December 2006|শিরোনাম=Atg22 recycles amino acids to link the degradative and recycling functions of autophagy|পাতাসমূহ=5094–104|doi=10.1091/mbc.e06-06-0479|pmc=1679675|pmid=17021250}}</ref> |
|||
== ফাংশন == |
|||
'''''আণবিক জীববিজ্ঞান :''''' |
|||
| ⚫ | বিভিন্ন সেলুলার ফাংশনে অটোফ্যাজির ভূমিকা রয়েছে। একটি বিশেষ উদাহরণ হল খামির, যেখানে পুষ্টির অনাহার উচ্চ স্তরের অটোফ্যাজিকে প্ররোচিত করে। এটি অপ্রয়োজনীয় প্রোটিনগুলিকে অবনমিত করার অনুমতি দেয় এবং বেঁচে থাকার জন্য প্রয়োজনীয় প্রোটিনগুলির সংশ্লেষণের জন্য অ্যামিনো অ্যাসিড পুনর্ব্যবহৃত হয়। <ref name="Klionsky2002">{{সাময়িকী উদ্ধৃতি|vauthors=Reggiori F, Klionsky DJ|তারিখ=February 2002|শিরোনাম=Autophagy in the eukaryotic cell|পাতাসমূহ=11–21|doi=10.1128/EC.01.1.11-21.2002|pmc=118053|pmid=12455967}}</ref> <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Klionsky DJ, Emr SD|তারিখ=December 2000|শিরোনাম=Autophagy as a regulated pathway of cellular degradation|পাতাসমূহ=1717–21|doi=10.1126/science.290.5497.1717|pmc=2732363|pmid=11099404}}</ref> <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Levine B, Klionsky DJ|তারিখ=April 2004|শিরোনাম=Development by self-digestion: molecular mechanisms and biological functions of autophagy|পাতাসমূহ=463–77|doi=10.1016/S1534-5807(04)00099-1|pmid=15068787|doi-access=free}}</ref> উচ্চতর ইউক্যারিওটে, ট্রান্স-প্ল্যাসেন্টাল খাদ্য সরবরাহ বন্ধ করার পরে, সেইসাথে পুষ্টির ক্ষুধার্ত সংস্কৃতিযুক্ত কোষ এবং টিস্যুতে জন্মের সময় প্রাণীদের মধ্যে পুষ্টির হ্রাসের প্রতিক্রিয়া হিসাবে অটোফ্যাজি প্ররোচিত হয়। <ref name="Kuma2004">{{সাময়িকী উদ্ধৃতি|vauthors=Kuma A, Hatano M, Matsui M, Yamamoto A, Nakaya H, Yoshimori T, Ohsumi Y, Tokuhisa T, Mizushima N|তারিখ=December 2004|শিরোনাম=The role of autophagy during the early neonatal starvation period|পাতাসমূহ=1032–6|doi=10.1038/nature03029|pmid=15525940}}</ref> <ref name="Ohsumi2004">{{সাময়িকী উদ্ধৃতি|vauthors=Mizushima N, Yamamoto A, Matsui M, Yoshimori T, Ohsumi Y|তারিখ=March 2004|শিরোনাম=In vivo analysis of autophagy in response to nutrient starvation using transgenic mice expressing a fluorescent autophagosome marker|পাতাসমূহ=1101–11|doi=10.1091/mbc.E03-09-0704|pmc=363084|pmid=14699058}}</ref> মিউট্যান্ট ইস্ট কোষ যাদের অটোফ্যাজিক ক্ষমতা হ্রাস পায় সেগুলি পুষ্টির ঘাটতি অবস্থায় দ্রুত ধ্বংস হয়ে যায়। <ref name="Tsukada93">{{সাময়িকী উদ্ধৃতি|vauthors=Tsukada M, Ohsumi Y|তারিখ=October 1993|শিরোনাম=Isolation and characterization of autophagy-defective mutants of Saccharomyces cerevisiae|পাতাসমূহ=169–74|doi=10.1016/0014-5793(93)80398-E|pmid=8224160|doi-access=free}}</ref> ''এপিজি'' মিউট্যান্টদের উপর অধ্যয়নগুলি পরামর্শ দেয় যে অটোফেজিক দেহের মাধ্যমে অটোফ্যাজি ক্ষুধার্ত অবস্থায় শূন্যস্থানে প্রোটিনের অবক্ষয়ের জন্য অপরিহার্য, এবং অন্তত 15টি এপিজি জিন খামিরের অটোফ্যাজিতে জড়িত। <ref name="Tsukada93" /> ATG7 নামে পরিচিত একটি জিন পুষ্টি-মধ্যস্থিত অটোফ্যাজিতে জড়িত ছিল, কারণ ইঁদুরের গবেষণায় দেখা গেছে যে ক্ষুধা-প্ররোচিত ''অটোফ্যাজি'' atg7-অপ্রতুল ইঁদুরে প্রতিবন্ধী ছিল। <ref name="Ohsumi2004" /> |
||
| ⚫ | |||
ভেসিকুলার স্টোমাটাইটিস ভাইরাস সাইটোসোল থেকে অটোফাগোসোম দ্বারা গ্রহণ করা হয় এবং এন্ডোসোমে স্থানান্তরিত হয় যেখানে টোল-লাইক রিসেপ্টর 7 নামক প্যাটার্ন রিকগনিশন রিসেপ্টর দ্বারা সনাক্ত করা হয়, একক আটকে থাকা [[আরএনএ]] সনাক্ত করে। টোল-সদৃশ রিসেপ্টর সক্রিয় হওয়ার পরে, অন্তঃকোষীয় সিগন্যালিং ক্যাসকেডগুলি শুরু হয়, যার ফলে [[ইন্টারফেরন]] এবং অন্যান্য অ্যান্টিভাইরাল সাইটোকাইনগুলি অন্তর্ভুক্ত হয়। ভাইরাস এবং ব্যাকটেরিয়ার একটি উপসেট তাদের নিজস্ব প্রতিলিপি প্রচারের জন্য অটোফ্যাজিক পথকে বিকৃত করে। <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Jackson WT, Giddings TH, Taylor MP, Mulinyawe S, Rabinovitch M, Kopito RR, Kirkegaard K|তারিখ=May 2005|শিরোনাম=Subversion of cellular autophagosomal machinery by RNA viruses|পাতাসমূহ=e156|doi=10.1371/journal.pbio.0030156|pmc=1084330|pmid=15884975}} {{উন্মুক্ত প্রবেশাধিকার}}</ref> গ্যালেক্টিন-8 সম্প্রতি একটি অন্তঃকোষীয় "বিপদ রিসেপ্টর" হিসাবে চিহ্নিত করা হয়েছে, যা অন্তঃকোষীয় রোগজীবাণুগুলির বিরুদ্ধে অটোফ্যাজি শুরু করতে সক্ষম। যখন গ্যালেক্টিন-8 একটি ক্ষতিগ্রস্ত [[কোষ গহ্বর|ভ্যাকুওলের]] সাথে আবদ্ধ হয়, তখন এটি একটি অটোফ্যাজি অ্যাডাপ্টার নিয়োগ করে যেমন NDP52 যা একটি অটোফ্যাগোসোম এবং ব্যাকটেরিয়া অবক্ষয় গঠনের দিকে পরিচালিত করে। <ref name=":3">{{সাময়িকী উদ্ধৃতি|vauthors=Thurston TL, Wandel MP, von Muhlinen N, Foeglein A, Randow F|তারিখ=January 2012|শিরোনাম=Galectin 8 targets damaged vesicles for autophagy to defend cells against bacterial invasion|পাতাসমূহ=414–8|doi=10.1038/nature10744|pmc=3343631|pmid=22246324}}</ref> |
|||
স্যাকারোমাইসেস সেরেভিসিয়াতে পরিচালিত জেনেটিক স্ক্রিন দ্বারা প্রথম অটোফ্যাজি জিন সনাক্ত করা হয়েছিল। তাদের শনাক্তকরণের পর সেই জিনগুলিকে কার্যকরীভাবে বৈশিষ্ট্যযুক্ত করা হয়েছিল এবং বিভিন্ন জীবের মধ্যে তাদের অর্থলগগুলি চিহ্নিত করা হয়েছিল এবং অধ্যয়ন করা হয়েছিল। আজ, ছত্রিশটি Atg প্রোটিনকে অটোফ্যাজির জন্য বিশেষভাবে গুরুত্বপূর্ণ হিসাবে শ্রেণীবদ্ধ করা হয়েছে, যার মধ্যে 18টি মূল যন্ত্রপাতির অন্তর্গত , স্তন্যপায়ী প্রাণীদের মধ্যে, অ্যামিনো অ্যাসিড সংবেদন এবং অতিরিক্ত সংকেত যেমন বৃদ্ধির কারণ এবং প্রতিক্রিয়াশীল অক্সিজেন প্রজাতি প্রোটিন কাইনেস mTOR এবং AMPK এর কার্যকলাপ নিয়ন্ত্রণ করে। এই দুটি কাইনেস Unc-51-এর মতো কাইনেস ULK1 এবং ULK2 (Atg1-এর স্তন্যপায়ী হোমোলগ) এর ইনহিবিটরি ফসফোরিলেশনের মাধ্যমে অটোফ্যাজি নিয়ন্ত্রণ করে। অটোফ্যাজি আনয়নের ফলে ডিফসফোরিলেশন এবং ইউএলকে কাইনেস সক্রিয় হয়। ULK হল একটি প্রোটিন কমপ্লেক্সের অংশ যাতে Atg13, Atg101 এবং FIP200 রয়েছে। ULK ফসফরিলেট করে এবং সক্রিয় করে বেক্লিন-1 (Atg6 এর স্তন্যপায়ী হোমোলগ),যা একটি প্রোটিন কমপ্লেক্সেরও অংশ। অটোফ্যাজি-ইনডিউসিবল বেক্লিন-1 কমপ্লেক্স প্রোটিন PIK3R4(p150), Atg14L এবং ক্লাস III ফসফ্যাটিডিলিনোসিটল 3-ফসফেট কিনেস (PI(3)K) Vps34 ধারণ করে। সক্রিয় ULK এবং Beclin-1 কমপ্লেক্সগুলি অটোফ্যাগোসোম সূচনা, ফাগোফোরের সাইটে পুনরায় স্থানীয়করণ করে, যেখানে তারা উভয়ই ডাউনস্ট্রিম অটোফ্যাজি উপাদানগুলির সক্রিয়করণে অবদান রাখে। |
|||
=== মেরামত প্রক্রিয়া === |
|||
| ⚫ | একবার সক্রিয় |
||
অটোফ্যাজি ক্ষতিগ্রস্থ অর্গানেল, কোষের ঝিল্লি এবং প্রোটিনকে ক্ষয় করে এবং অপর্যাপ্ত অটোফ্যাজি ক্ষতিগ্রস্থ কোষ জমে এবং [[জরাগ্রস্ততা|বার্ধক্যের]] অন্যতম প্রধান কারণ বলে মনে করা হয়। <ref name="Cuervo2005">{{সাময়িকী উদ্ধৃতি|vauthors=Cuervo AM, Bergamini E, Brunk UT, Dröge W, Ffrench M, Terman A|বছর=2005|শিরোনাম=Autophagy and aging: the importance of maintaining "clean" cells|পাতাসমূহ=131–40|doi=10.4161/auto.1.3.2017|pmid=16874025|doi-access=free}}</ref> অটোফ্যাজি এবং অটোফ্যাজি নিয়ন্ত্রক লাইসোসোমাল ক্ষতির প্রতিক্রিয়ার সাথে জড়িত, যা প্রায়শই গ্যালেক্টিন যেমন গ্যালেক্টিন-3 এবং গ্যালেক্টিন-8 দ্বারা পরিচালিত হয়। |
|||
=== প্রোগ্রাম করা কোষের মৃত্যু === |
|||
অটোফ্যাজিতে জড়িত দুটি ইউবিকুইটিন-সদৃশ সংযোগ ব্যবস্থার মধ্যে প্রথমটি ইউবিকুইটিন-সদৃশ প্রোটিন Atg12 কে Atg5 এর সাথে সংযুক্ত করে। ফলে কনজুগেট প্রোটিন তখন Atg16L1 কে আবদ্ধ করে একটি E3-এর মতো কমপ্লেক্স গঠন করে যা দ্বিতীয় ইউবিকুইটিন-এর মতো কনজুগেশান সিস্টেমের অংশ হিসেবে কাজ করে। এই জটিলটি Atg3 কে আবদ্ধ করে এবং সক্রিয় করে, যা লিপিডের সাথে LC3 প্রোটিন হিসেবে সবচেয়ে বেশি অধ্যয়ন করা হয়, যা ইউবিকুইটিন-সদৃশ ইস্ট প্রোটিন ATG8 (LC3A-C, GATE16, এবং GABARAPL1-3) এর স্তন্যপায়ী হোমোলগগুলিকে সংযুক্ত করে। |
|||
প্রোগ্রামড সেল ডেথ (পিসিডি) এর একটি প্রক্রিয়া অটোফাগোসোমের উপস্থিতির সাথে যুক্ত এবং অটোফ্যাজি প্রোটিনের উপর নির্ভর করে। কোষের মৃত্যুর এই রূপটি সম্ভবত এমন একটি প্রক্রিয়ার সাথে মিলে যায় যা অটোফ্যাজিক পিসিডি হিসাবে morphologically সংজ্ঞায়িত করা হয়েছে। একটি প্রশ্ন যা ক্রমাগত উত্থাপিত হয়, তবে, মৃত কোষে অটোফাজিক কার্যকলাপ মৃত্যুর কারণ নাকি আসলে এটি প্রতিরোধ করার একটি প্রচেষ্টা। রূপগত এবং হিস্টোকেমিক্যাল অধ্যয়নগুলি এখনও পর্যন্ত অটোফ্যাজিক প্রক্রিয়া এবং কোষের মৃত্যুর মধ্যে একটি কার্যকারক সম্পর্ক প্রমাণ করেনি। প্রকৃতপক্ষে, সম্প্রতি শক্তিশালী যুক্তি রয়েছে যে মৃত কোষে অটোফ্যাজিক কার্যকলাপ আসলে একটি বেঁচে থাকার প্রক্রিয়া হতে পারে। <ref name="tavassoly">{{বই উদ্ধৃতি|শিরোনাম=Dynamics of Cell Fate Decision Mediated by the Interplay of Autophagy and Apoptosis in Cancer Cells|vauthors=Tavassoly I|তারিখ=2015|ধারাবাহিক=Springer Theses|প্রকাশক=Springer International Publishing|doi=10.1007/978-3-319-14962-2|আইএসবিএন=978-3-319-14962-2}}</ref> <ref name="Shimizu2005">{{সাময়িকী উদ্ধৃতি|vauthors=Tsujimoto Y, Shimizu S|তারিখ=November 2005|শিরোনাম=Another way to die: autophagic programmed cell death|পাতাসমূহ=1528–34|doi=10.1038/sj.cdd.4401777|pmid=16247500|doi-access=free}}</ref> পোকামাকড়ের মেটামরফোসিসের গবেষণায় দেখা গেছে যে কোষগুলি PCD-এর একটি ফর্মের মধ্য দিয়ে যাচ্ছে যা অন্যান্য ফর্ম থেকে আলাদা বলে মনে হয়; এগুলি অটোফ্যাজিক কোষের মৃত্যুর উদাহরণ হিসাবে প্রস্তাবিত হয়েছে। <ref name="Osborne1993">{{সাময়িকী উদ্ধৃতি|vauthors=Schwartz LM, Smith SW, Jones ME, Osborne BA|তারিখ=February 1993|শিরোনাম=Do all programmed cell deaths occur via apoptosis?|পাতাসমূহ=980–4|doi=10.1073/pnas.90.3.980|pmc=45794|pmid=8430112|doi-access=free}}</ref> সাম্প্রতিক ফার্মাকোলজিকাল এবং জৈব রাসায়নিক গবেষণায় প্রস্তাব করা হয়েছে যে বেঁচে থাকা এবং প্রাণঘাতী অটোফ্যাজিকে বিশেষ করে ভাইরাল সংক্রমণের পরে চাপের সময় নিয়ন্ত্রক সংকেতের ধরন এবং মাত্রা দ্বারা আলাদা করা যেতে পারে। <ref name="Datan">{{সাময়িকী উদ্ধৃতি|vauthors=Datan E, Shirazian A, Benjamin S, Matassov D, Tinari A, Malorni W, Lockshin RA, Garcia-Sastre A, Zakeri Z|তারিখ=March 2014|শিরোনাম=mTOR/p70S6K signaling distinguishes routine, maintenance-level autophagy from autophagic cell death during influenza A infection|পাতাসমূহ=175–190|doi=10.1016/j.virol.2014.01.008|pmc=4005847|pmid=24606695}}</ref> যদিও প্রতিশ্রুতিশীল, এই ফলাফলগুলি অ-ভাইরাল সিস্টেমে পরীক্ষা করা হয়নি। |
|||
== ব্যায়াম == |
|||
phosphatidylethanolamine (PE) autophagosomes পৃষ্ঠের উপর Lipidated LC3 অটোফাগোসোম বন্ধ করতে অবদান রাখে এবং নির্দিষ্ট কার্গোস এবং অ্যাডাপ্টার প্রোটিন যেমন Sequestosome-1/p62 এর ডকিং সক্ষম করে। সম্পূর্ণ অটোফ্যাগোসোম তারপর SNAREs এবং UVRAG সহ একাধিক প্রোটিনের ক্রিয়াকলাপের মাধ্যমে একটি লাইসোসোমের সাথে ফিউজ হয়ে যায়। ফিউশন অনুসরণ করে LC3 ভেসিকলের ভিতরের দিকে ধরে রাখা হয় এবং কার্গো সহ ক্ষয়প্রাপ্ত হয়, যখন বাইরের দিকে সংযুক্ত LC3 অণুগুলি Atg4 দ্বারা বিচ্ছিন্ন হয় এবং পুনর্ব্যবহৃত হয়। অটোলাইসোসোমের বিষয়বস্তু পরবর্তীকালে ক্ষয়প্রাপ্ত হয় এবং তাদের বিল্ডিং ব্লকগুলি ভেসিকল থেকে পারমিজের ক্রিয়াকলাপের মাধ্যমে মুক্তি পায়।Sirtuin 1 (SIRT1) অটোফ্যাজির জন্য প্রয়োজনীয় প্রোটিনের অ্যাসিটাইলেশন প্রতিরোধ করে অটোফ্যাজিকে উদ্দীপিত করে (ডিসিটাইলেশনের মাধ্যমে) যেমনটি সভ্য কোষ এবং ভ্রূণ এবং নবজাতক টিস্যুতে প্রদর্শিত হয়। এই ফাংশন sirtuin অভিব্যক্তি এবং ক্যালোরি সীমাবদ্ধতার কারণে সীমিত পুষ্টির সেলুলার প্রতিক্রিয়া মধ্যে একটি লিঙ্ক প্রদান করে। |
|||
বেসাল [[হোমিওস্ট্যাটিস|হোমিওস্টেসিসের]] জন্য অটোফ্যাজি অপরিহার্য; শারীরিক ব্যায়ামের সময় [[ঐচ্ছিক পেশী|পেশী]] হোমিওস্ট্যাসিস বজায় রাখার জন্য এটি অত্যন্ত গুরুত্বপূর্ণ। <ref name="pimd111111">{{সাময়িকী উদ্ধৃতি|vauthors=Sanchez AM, Bernardi H, Py G, Candau RB|তারিখ=October 2014|শিরোনাম=Autophagy is essential to support skeletal muscle plasticity in response to endurance exercise|ইউআরএল=https://hal.archives-ouvertes.fr/hal-01837580|পাতাসমূহ=R956-69|doi=10.1152/ajpregu.00187.2014|pmid=25121614}}</ref> <ref name="Klionsky2011">{{সাময়িকী উদ্ধৃতি|vauthors=Nair U, Klionsky DJ|তারিখ=December 2011|শিরোনাম=Activation of autophagy is required for muscle homeostasis during physical exercise|পাতাসমূহ=1405–6|doi=10.4161/auto.7.12.18315|pmc=3288013|pmid=22082869}}</ref> আণবিক স্তরে অটোফ্যাজি শুধুমাত্র আংশিকভাবে বোঝা যায়। ইঁদুরের একটি সমীক্ষা দেখায় যে অটোফ্যাজি তাদের পুষ্টি এবং শক্তির চাহিদার নিরন্তর পরিবর্তনশীল চাহিদার জন্য গুরুত্বপূর্ণ, বিশেষ করে প্রোটিন ক্যাটাবলিজমের বিপাকীয় পথের মাধ্যমে। [[ডালাস|ডালাসের]] ইউনিভার্সিটি অফ টেক্সাস সাউথ ওয়েস্টার্ন মেডিক্যাল সেন্টার দ্বারা পরিচালিত 2012 সালের একটি গবেষণায়, মিউট্যান্ট ইঁদুর ( BCL2 ফসফোরিলেশন সাইটগুলির একটি নক-ইন মিউটেশন সহ বংশধর তৈরি করতে যা বেসাল অটোফ্যাজির স্বাভাবিক মাত্রা দেখায় তবে চাপ-প্ররোচিত অটোফ্যাজিতে ঘাটতি ছিল) পরীক্ষা করা হয়েছিল। এই তত্ত্বকে চ্যালেঞ্জ করতে। ফলাফলগুলি দেখায় যে একটি নিয়ন্ত্রণ গোষ্ঠীর সাথে তুলনা করলে, এই ইঁদুরগুলি তীব্র ব্যায়ামের সময় সহনশীলতা হ্রাস এবং একটি পরিবর্তিত [[গ্লুকোজ]] বিপাক চিত্রিত করে। <ref name="He2012">{{সাময়িকী উদ্ধৃতি|vauthors=He C, Bassik MC, Moresi V, Sun K, Wei Y, Zou Z, An Z, Loh J, Fisher J, Sun Q, Korsmeyer S, Packer M, May HI, Hill JA, Virgin HW, Gilpin C, Xiao G, Bassel-Duby R, Scherer PE, Levine B|তারিখ=January 2012|শিরোনাম=Exercise-induced BCL2-regulated autophagy is required for muscle glucose homeostasis|পাতাসমূহ=511–5|doi=10.1038/nature10758|pmc=3518436|pmid=22258505}}</ref> |
|||
অন্য একটি গবেষণায় দেখা গেছে যে কোলাজেন VI নকআউট ইঁদুরের [[ঐচ্ছিক পেশী|কঙ্কালের পেশী]] ফাইবারগুলি অটোফ্যাজির অপ্রতুলতার কারণে অবক্ষয়ের লক্ষণ দেখায় যা ক্ষতিগ্রস্থ মাইটোকন্ড্রিয়া এবং অতিরিক্ত [[কোষপতন|কোষের মৃত্যুর]] কারণ হয়ে দাঁড়ায়। <ref name="Grumati11">{{সাময়িকী উদ্ধৃতি|vauthors=Grumati P, Coletto L, Schiavinato A, Castagnaro S, Bertaggia E, Sandri M, Bonaldo P|তারিখ=December 2011|শিরোনাম=Physical exercise stimulates autophagy in normal skeletal muscles but is detrimental for collagen VI-deficient muscles|পাতাসমূহ=1415–23|doi=10.4161/auto.7.12.17877|pmc=3288016|pmid=22024752}}</ref> ব্যায়াম-প্ররোচিত অটোফ্যাজি যদিও ব্যর্থ হয়েছিল; কিন্তু যখন ব্যায়াম-পরবর্তী অটোফ্যাজি কৃত্রিমভাবে প্ররোচিত হয়, তখন কোলাজেন VI- এর ঘাটতিযুক্ত পেশী ফাইবারগুলিতে ক্ষতিগ্রস্ত অর্গানেলগুলি জমা হওয়া প্রতিরোধ করা হয়েছিল এবং সেলুলার হোমিওস্ট্যাসিস বজায় রাখা হয়েছিল। উভয় গবেষণাই দেখায় যে অটোফ্যাজি ইনডাকশন ব্যায়ামের উপকারী বিপাকীয় প্রভাবে অবদান রাখতে পারে এবং ব্যায়ামের সময় পেশী হোমিওস্ট্যাসিস বজায় রাখতে এটি অপরিহার্য, বিশেষ করে কোলাজেন VI ফাইবারগুলিতে। <ref name="He2012">{{সাময়িকী উদ্ধৃতি|vauthors=He C, Bassik MC, Moresi V, Sun K, Wei Y, Zou Z, An Z, Loh J, Fisher J, Sun Q, Korsmeyer S, Packer M, May HI, Hill JA, Virgin HW, Gilpin C, Xiao G, Bassel-Duby R, Scherer PE, Levine B|তারিখ=January 2012|শিরোনাম=Exercise-induced BCL2-regulated autophagy is required for muscle glucose homeostasis|পাতাসমূহ=511–5|doi=10.1038/nature10758|pmc=3518436|pmid=22258505}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFHeBassikMoresiSun2012">He C, Bassik MC, Moresi V, Sun K, Wei Y, Zou Z, et al. (January 2012). [//www.ncbi.nlm.nih.gov/pmc/articles/PMC3518436 "Exercise-induced BCL2-regulated autophagy is required for muscle glucose homeostasis"]. ''Nature''. '''481''' (7382): 511–5. [[বিবকোড|Bibcode]]:[https://ui.adsabs.harvard.edu/abs/2012Natur.481..511H 2012Natur.481..511H]. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:[[doi:10.1038/nature10758|10.1038/nature10758]]. [[পাবমেড সেন্ট্রাল|PMC]] <span class="cs1-lock-free" title="Freely accessible">[//www.ncbi.nlm.nih.gov/pmc/articles/PMC3518436 3518436]</span>. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/22258505 22258505].</cite></ref> <ref name="Klionsky2011">{{সাময়িকী উদ্ধৃতি|vauthors=Nair U, Klionsky DJ|তারিখ=December 2011|শিরোনাম=Activation of autophagy is required for muscle homeostasis during physical exercise|পাতাসমূহ=1405–6|doi=10.4161/auto.7.12.18315|pmc=3288013|pmid=22082869}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFNairKlionsky2011">Nair U, Klionsky DJ (December 2011). [//www.ncbi.nlm.nih.gov/pmc/articles/PMC3288013 "Activation of autophagy is required for muscle homeostasis during physical exercise"]. ''Autophagy''. '''7''' (12): 1405–6. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:[[doi:10.4161/auto.7.12.18315|10.4161/auto.7.12.18315]]. [[পাবমেড সেন্ট্রাল|PMC]] <span class="cs1-lock-free" title="Freely accessible">[//www.ncbi.nlm.nih.gov/pmc/articles/PMC3288013 3288013]</span>. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/22082869 22082869].</cite></ref> <ref name="Grumati11" /> |
|||
ইনস্টিটিউট ফর সেল বায়োলজি, বন ইউনিভার্সিটির কাজ দেখিয়েছে যে একটি নির্দিষ্ট ধরণের অটোফ্যাজি, অর্থাৎ চ্যাপেরোন-অ্যাসিস্টেড সিলেক্টিভ অটোফ্যাজি (CASA), পেশী সংকোচনের জন্য প্ররোচিত হয় এবং যান্ত্রিক উত্তেজনার মধ্যে পেশী সারকোমের বজায় রাখার জন্য প্রয়োজনীয়। <ref name="pmid20060297">{{সাময়িকী উদ্ধৃতি|vauthors=Arndt V, Dick N, Tawo R, Dreiseidler M, Wenzel D, Hesse M, Fürst DO, Saftig P, Saint R, Fleischmann BK, Hoch M, Höhfeld J|তারিখ=January 2010|শিরোনাম=Chaperone-assisted selective autophagy is essential for muscle maintenance|পাতাসমূহ=143–8|doi=10.1016/j.cub.2009.11.022|pmid=20060297|doi-access=free}}</ref> CASA চ্যাপেরোন কমপ্লেক্স যান্ত্রিকভাবে ক্ষতিগ্রস্থ সাইটোস্কেলটন উপাদানগুলিকে স্বীকৃতি দেয় এবং নিষ্পত্তির জন্য লাইসোসোমগুলিতে একটি ubiquitin- নির্ভর অটোফ্যাজিক বাছাই পথের মাধ্যমে এই উপাদানগুলিকে নির্দেশ করে। পেশী কার্যকলাপ বজায় রাখার জন্য এটি প্রয়োজনীয়। <ref name="pmid20060297" /> <ref name="pmid23434281">{{সাময়িকী উদ্ধৃতি|vauthors=Ulbricht A, Eppler FJ, Tapia VE, van der Ven PF, Hampe N, Hersch N, Vakeel P, Stadel D, Haas A, Saftig P, Behrends C, Fürst DO, Volkmer R, Hoffmann B, Kolanus W, Höhfeld J|তারিখ=March 2013|শিরোনাম=Cellular mechanotransduction relies on tension-induced and chaperone-assisted autophagy|পাতাসমূহ=430–5|doi=10.1016/j.cub.2013.01.064|pmid=23434281|doi-access=free}}</ref> |
|||
'''''ক্রিয়াকাণ্ড :----------------------------------------------------------------------------------------------''''' |
|||
== অস্টিওআর্থারাইটিস == |
|||
যেহেতু বয়সের সাথে সাথে অটোফ্যাজি কমে যায় এবং বয়স অস্টিওআর্থারাইটিসের জন্য একটি প্রধান ঝুঁকির কারণ, এই রোগের বিকাশে অটোফ্যাজির ভূমিকার পরামর্শ দেওয়া হয়। অটোফ্যাজিতে জড়িত প্রোটিনগুলি বয়সের সাথে সাথে মানুষের এবং মাউসের আর্টিকুলার কার্টিলেজে হ্রাস পায়। <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Caramés B, Taniguchi N, Otsuki S, Blanco FJ, Lotz M|তারিখ=March 2010|শিরোনাম=Autophagy is a protective mechanism in normal cartilage, and its aging-related loss is linked with cell death and osteoarthritis|পাতাসমূহ=791–801|doi=10.1002/art.27305|pmc=2838960|pmid=20187128}}</ref> সংস্কৃতিতে কারটিলেজ এক্সপ্ল্যান্টের যান্ত্রিক আঘাতও অটোফ্যাজি প্রোটিন হ্রাস করে। <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Caramés B, Taniguchi N, Seino D, Blanco FJ, D'Lima D, Lotz M|তারিখ=April 2012|শিরোনাম=Mechanical injury suppresses autophagy regulators and pharmacologic activation of autophagy results in chondroprotection|পাতাসমূহ=1182–92|doi=10.1002/art.33444|pmc=3288456|pmid=22034068}}</ref> অটোফ্যাজি ক্রমাগত স্বাভাবিক তরুণাস্থিতে সক্রিয় হয় কিন্তু বয়সের সাথে আপোস করা হয় এবং কারটিলেজ কোষের মৃত্যু এবং কাঠামোগত ক্ষতির আগে। <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Caramés B, Olmer M, Kiosses WB, Lotz MK|তারিখ=June 2015|শিরোনাম=The relationship of autophagy defects to cartilage damage during joint aging in a mouse model|পাতাসমূহ=1568–76|doi=10.1002/art.39073|pmc=4446178|pmid=25708836}}</ref> এইভাবে অটোফ্যাজি জয়েন্টে একটি স্বাভাবিক প্রতিরক্ষামূলক প্রক্রিয়া ( কন্ড্রোপ্রোটেকশন ) এর সাথে জড়িত। |
|||
== ক্যান্সার == |
|||
'''''পুষ্টির অনাহার:''''' |
|||
ক্যান্সার প্রায়ই ঘটে যখন কোষের পার্থক্য নিয়ন্ত্রিত বিভিন্ন পথ ব্যাহত হয়। অটোফ্যাজি ক্যান্সারে একটি গুরুত্বপূর্ণ ভূমিকা পালন করে - উভয়ই ক্যান্সারের বিরুদ্ধে সুরক্ষার পাশাপাশি ক্যান্সারের বৃদ্ধিতে সম্ভাব্য অবদান রাখে। <ref name="tavassoly">{{বই উদ্ধৃতি|শিরোনাম=Dynamics of Cell Fate Decision Mediated by the Interplay of Autophagy and Apoptosis in Cancer Cells|vauthors=Tavassoly I|তারিখ=2015|ধারাবাহিক=Springer Theses|প্রকাশক=Springer International Publishing|doi=10.1007/978-3-319-14962-2|আইএসবিএন=978-3-319-14962-2}}<cite class="citation book cs1" data-ve-ignore="true" id="CITEREFTavassoly2015">Tavassoly I (2015). ''Dynamics of Cell Fate Decision Mediated by the Interplay of Autophagy and Apoptosis in Cancer Cells''. Springer Theses. Springer International Publishing. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:[[doi:10.1007/978-3-319-14962-2|10.1007/978-3-319-14962-2]]. [[আন্তর্জাতিক মান পুস্তক সংখ্যা|ISBN]] [[বিশেষ:পুস্তক সূত্র/978-3-319-14962-2|<bdi>978-3-319-14962-2</bdi>]]. [[S2CID (শনাক্তকারী)|S2CID]] [https://api.semanticscholar.org/CorpusID:89307028 89307028].</cite></ref> <ref name="Furuya">Furuya, N., Liang, X.H., and Levin, B. 2004. Autophagy and cancer. In Autophagy. D.J. Klionsky editor. Landes Bioscience. Georgetown, Texas, USA. 244-253.</ref> অটোফ্যাজি ক্ষুধার্ত টিউমার কোষগুলির বেঁচে থাকার প্রচারের মাধ্যমে ক্যান্সারে অবদান রাখতে পারে, বা অটোফ্যাজির মাধ্যমে অ্যাপোপটোটিক মধ্যস্থতাকারীদের অবনমিত করে: এই ধরনের ক্ষেত্রে, অটোফ্যাজির শেষ পর্যায়ের ইনহিবিটর (যেমন ক্লোরোকুইন ) ব্যবহার করে যে কোষগুলি অটোফ্যাজি ব্যবহার করে। বেঁচে থাকা, অ্যান্টিনোপ্লাস্টিক ওষুধের দ্বারা নিহত ক্যান্সার কোষের সংখ্যা বৃদ্ধি করে। <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Vlahopoulos S, Critselis E, Voutsas IF, Perez SA, Moschovi M, Baxevanis CN, Chrousos GP|তারিখ=2014|শিরোনাম=New use for old drugs? Prospective targets of chloroquines in cancer therapy|পাতাসমূহ=843–51|doi=10.2174/1389450115666140714121514|pmid=25023646}}</ref> |
|||
ক্যান্সারে অটোফ্যাজির ভূমিকা এমন একটি যা অত্যন্ত গবেষণা এবং পর্যালোচনা করা হয়েছে। এমন প্রমাণ রয়েছে যা টিউমার দমনকারী এবং টিউমার কোষের বেঁচে থাকার একটি কারণ হিসাবে অটোফ্যাজির ভূমিকাকে জোর দেয়। সাম্প্রতিক গবেষণায় দেখা গেছে যে, অটোফ্যাজিটি বেশ কয়েকটি মডেল অনুসারে টিউমার দমনকারী হিসাবে ব্যবহার করার সম্ভাবনা বেশি। <ref name="Furuya">Furuya, N., Liang, X.H., and Levin, B. 2004. Autophagy and cancer. In Autophagy. D.J. Klionsky editor. Landes Bioscience. Georgetown, Texas, USA. 244-253.</ref> |
|||
| ⚫ | |||
=== টিউমার দমনকারী === |
|||
ইঁদুর এবং বিভিন্ন রকমের বেক্লিন 1 নিয়ে বেশ কিছু পরীক্ষা করা হয়েছে, একটি প্রোটিন যা অটোফ্যাজি নিয়ন্ত্রণ করে। যখন বেক্লিন 1 জিনকে হেটেরোজাইগাস (বেক্লিন 1+/-) হিসাবে পরিবর্তিত করা হয়েছিল, তখন ইঁদুরগুলি টিউমার-প্রবণ বলে প্রমাণিত হয়েছিল। <ref name="Qu">{{সাময়িকী উদ্ধৃতি|vauthors=Qu X, Yu J, Bhagat G, Furuya N, Hibshoosh H, Troxel A, Rosen J, Eskelinen EL, Mizushima N, Ohsumi Y, Cattoretti G, Levine B|তারিখ=December 2003|শিরোনাম=Promotion of tumorigenesis by heterozygous disruption of the beclin 1 autophagy gene|পাতাসমূহ=1809–20|doi=10.1172/JCI20039|pmc=297002|pmid=14638851}}</ref> যাইহোক, যখন বেক্লিন 1 অত্যধিক এক্সপ্রেসড ছিল, তখন টিউমারের বিকাশ বাধাগ্রস্ত হয়েছিল। <ref name="levine 1999">{{সাময়িকী উদ্ধৃতি|vauthors=Liang XH, Jackson S, Seaman M, Brown K, Kempkes B, Hibshoosh H, Levine B|তারিখ=December 1999|শিরোনাম=Induction of autophagy and inhibition of tumorigenesis by beclin 1|পাতাসমূহ=672–6|doi=10.1038/45257|pmid=10604474}}</ref> বেক্লিন মিউট্যান্টের ফেনোটাইপগুলি ব্যাখ্যা করার সময় এবং অটোফ্যাজির ত্রুটির জন্য পর্যবেক্ষণগুলিকে দায়ী করার সময় যত্ন নেওয়া উচিত, তবে: বেক্লিন 1 সাধারণত ফসফ্যাটিডাইলিনোসিটল 3- ফসফেট উত্পাদনের জন্য প্রয়োজন এবং যেমন এটি অসংখ্য লাইসোসোমাল এবং এন্ডোসোমাল ফাংশনগুলিকে প্রভাবিত করে, যার মধ্যে এন্ডোকাইটোসিটেশন অফ এন্ডোকাইটোসিটেশন সহ। বৃদ্ধি ফ্যাক্টর রিসেপ্টর। অটোফ্যাজি-স্বাধীন পথের মাধ্যমে বেকলিন1 ক্যান্সারের বিকাশকে প্রভাবিত করে এমন সম্ভাবনার সমর্থনে এই সত্য যে মূল অটোফ্যাজি কারণগুলি যা অন্যান্য সেলুলার প্রক্রিয়াগুলিকে প্রভাবিত করে এবং নিশ্চিতভাবে কোষের বিস্তার এবং কোষের মৃত্যুকে প্রভাবিত করে না, যেমন Atg7 বা Atg5।, একটি ভিন্ন ফিনোটাইপ দেখান যখন সংশ্লিষ্ট জিনটি ছিটকে যায়, যা টিউমার গঠন অন্তর্ভুক্ত করে না। উপরন্তু, Beclin1-এর সম্পূর্ণ নকআউট ভ্রূণজনিত প্রাণঘাতী যেখানে Atg7 বা Atg5-এর নকআউট নয়। |
|||
নেক্রোসিস এবং দীর্ঘস্থায়ী প্রদাহও অটোফ্যাজির মাধ্যমে সীমিত দেখানো হয়েছে যা টিউমার কোষ গঠনের বিরুদ্ধে রক্ষা করতে সাহায্য করে। <ref name="Duran">{{সাময়িকী উদ্ধৃতি|vauthors=Duran A, Linares JF, Galvez AS, Wikenheiser K, Flores JM, Diaz-Meco MT, Moscat J|তারিখ=April 2008|শিরোনাম=The signaling adaptor p62 is an important NF-kappaB mediator in tumorigenesis|পাতাসমূহ=343–54|doi=10.1016/j.ccr.2008.02.001|pmid=18394557|doi-access=free}}</ref> |
|||
| ⚫ | |||
=== টিউমার কোষ বেঁচে থাকা === |
|||
| ⚫ | পারকিনসন্স ডিজিজ হল একটি নিউরোডিজেনারেটিভ ডিসঅর্ডার যা আংশিকভাবে |
||
বিকল্পভাবে, টিউমার কোষের বেঁচে থাকার ক্ষেত্রে অটোফ্যাজি একটি বড় ভূমিকা পালন করতে দেখা গেছে। ক্যান্সারযুক্ত কোষগুলিতে, অটোফ্যাজি কোষের উপর চাপ মোকাবেলা করার উপায় হিসাবে ব্যবহৃত হয়। <ref name="Paglin">{{সাময়িকী উদ্ধৃতি|vauthors=Paglin S, Hollister T, Delohery T, Hackett N, McMahill M, Sphicas E, Domingo D, Yahalom J|তারিখ=January 2001|শিরোনাম=A novel response of cancer cells to radiation involves autophagy and formation of acidic vesicles|পাতাসমূহ=439–44|pmid=11212227}}</ref> উদাহরণস্বরূপ, miRNA-4673 দ্বারা অটোফ্যাজি অন্তর্ভুক্ত করা একটি প্রো-সারভাইভাল মেকানিজম যা বিকিরণের বিরুদ্ধে ক্যান্সার কোষের প্রতিরোধ ক্ষমতা উন্নত করে। <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Dökümcü K, Simonian M, Farahani RM|তারিখ=October 2018|শিরোনাম=miR4673 improves fitness profile of neoplastic cells by induction of autophagy|পাতাসমূহ=1068|doi=10.1038/s41419-018-1088-6|pmc=6195512|pmid=30341280}}</ref> একবার এই অটোফ্যাজি সম্পর্কিত জিনগুলিকে বাধা দেওয়া হলে, কোষের মৃত্যুর সম্ভাবনা ছিল। <ref name="Jin">{{সাময়িকী উদ্ধৃতি|vauthors=Jin S, White E|বছর=2007|শিরোনাম=Role of autophagy in cancer: management of metabolic stress|পাতাসমূহ=28–31|doi=10.4161/auto.3269|pmc=2770734|pmid=16969128}}</ref> বিপাকীয় শক্তি বৃদ্ধি অটোফ্যাজি ফাংশন দ্বারা অফসেট হয়. এই বিপাকীয় চাপের মধ্যে রয়েছে হাইপোক্সিয়া, পুষ্টির বঞ্চনা এবং বিস্তার বৃদ্ধি। এই স্ট্রেসগুলি ATP রিসাইকেল করতে এবং ক্যান্সারের কোষগুলির বেঁচে থাকার জন্য অটোফ্যাজি সক্রিয় করে। <ref name="Yang">{{সাময়িকী উদ্ধৃতি|vauthors=Yang ZJ, Chee CE, Huang S, Sinicrope FA|তারিখ=September 2011|শিরোনাম=The role of autophagy in cancer: therapeutic implications|পাতাসমূহ=1533–41|doi=10.1158/1535-7163.MCT-11-0047|pmc=3170456|pmid=21878654}}</ref> অটোফ্যাজি সেলুলার শক্তি উৎপাদন বজায় রেখে টিউমার কোষের ক্রমাগত বৃদ্ধিকে সক্ষম করে দেখানো হয়েছে। এই টিউমার কোষগুলিতে অটোফ্যাজি জিনগুলিকে বাধা দেওয়ার মাধ্যমে, টিউমারের রিগ্রেশন এবং টিউমার দ্বারা প্রভাবিত অঙ্গগুলির বর্ধিত বেঁচে থাকা পাওয়া গেছে। তদ্ব্যতীত, অটোফ্যাজির বাধাও ক্যান্সার প্রতিরোধী থেরাপির কার্যকারিতা বাড়াতে দেখানো হয়েছে। <ref name="Yang" /> |
|||
=== কোষের মৃত্যুর প্রক্রিয়া === |
|||
যে কোষগুলি অত্যধিক চাপের মধ্য দিয়ে যায় সেগুলি [[কোষপতন|অ্যাপোপটোসিস]] বা নেক্রোসিসের মাধ্যমে কোষের মৃত্যু অনুভব করে। দীর্ঘায়িত অটোফ্যাজি অ্যাক্টিভেশন প্রোটিন এবং অর্গানেলের উচ্চ টার্নওভার হারের দিকে পরিচালিত করে। বেঁচে থাকার থ্রেশহোল্ডের উপরে একটি উচ্চ হার একটি উচ্চ অ্যাপোপটোটিক থ্রেশহোল্ড সহ ক্যান্সার কোষকে মেরে ফেলতে পারে। <ref name="Yang">{{সাময়িকী উদ্ধৃতি|vauthors=Yang ZJ, Chee CE, Huang S, Sinicrope FA|তারিখ=September 2011|শিরোনাম=The role of autophagy in cancer: therapeutic implications|পাতাসমূহ=1533–41|doi=10.1158/1535-7163.MCT-11-0047|pmc=3170456|pmid=21878654}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFYangCheeHuangSinicrope2011">Yang ZJ, Chee CE, Huang S, Sinicrope FA (September 2011). [//www.ncbi.nlm.nih.gov/pmc/articles/PMC3170456 "The role of autophagy in cancer: therapeutic implications"]. ''Molecular Cancer Therapeutics''. '''10''' (9): 1533–41. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:[[doi:10.1158/1535-7163.MCT-11-0047|10.1158/1535-7163.MCT-11-0047]]. [[পাবমেড সেন্ট্রাল|PMC]] <span class="cs1-lock-free" title="Freely accessible">[//www.ncbi.nlm.nih.gov/pmc/articles/PMC3170456 3170456]</span>. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/21878654 21878654].</cite></ref> <ref name=":0">{{সাময়িকী উদ্ধৃতি|vauthors=Tavassoly I, Parmar J, Shajahan-Haq AN, Clarke R, Baumann WT, Tyson JJ|তারিখ=April 2015|শিরোনাম=Dynamic Modeling of the Interaction Between Autophagy and Apoptosis in Mammalian Cells|পাতাসমূহ=263–72|doi=10.1002/psp4.29|pmc=4429580|pmid=26225250}}</ref> এই কৌশলটি একটি থেরাপিউটিক ক্যান্সার চিকিত্সা হিসাবে ব্যবহার করা যেতে পারে। <ref name="tavassoly">{{বই উদ্ধৃতি|শিরোনাম=Dynamics of Cell Fate Decision Mediated by the Interplay of Autophagy and Apoptosis in Cancer Cells|vauthors=Tavassoly I|তারিখ=2015|ধারাবাহিক=Springer Theses|প্রকাশক=Springer International Publishing|doi=10.1007/978-3-319-14962-2|আইএসবিএন=978-3-319-14962-2}}<cite class="citation book cs1" data-ve-ignore="true" id="CITEREFTavassoly2015">Tavassoly I (2015). ''Dynamics of Cell Fate Decision Mediated by the Interplay of Autophagy and Apoptosis in Cancer Cells''. Springer Theses. Springer International Publishing. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:[[doi:10.1007/978-3-319-14962-2|10.1007/978-3-319-14962-2]]. [[আন্তর্জাতিক মান পুস্তক সংখ্যা|ISBN]] [[বিশেষ:পুস্তক সূত্র/978-3-319-14962-2|<bdi>978-3-319-14962-2</bdi>]]. [[S2CID (শনাক্তকারী)|S2CID]] [https://api.semanticscholar.org/CorpusID:89307028 89307028].</cite></ref> |
|||
গবেষণায় নতুন উন্নয়ন পাওয়া গেছে যে লক্ষ্যযুক্ত অটোফ্যাজি ক্যান্সারের বিরুদ্ধে লড়াই করার জন্য একটি কার্যকর থেরাপিউটিক সমাধান হতে পারে। উপরে আলোচনা করা হয়েছে, অটোফ্যাজি টিউমার দমন এবং টিউমার কোষের বেঁচে থাকার উভয় ভূমিকা পালন করে। সুতরাং, অটোফ্যাজির গুণাবলী ক্যান্সার প্রতিরোধের কৌশল হিসাবে ব্যবহার করা যেতে পারে। প্রথম কৌশলটি হল অটোফ্যাজি প্ররোচিত করা এবং এর টিউমার দমন বৈশিষ্ট্যগুলিকে উন্নত করা। দ্বিতীয় কৌশলটি হল অটোফ্যাজিকে বাধা দেওয়া এবং এইভাবে অ্যাপোপটোসিসকে প্ররোচিত করা। <ref name="Jin">{{সাময়িকী উদ্ধৃতি|vauthors=Jin S, White E|বছর=2007|শিরোনাম=Role of autophagy in cancer: management of metabolic stress|পাতাসমূহ=28–31|doi=10.4161/auto.3269|pmc=2770734|pmid=16969128}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFJinWhite2007">Jin S, White E (2007). [//www.ncbi.nlm.nih.gov/pmc/articles/PMC2770734 "Role of autophagy in cancer: management of metabolic stress"]. ''Autophagy''. '''3''' (1): 28–31. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:[[doi:10.4161/auto.3269|10.4161/auto.3269]]. [[পাবমেড সেন্ট্রাল|PMC]] <span class="cs1-lock-free" title="Freely accessible">[//www.ncbi.nlm.nih.gov/pmc/articles/PMC2770734 2770734]</span>. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/16969128 16969128].</cite></ref> |
|||
| ⚫ | |||
অটোফ্যাজি-প্ররোচিত থেরাপির সময় ডোজ-প্রতিক্রিয়া-বিরোধী টিউমার প্রভাবগুলি দেখে প্রথম কৌশলটি পরীক্ষা করা হয়েছে। এই থেরাপিগুলি দেখিয়েছে যে ডোজ-নির্ভর পদ্ধতিতে অটোফ্যাজি বৃদ্ধি পায়। এটি সরাসরি ডোজ-নির্ভর পদ্ধতিতে ক্যান্সার কোষের বৃদ্ধির সাথে সম্পর্কিত। <ref name="Paglin">{{সাময়িকী উদ্ধৃতি|vauthors=Paglin S, Hollister T, Delohery T, Hackett N, McMahill M, Sphicas E, Domingo D, Yahalom J|তারিখ=January 2001|শিরোনাম=A novel response of cancer cells to radiation involves autophagy and formation of acidic vesicles|পাতাসমূহ=439–44|pmid=11212227}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFPaglinHollisterDeloheryHackett2001">Paglin S, Hollister T, Delohery T, Hackett N, McMahill M, Sphicas E, Domingo D, Yahalom J (January 2001). "A novel response of cancer cells to radiation involves autophagy and formation of acidic vesicles". ''Cancer Research''. '''61''' (2): 439–44. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/11212227 11212227].</cite></ref> <ref name=":0">{{সাময়িকী উদ্ধৃতি|vauthors=Tavassoly I, Parmar J, Shajahan-Haq AN, Clarke R, Baumann WT, Tyson JJ|তারিখ=April 2015|শিরোনাম=Dynamic Modeling of the Interaction Between Autophagy and Apoptosis in Mammalian Cells|পাতাসমূহ=263–72|doi=10.1002/psp4.29|pmc=4429580|pmid=26225250}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFTavassolyParmarShajahan-HaqClarke2015">Tavassoly I, Parmar J, Shajahan-Haq AN, Clarke R, Baumann WT, Tyson JJ (April 2015). [//www.ncbi.nlm.nih.gov/pmc/articles/PMC4429580 "Dynamic Modeling of the Interaction Between Autophagy and Apoptosis in Mammalian Cells"]. ''CPT: Pharmacometrics & Systems Pharmacology''. '''4''' (4): 263–72. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:[[doi:10.1002/psp4.29|10.1002/psp4.29]]. [[পাবমেড সেন্ট্রাল|PMC]] <span class="cs1-lock-free" title="Freely accessible">[//www.ncbi.nlm.nih.gov/pmc/articles/PMC4429580 4429580]</span>. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/26225250 26225250].</cite></ref> এই ডেটাগুলি থেরাপির বিকাশকে সমর্থন করে যা অটোফ্যাজিকে উত্সাহিত করবে। দ্বিতীয়ত, অটোফ্যাজি প্ররোচিত করার জন্য সরাসরি পরিচিত প্রোটিন পথগুলিকে বাধা দেওয়াও একটি অ্যান্টিক্যান্সার থেরাপি হিসাবে কাজ করতে পারে। <ref name="Jin">{{সাময়িকী উদ্ধৃতি|vauthors=Jin S, White E|বছর=2007|শিরোনাম=Role of autophagy in cancer: management of metabolic stress|পাতাসমূহ=28–31|doi=10.4161/auto.3269|pmc=2770734|pmid=16969128}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFJinWhite2007">Jin S, White E (2007). [//www.ncbi.nlm.nih.gov/pmc/articles/PMC2770734 "Role of autophagy in cancer: management of metabolic stress"]. ''Autophagy''. '''3''' (1): 28–31. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:[[doi:10.4161/auto.3269|10.4161/auto.3269]]. [[পাবমেড সেন্ট্রাল|PMC]] <span class="cs1-lock-free" title="Freely accessible">[//www.ncbi.nlm.nih.gov/pmc/articles/PMC2770734 2770734]</span>. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/16969128 16969128].</cite></ref> <ref name=":0" /> |
|||
অগ্ন্যাশয়ের ইনসুলিন-উৎপাদনকারী বিটা কোষে অটোফ্যাজি ফর্মের অটোফ্যাজির অত্যধিক কার্যকলাপ ক্ষরণের জন্য উপলব্ধ ইনসুলিনের পরিমাণ কমিয়ে দিতে পারে, যার ফলে টাইপ 2 ডায়াবেটিস হয় |
|||
দ্বিতীয় কৌশলটি এই ধারণার উপর ভিত্তি করে যে অটোফ্যাজি হল একটি প্রোটিন অবক্ষয় পদ্ধতি যা হোমিওস্ট্যাসিস বজায় রাখার জন্য ব্যবহৃত হয় এবং যে ফলাফলগুলি অটোফ্যাজিকে বাধা দেয় তা প্রায়শই অ্যাপোপটোসিসের দিকে পরিচালিত করে। অটোফ্যাজি প্রতিরোধ করা ঝুঁকিপূর্ণ কারণ এটি কাঙ্ক্ষিত কোষের মৃত্যুর পরিবর্তে কোষের বেঁচে থাকার দিকে পরিচালিত করতে পারে। <ref name="Paglin">{{সাময়িকী উদ্ধৃতি|vauthors=Paglin S, Hollister T, Delohery T, Hackett N, McMahill M, Sphicas E, Domingo D, Yahalom J|তারিখ=January 2001|শিরোনাম=A novel response of cancer cells to radiation involves autophagy and formation of acidic vesicles|পাতাসমূহ=439–44|pmid=11212227}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFPaglinHollisterDeloheryHackett2001">Paglin S, Hollister T, Delohery T, Hackett N, McMahill M, Sphicas E, Domingo D, Yahalom J (January 2001). "A novel response of cancer cells to radiation involves autophagy and formation of acidic vesicles". ''Cancer Research''. '''61''' (2): 439–44. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/11212227 11212227].</cite></ref> |
|||
=== অটোফ্যাজির নেতিবাচক নিয়ন্ত্রক === |
|||
অটোফ্যাজির নেতিবাচক নিয়ন্ত্রক, যেমন mTOR, cFLIP, EGFR, এবং (GAPR-1) অটোফ্যাজি ক্যাসকেডের বিভিন্ন পর্যায়ে কাজ করার জন্য সাজানো হয়। অটোফ্যাজিক হজমের শেষ পণ্যগুলি দীর্ঘায়িত কার্যকলাপ বন্ধ করার জন্য একটি নেতিবাচক-প্রতিক্রিয়া নিয়ন্ত্রক প্রক্রিয়া হিসাবেও কাজ করতে পারে। <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Razaghi A, Heimann K, Schaeffer PM, Gibson SB|তারিখ=February 2018|শিরোনাম=Negative regulators of cell death pathways in cancer: perspective on biomarkers and targeted therapies|পাতাসমূহ=93–112|doi=10.1007/s10495-018-1440-4|pmid=29322476}}</ref> |
|||
== প্রদাহ এবং অটোফ্যাজির মধ্যে ইন্টারফেস == |
|||
| ⚫ | |||
প্রদাহ নিয়ন্ত্রণের অটোফ্যাজি নিয়ন্ত্রণকারীর নিয়ন্ত্রক, এবং তদ্বিপরীত। <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Cadwell K|তারিখ=November 2016|শিরোনাম=Crosstalk between autophagy and inflammatory signalling pathways: balancing defence and homeostasis|পাতাসমূহ=661–675|doi=10.1038/nri.2016.100|pmc=5343289|pmid=27694913}}</ref> মেরুদণ্ডী প্রাণীর কোষগুলি সাধারণত সংক্রমণ পরিষ্কার করার জন্য প্রতিরোধ ব্যবস্থার ক্ষমতা বাড়াতে এবং টিস্যু গঠন এবং কার্যকারিতা পুনরুদ্ধার করে এমন প্রক্রিয়াগুলি শুরু করতে প্রদাহকে সক্রিয় করে। <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Medzhitov R|তারিখ=July 2008|শিরোনাম=Origin and physiological roles of inflammation|পাতাসমূহ=428–35|doi=10.1038/nature07201|pmid=18650913}}</ref> সুতরাং, প্রদাহ নিয়ন্ত্রণকারী প্রধান কারণগুলির সাথে সেলুলার এবং ব্যাকটেরিয়া ধ্বংসাবশেষ অপসারণের জন্য প্রক্রিয়াগুলির দম্পতি নিয়ন্ত্রণ করা গুরুত্বপূর্ণ: অটোফ্যাজির সময় লাইসোসোম দ্বারা সেলুলার উপাদানগুলির অবক্ষয় গুরুত্বপূর্ণ অণুগুলিকে পুনর্ব্যবহার করতে এবং বিল্ডিং ব্লকগুলির একটি পুল তৈরি করতে সহায়তা করে। কোষ পরিবর্তনশীল মাইক্রোএনভায়রনমেন্টে সাড়া দেয়। <ref>{{বই উদ্ধৃতি|শিরোনাম=Autophagy Regulation of Innate Immunity|vauthors=Tan P, Ye Y, Mao J, He L|তারিখ=2019|ধারাবাহিক=Advances in Experimental Medicine and Biology|পাতাসমূহ=167–179|অধ্যায়=Autophagy and Immune-Related Diseases|doi=10.1007/978-981-15-0606-2_10|আইএসবিএন=978-981-15-0605-5|pmid=31728870}}</ref> প্রোটিনগুলি যেগুলি প্রদাহ এবং অটোফ্যাজি নিয়ন্ত্রণ করে একটি নেটওয়ার্ক গঠন করে যা টিস্যু ফাংশনগুলির জন্য গুরুত্বপূর্ণ, যা ক্যান্সারে অনিয়ন্ত্রিত হয়: ক্যান্সার কোষগুলিতে, বিকৃতভাবে প্রকাশ করা এবং মিউট্যান্ট প্রোটিনগুলি প্রোটিওলাইটিক সিস্টেমের "পুনরায়যুক্ত" নেটওয়ার্কের উপর কোষের বেঁচে থাকার নির্ভরতা বাড়ায় যা ম্যালিগন্যান্ট কোষগুলিকে রক্ষা করে। অ্যাপোপটোটিক প্রোটিন থেকে এবং ইমিউন সিস্টেম দ্বারা স্বীকৃতি থেকে। <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Varisli L, Cen O, Vlahopoulos S|তারিখ=March 2020|শিরোনাম=Dissecting pharmacological effects of chloroquine in cancer treatment: interference with inflammatory signaling pathways|পাতাসমূহ=257–278|doi=10.1111/imm.13160|pmc=7011648|pmid=31782148}}</ref> এটি ক্যান্সার কোষকে অটোফ্যাজির নিয়ন্ত্রকদের হস্তক্ষেপের জন্য ঝুঁকিপূর্ণ করে। |
|||
| ⚫ | |||
| ⚫ | [[পারকিনসন রোগ|পারকিনসন্স ডিজিজ]] হল একটি নিউরোডিজেনারেটিভ ডিসঅর্ডার যা আংশিকভাবে [[মস্তিষ্ক]] এবং [[মস্তিষ্ককাণ্ড|মস্তিষ্কের স্টেম]] সেলের কোষের মৃত্যুর কারণে ঘটে থাকে যেমন সাবস্টানটিয়া নিগ্রা । পারকিনসন্স রোগের বৈশিষ্ট্য হল আলফা-সিনুক্লিয়েন (লেউই বডি) নামক প্রোটিনকে প্রভাবিত নিউরনে অন্তর্ভুক্ত করা যা কোষ ভেঙ্গে যেতে পারে না। অটোফ্যাজি পথের নিয়ন্ত্রণমুক্তকরণ এবং অটোফ্যাজি নিয়ন্ত্রণকারী অ্যালিলের মিউটেশন নিউরোডিজেনারেটিভ রোগের কারণ বলে মনে করা হয়।{{তথ্যসূত্র প্রয়োজন|date=December 2018}} নিউরোনাল বেঁচে থাকার জন্য অটোফ্যাজি অপরিহার্য।{{তথ্যসূত্র প্রয়োজন|date=December 2018}} দক্ষ অটোফ্যাজি ব্যতীত, নিউরনগুলি সর্বব্যাপী প্রোটিন একত্রিত করে এবং হ্রাস পায়।{{তথ্যসূত্র প্রয়োজন|date=December 2018}} Ubiquitinated প্রোটিন হল প্রোটিন যেগুলিকে অবনতি হওয়ার জন্য ubiquitin দিয়ে ট্যাগ করা হয়েছে। সিনুক্লিন অ্যালিলের মিউটেশন লাইসোসোম পিএইচ বৃদ্ধি এবং হাইড্রোলেজ বাধার দিকে পরিচালিত করে। ফলস্বরূপ, লাইসোসোমের অবক্ষয় ক্ষমতা হ্রাস পায়। PINK1 <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Valente EM, Abou-Sleiman PM, Caputo V, Muqit MM, Harvey K, Gispert S, Ali Z, Del Turco D, Bentivoglio AR, Healy DG, Albanese A, Nussbaum R, González-Maldonado R, Deller T, Salvi S, Cortelli P, Gilks WP, Latchman DS, Harvey RJ, Dallapiccola B, Auburger G, Wood NW|তারিখ=May 2004|শিরোনাম=Hereditary early-onset Parkinson's disease caused by mutations in PINK1|পাতাসমূহ=1158–60|doi=10.1126/science.1096284|pmid=15087508}}</ref> এবং পার্কিন ফাংশন হারানো সহ এই রোগের সাথে জড়িত বেশ কয়েকটি জেনেটিক মিউটেশন রয়েছে। <ref name="Kitada_1998">{{সাময়িকী উদ্ধৃতি|vauthors=Kitada T, Asakawa S, Hattori N, Matsumine H, Yamamura Y, Minoshima S, Yokochi M, Mizuno Y, Shimizu N|তারিখ=April 1998|শিরোনাম=Mutations in the parkin gene cause autosomal recessive juvenile parkinsonism|পাতাসমূহ=605–8|doi=10.1038/33416|pmid=9560156}}</ref> এই জিনগুলির কার্যকারিতা ক্ষতির ফলে ক্ষতিগ্রস্থ মাইটোকন্ড্রিয়াল সঞ্চয় এবং প্রোটিন একত্রিত হতে পারে যা সেলুলার অবক্ষয়ের দিকে পরিচালিত করতে পারে। মাইটোকন্ড্রিয়া পারকিনসন্স রোগের সাথে জড়িত। ইডিওপ্যাথিক পারকিনসন রোগে, এই রোগটি সাধারণত অকার্যকর মাইটোকন্ড্রিয়া, সেলুলার অক্সিডেটিভ স্ট্রেস, অটোফ্যাজিক পরিবর্তন এবং প্রোটিনের একত্রিতকরণের কারণে ঘটে। এগুলি মাইটোকন্ড্রিয়াল ফুলে যাওয়া এবং ডিপোলারাইজেশন হতে পারে। <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Esteves AR, Arduíno DM, Silva DF, Oliveira CR, Cardoso SM|তারিখ=January 2011|শিরোনাম=Mitochondrial Dysfunction: The Road to Alpha-Synuclein Oligomerization in PD|পাতাসমূহ=693761|doi=10.4061/2011/693761|pmc=3026982|pmid=21318163}}</ref> |
||
| ⚫ | |||
[[অগ্ন্যাশয়|অগ্ন্যাশয়ের]] ইনসুলিন-উৎপাদনকারী বিটা কোষে অটোফ্যাজি ফর্মের ক্রাইনোফ্যাজির অত্যধিক ক্রিয়াকলাপ ক্ষরণের জন্য উপলব্ধ [[ইনসুলিন|ইনসুলিনের]] পরিমাণ হ্রাস করতে পারে, যার ফলে [[টাইপ ২ ডায়াবেটিস|টাইপ 2 ডায়াবেটিস]] হয়। <ref name="pmid32620244">{{সাময়িকী উদ্ধৃতি|vauthors=Csizmadia T, Juhász G|বছর=2020|শিরোনাম=Crinophagy mechanisms and its potential role in human health and disease|পাতাসমূহ=239–255|doi=10.1016/bs.pmbts.2020.02.002|আইএসবিএন=9780128220214|pmid=32620244}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFCsizmadiaJuhász2020">Csizmadia T, Juhász G (2020). "Crinophagy mechanisms and its potential role in human health and disease". ''[[সায়েন্স ডাইরেক্ট|Progress in Molecular Biology and Translational Science]]''. '''172''': 239–255. [[ডিজিটাল অবজেক্ট আইডেন্টিফায়ার|doi]]:[[doi:10.1016/bs.pmbts.2020.02.002|10.1016/bs.pmbts.2020.02.002]]. [[আন্তর্জাতিক মান পুস্তক সংখ্যা|ISBN]] [[Special:BookSources/9780128220214|<bdi>9780128220214</bdi>]]. [[পাবমেড|PMID]] [//pubmed.ncbi.nlm.nih.gov/32620244 32620244]. [[S2CID (শনাক্তকারী)|S2CID]] [https://api.semanticscholar.org/CorpusID:212903191 212903191].</cite></ref> |
|||
== ড্রাগ টার্গেট হিসাবে অটোফ্যাজির তাত্পর্য == |
|||
| ⚫ | যেহেতু অটোফ্যাজির dysregulation রোগের বিস্তৃত পরিসরের প্যাথোজেনেসিসের সাথে জড়িত, তাই ছোট সিন্থেটিক বা প্রাকৃতিক অণুগুলিকে চিহ্নিত করতে এবং চিহ্নিত করার জন্য প্রচুর প্রচেষ্টা বিনিয়োগ করা হয় যা এটি নিয়ন্ত্রণ করতে পারে। <ref>{{সাময়িকী উদ্ধৃতি|vauthors=Moosavi MA, Haghi A, Rahmati M, Taniguchi H, Mocan A, Echeverría J, Gupta VK, Tzvetkov NT, Atanasov AG|বছর=2018|শিরোনাম=Phytochemicals as potent modulators of autophagy for cancer therapy|পাতাসমূহ=46–69|doi=10.1016/j.canlet.2018.02.030|pmid=29474859}}</ref> |
||
== আরো দেখুন == |
|||
== তথ্যসূত্র == |
|||
| ⚫ | |||
[[বিষয়শ্রেণী:অনাক্রম্যবিজ্ঞান]] |
[[বিষয়শ্রেণী:অনাক্রম্যবিজ্ঞান]] |
||
| ⚫ | |||
০৭:০৩, ১২ ফেব্রুয়ারি ২০২২ তারিখে সংশোধিত সংস্করণ

অটোফ্যাজি (বা অটোফ্যাগোসাইটোসিস ; আত্মভক্ষণ বা অটোফ্যাজি (বা অটোফ্যাগোসাইটোসিস; প্রাচীন গ্রীক αὐτόφαγος অটোফ্যাগোস থেকে, যার অর্থ "আত্ম-ভোজন" এবং κύτος kýtos, যার অর্থ "ফাঁপা" হল কোষের প্রাকৃতিক, সংরক্ষিত অবক্ষয় যা অপ্রয়োজনীয় বা বাধ্যতামূলক কাজের মাধ্যমে অপসারণ করে। লাইসোসোম-নির্ভর নিয়ন্ত্রিত প্রক্রিয়া। এটি সেলুলার উপাদানগুলির সুশৃঙ্খল অবক্ষয় এবং পুনর্ব্যবহার করার অনুমতি দেয়। যদিও প্রাথমিকভাবে অনাহার থেকে রক্ষা করার জন্য একটি আদিম অবক্ষয়ের পথ হিসাবে চিহ্নিত করা হয়েছিল, তবে এটি ক্রমবর্ধমানভাবে স্পষ্ট হয়ে উঠেছে যে অ-ক্ষুধার্ত কোষগুলির হোমিওস্ট্যাসিসে অটোফ্যাজিও একটি প্রধান ভূমিকা পালন করে। অটোফ্যাজির ত্রুটিগুলি নিউরোডিজেনারেশন এবং ক্যান্সার সহ বিভিন্ন মানব রোগের সাথে যুক্ত করা হয়েছে এবং এই রোগগুলির সম্ভাব্য চিকিত্সা হিসাবে অটোফ্যাজিকে সংশোধন করার আগ্রহ দ্রুত বৃদ্ধি পেয়েছে।অটোফ্যাজির চারটি রূপ শনাক্ত করা হয়েছে: ম্যাক্রোঅটোফ্যাগি, মাইক্রোঅটোফ্যাজি, চ্যাপেরোন-মিডিয়াটেড অটোফ্যাজি (CMA), এবং ক্রিনোফ্যাজি। ম্যাক্রোঅটোফ্যাজিতে (অটোফ্যাজির সবচেয়ে পুঙ্খানুপুঙ্খভাবে গবেষণা করা ফর্ম), সাইটোপ্লাজমিক উপাদানগুলি (মাইটোকন্ড্রিয়ার মতো) অটোফ্যাগোসোম নামে পরিচিত একটি ডাবল-মেমব্রেন ভেসিকলের মধ্যে কোষের বাকি অংশ থেকে লক্ষ্যবস্তু এবং বিচ্ছিন্ন করা হয়, যা সময়ের সাথে সাথে, একটি উপলব্ধ লাইসোসোমের সাথে ফিউজ করে, যার বর্জ্য ব্যবস্থাপনা এবং নিষ্পত্তির বিশেষ প্রক্রিয়া নিয়ে আসে; এবং অবশেষে ভেসিকলের বিষয়বস্তু (এখন এটি একটি অটোলাইসোসোম নামে পরিচিত) অবনতি এবং পুনর্ব্যবহৃত হয়। ক্রিনোফ্যাজিতে (অটোফ্যাজির সর্বনিম্ন পরিচিত এবং গবেষণাকৃত রূপ), অপ্রয়োজনীয় সিক্রেটরি গ্রানুলগুলিকে অবনমিত করে পুনর্ব্যবহার করা হয়।রোগে, অটোফ্যাজিকে মানসিক চাপের অভিযোজিত প্রতিক্রিয়া হিসাবে দেখা হয়, কোষের বেঁচে থাকার প্রচার করে; কিন্তু অন্যান্য ক্ষেত্রে, এটি কোষের মৃত্যু এবং অসুস্থতা প্রচার করে বলে মনে হয়। অনাহারের চরম ক্ষেত্রে, সেলুলার উপাদানগুলির ভাঙ্গন সেলুলার শক্তির মাত্রা বজায় রেখে সেলুলার বেঁচে থাকার প্রচার করে।"অটোফ্যাজি" শব্দটি 19 শতকের মাঝামাঝি থেকে বিদ্যমান ছিল এবং প্রায়শই ব্যবহৃত হত। এটির বর্তমান ব্যবহারে, অটোফ্যাজি শব্দটি 1963 সালে বেলজিয়ান জৈব রসায়নবিদ ক্রিশ্চিয়ান ডি ডুভ তার লাইসোসোমের কার্যাবলী আবিষ্কারের ভিত্তিতে তৈরি করেছিলেন। 1990-এর দশকে ইস্টে অটোফ্যাজি-সম্পর্কিত জিনের সনাক্তকরণ গবেষকদের অটোফ্যাজির প্রক্রিয়াগুলি বের করার অনুমতি দেয়,যা শেষ পর্যন্ত 2016 তে ফিজিওলজিতে নোবেল পুরস্কার বা পুরস্কার লাভ করে জাপানি গবেষক ইয়োশিনোরি ওহসুমির ওষুধ।
অটোফ্যাগির চারটি রূপ শনাক্ত করা হয়েছে: ম্যাক্রোঅটোফ্যাগি, মাইক্রোঅটোফ্যাগি, চ্যাপেরোন - মিডিয়াটেড অটোফ্যাজি (সিএমএ), এবং ক্রিনোপ্যাগি। [১] ম্যাক্রোঅটোফ্যাজিতে (অটোফ্যাজির সবচেয়ে পুঙ্খানুপুঙ্খভাবে গবেষণা করা ফর্ম), সাইটোপ্লাজমিক উপাদানগুলি (যেমন মাইটোকন্ড্রিয়া) অটোফ্যাগোসোম নামে পরিচিত একটি ডাবল-মেমব্রেন ভেসিকলের মধ্যে কোষের বাকি অংশ থেকে লক্ষ্যবস্তু এবং বিচ্ছিন্ন করা হয়, [২] [৩] যা সময়ের সাথে সাথে, একটি উপলব্ধ লাইসোসোমের সাথে ফিউজ করে, বর্জ্য ব্যবস্থাপনা এবং নিষ্পত্তির বিশেষ প্রক্রিয়া নিয়ে আসে; এবং অবশেষে ভেসিকলের বিষয়বস্তু (এখন এটি একটি অটোলাইসোসোম বলা হয়) অবনমিত হয় এবং পুনর্ব্যবহৃত হয়। ক্রিনোফ্যাজিতে (অটোফ্যাজির সর্বনিম্ন সুপরিচিত এবং গবেষণাকৃত রূপ), অপ্রয়োজনীয় সিক্রেটরি গ্রানুলগুলিকে অবনমিত করা হয় এবং পুনর্ব্যবহার করা হয়। [১]
রোগে, অটোফ্যাজিকে মানসিক চাপের অভিযোজিত প্রতিক্রিয়া হিসাবে দেখা হয়, কোষের বেঁচে থাকার প্রচার করে; কিন্তু অন্যান্য ক্ষেত্রে, এটি কোষের মৃত্যু এবং অসুস্থতাকে উন্নীত করে বলে মনে হয়। অনাহারের চরম ক্ষেত্রে, সেলুলার উপাদানগুলির ভাঙ্গন সেলুলার শক্তির মাত্রা বজায় রেখে সেলুলার বেঁচে থাকার প্রচার করে।
"অটোফ্যাজি" শব্দটি 19 শতকের মাঝামাঝি থেকে বিদ্যমান ছিল এবং প্রায়শই ব্যবহৃত হত। [৪] এটির বর্তমান ব্যবহারে, অটোফ্যাজি শব্দটি 1963 সালে বেলজিয়ান জৈব রসায়নবিদ ক্রিশ্চিয়ান ডি ডুভ লাইসোসোমের কার্যাবলী আবিষ্কারের ভিত্তিতে তৈরি করেছিলেন। [৫] 1990-এর দশকে ইস্টে অটোফ্যাজি-সম্পর্কিত জিনের সনাক্তকরণ গবেষকদের অটোফ্যাজির প্রক্রিয়াগুলি বের করার অনুমতি দেয়, [৬] [৭] [৮] [৯] [১০] যা অবশেষে 2016 তে ফিজিওলজিতে নোবেল পুরস্কার বা জাপানি গবেষক ইয়োশিনোরি ওহসুমির ওষুধ । [১১]
কিথ আর. পোর্টার এবং তার ছাত্র টমাস অ্যাশফোর্ড রকফেলার ইনস্টিটিউটে অটোফ্যাজি প্রথম পর্যবেক্ষণ করেছিলেন। 1962 সালের জানুয়ারিতে তারা গ্লুকাগন যোগ করার পর ইঁদুরের যকৃতের কোষে লাইসোসোমের সংখ্যা বৃদ্ধির কথা জানায় এবং কোষের কেন্দ্রের দিকে কিছু স্থানচ্যুত লাইসোসোমে মাইটোকন্ড্রিয়ার মতো অন্যান্য কোষের অর্গানেল রয়েছে। ক্রিশ্চিয়ান ডি ডুভ এবং অ্যালেক্স বি নোভিকফের নামানুসারে তারা এই অটোলাইসিসকে বলে। তবে পোর্টার এবং অ্যাশফোর্ড ভুলভাবে তাদের ডেটাকে লাইসোসোম গঠন হিসাবে ব্যাখ্যা করেছেন (প্রাক-বিদ্যমান অর্গানেলগুলিকে উপেক্ষা করে)। লাইসোসোমগুলি কোষের অর্গানেল হতে পারে না, তবে সাইটোপ্লাজমের অংশ যেমন মাইটোকন্ড্রিয়া এবং সেই হাইড্রোলাইটিক এনজাইমগুলি মাইক্রোবডি দ্বারা উত্পাদিত হয়েছিল। [১২] 1963 সালে Hruban, Spargo এবং সহকর্মীরা "ফোকাল সাইটোপ্লাজমিক অবক্ষয়" এর একটি বিশদ আল্ট্রাস্ট্রাকচারাল বর্ণনা প্রকাশ করেন, যা আঘাত-প্ররোচিত সিকোয়েস্ট্রেশনের 1955 সালের জার্মান গবেষণার উল্লেখ করে। Hruban, Spargo এবং সহকর্মীরা লাইসোসোমে বিচ্ছিন্ন সাইটোপ্লাজমের পরিপক্কতার তিনটি ক্রমাগত পর্যায়কে স্বীকৃতি দিয়েছিলেন এবং এই প্রক্রিয়াটি শুধুমাত্র আঘাতের অবস্থার মধ্যেই সীমাবদ্ধ ছিল না যা "কোষীয় পদার্থের পুনঃব্যবহার" এবং পার্থক্যের সময় "অর্গানেলের নিষ্পত্তি" এর জন্য শারীরবৃত্তীয় অবস্থার অধীনে কাজ করে। . [১৩] এই আবিষ্কারের দ্বারা অনুপ্রাণিত হয়ে, ডি ডুভ ঘটনাটিকে "অটোফ্যাজি" নামকরণ করেছিলেন। পোর্টার এবং অ্যাশফোর্ডের বিপরীতে, ডি ডুভ লিভারে কোষের অবক্ষয়ের একটি প্রধান প্রবর্তক হিসাবে গ্লুকাগনের ভূমিকা বর্ণনা করার সময় লাইসোসোমাল ফাংশনের একটি অংশ হিসাবে এই শব্দটিকে কল্পনা করেছিলেন। তার ছাত্র রাসেল ডিটারের সাথে, তিনি প্রতিষ্ঠা করেছিলেন যে লাইসোসোমগুলি গ্লুকাগন-প্ররোচিত অটোফ্যাজির জন্য দায়ী। [১৪] [১৫] এই প্রথম সত্য যে লাইসোসোমগুলি অন্তঃকোষীয় অটোফ্যাজির সাইটগুলি প্রতিষ্ঠিত হয়েছিল। [৫] [১৬] [১৭]
1990-এর দশকে বিজ্ঞানীদের কয়েকটি দল স্বাধীনভাবে উদীয়মান খামির ব্যবহার করে অটোফ্যাজি-সম্পর্কিত জিন আবিষ্কার করেছিল। উল্লেখযোগ্যভাবে, ইয়োশিনোরি ওহসুমি এবং মাইকেল থাম অনাহার-প্ররোচিত অ-নির্বাচিত অটোফ্যাজি পরীক্ষা করেছেন; [৭] [৮] [৯] এরই মধ্যে, ড্যানিয়েল জে. ক্লিয়নস্কি সাইটোপ্লাজম-টু-ভ্যাক্যুল টার্গেটিং (সিভিটি) পথ আবিষ্কার করেন, যা নির্বাচনী অটোফ্যাজির একটি রূপ। [৬] [১০] তারা শীঘ্রই দেখতে পেল যে তারা আসলে একই পথ দেখছে, শুধু ভিন্ন কোণ থেকে। [১৮] [১৯] প্রাথমিকভাবে, এই এবং অন্যান্য খামির গ্রুপগুলির দ্বারা আবিষ্কৃত জিনগুলিকে বিভিন্ন নাম দেওয়া হয়েছিল (APG, AUT, CVT, GSA, PAG, PAZ, এবং PDD)। 2003 সালে খামির গবেষকরা অটোফ্যাজি জিন বোঝাতে ATG ব্যবহার করার জন্য একটি ঐক্যবদ্ধ নামকরণের পক্ষে ছিলেন। [২০] 2016 সালের ফিজিওলজি বা মেডিসিনে নোবেল পুরস্কারটি ইয়োশিনোরি ওহসুমিকে দেওয়া হয়েছিল, [১১] যদিও কেউ কেউ উল্লেখ করেছেন যে পুরস্কারটি আরও অন্তর্ভুক্ত হতে পারত। [২১]
সমসাময়িক সাহিত্যে, ব্রাজিলিয়ান লেখক লিওনিড আর বোজিও অটোফ্যাজিকে একটি অস্তিত্বের প্রশ্ন হিসাবে প্রকাশ করেছেন। টেম্পোস সোমব্রিওস [২২] বইয়ের মনস্তাত্ত্বিক নাটকে এমন চরিত্রের কথা বলা হয়েছে যারা তাদের নিজেদের জীবনকে অপ্রমাণিত অস্তিত্বে গ্রাস করে।
ম্যাক্রো, মাইক্রো এবং চ্যাপেরোন মধ্যস্থতাকারী অটোফ্যাজি অটোফ্যাজি-সম্পর্কিত জিন এবং তাদের সংশ্লিষ্ট এনজাইম দ্বারা মধ্যস্থতা করা হয়। [২] [৩] [২৩] [২৪] [২৫] ম্যাক্রোঅটোফ্যাজি তখন বাল্ক এবং সিলেক্টিভ অটোফ্যাজিতে বিভক্ত। নির্বাচনী অটোফ্যাজিতে অর্গানেলের অটোফ্যাজি হয়; মাইটোফ্যাজি, [২৬] লিপোফ্যাজি, [২৭] পেক্সোফ্যাজি, [২৮] ক্লোরোফ্যাজি, [২৯] রিবোফ্যাজি [৩০] এবং অন্যান্য।
ম্যাক্রোঅটোফ্যাজি হল প্রধান পথ, যা প্রাথমিকভাবে ক্ষতিগ্রস্ত কোষের অর্গানেল বা অব্যবহৃত প্রোটিন নির্মূল করতে ব্যবহৃত হয়। [৩১] প্রথমে ফাগোফোর এমন উপাদানকে আচ্ছন্ন করে যাকে অবনমিত করতে হয়, যা ধ্বংসের জন্য চিহ্নিত অর্গানেলের চারপাশে অটোফাগোসোম নামে পরিচিত একটি দ্বিগুণ ঝিল্লি তৈরি করে। [২৪] [৩২] অটোফ্যাগোসোম তারপর কোষের সাইটোপ্লাজমের মধ্য দিয়ে স্তন্যপায়ী প্রাণীর একটি লাইসোসোমে বা খামির ও উদ্ভিদের ভ্যাকুয়ালে যায় [৩৩] এবং দুটি অর্গানেল একত্রিত হয়। [২৪] লাইসোসোম/ভ্যাকুওলের মধ্যে, অটোফাগোসোমের বিষয়বস্তু অ্যাসিডিক লাইসোসোমাল হাইড্রোলেজের মাধ্যমে ক্ষয়প্রাপ্ত হয়। [৩৪]
অন্যদিকে, মাইক্রোঅটোফ্যাজি লাইসোসোমে সাইটোপ্লাজমিক উপাদানের সরাসরি আবদ্ধতাকে জড়িত করে। [৩৫] এটি ইনভাজিনেশনের মাধ্যমে ঘটে, যার অর্থ লাইসোসোমাল ঝিল্লির অভ্যন্তরীণ ভাঁজ, বা সেলুলার প্রোট্রুশন। [৩২]
চ্যাপেরোন -মিডিয়াটেড অটোফ্যাজি, বা সিএমএ, একটি অত্যন্ত জটিল এবং নির্দিষ্ট পথ, যা hsc70- ধারণকারী কমপ্লেক্স দ্বারা স্বীকৃতি জড়িত। [৩৬] এর মানে হল যে একটি প্রোটিনে অবশ্যই এই hsc70 কমপ্লেক্সের স্বীকৃতির স্থান থাকতে হবে যা এটিকে এই চ্যাপেরোনের সাথে আবদ্ধ হতে দেয়, যা CMA- সাবস্ট্রেট/চ্যাপেরোন কমপ্লেক্স গঠন করে। [৩৪] এই কমপ্লেক্সটি তারপর লাইসোসোমাল মেমব্রেন-বাউন্ড প্রোটিনে চলে যায় যা CMA রিসেপ্টরের সাথে চিনবে এবং আবদ্ধ করবে। স্বীকৃতির পরে, সাবস্ট্রেট প্রোটিনটি উন্মোচিত হয় এবং এটি লাইসোসোমাল hsc70 চ্যাপেরোনের সহায়তায় লাইসোসোম ঝিল্লি জুড়ে স্থানান্তরিত হয়। [২৩] [২৪] CMA অন্যান্য ধরনের অটোফ্যাজি থেকে উল্লেখযোগ্যভাবে আলাদা কারণ এটি প্রোটিন উপাদানকে একে একে স্থানান্তর করে এবং কোন উপাদান লাইসোসোমাল বাধা অতিক্রম করে সে সম্পর্কে এটি অত্যন্ত নির্বাচনী। [৩১]
মাইটোফ্যাজি হল অটোফ্যাজি দ্বারা মাইটোকন্ড্রিয়ার নির্বাচনী অবক্ষয়। এটি প্রায়ই ক্ষতি বা চাপের পরে ত্রুটিপূর্ণ মাইটোকন্ড্রিয়ায় ঘটে। মাইটোফ্যাগি মাইটোকন্ড্রিয়ার টার্নওভারকে উৎসাহিত করে এবং অকার্যকর মাইটোকন্ড্রিয়া জমা হতে বাধা দেয় যা সেলুলার অবক্ষয়ের দিকে পরিচালিত করতে পারে। এটি স্তন্যপায়ী প্রাণীদের মধ্যে Atg32 (খামিরে) এবং NIX এবং এর নিয়ন্ত্রক BNIP3 দ্বারা মধ্যস্থতা করা হয়। মাইটোফ্যাজি PINK1 এবং পার্কিন প্রোটিন দ্বারা নিয়ন্ত্রিত হয়। মাইটোফ্যাজির ঘটনা শুধুমাত্র ক্ষতিগ্রস্ত মাইটোকন্ড্রিয়াতেই সীমাবদ্ধ নয় বরং এর সাথে ক্ষতিগ্রস্থদেরও জড়িত। [২৫]
Lipophagy হল অটোফ্যাজি দ্বারা লিপিডের অবক্ষয়, [২৭] এমন একটি ফাংশন যা প্রাণী এবং ছত্রাক উভয় কোষেই বিদ্যমান বলে প্রমাণিত হয়েছে। [৩৭] উদ্ভিদ কোষে লাইপোফ্যাগির ভূমিকা অবশ্য অধরা থেকে যায়। [৩৮] লিপোফ্যাজিতে লক্ষ্যবস্তু হল লিপিড কাঠামো যাকে লিপিড ড্রপলেট (LDs), গোলাকার "অর্গানেলস" বলা হয় যা প্রধানত ট্রায়াসিলগ্লিসারল ( TAGs ) এবং ফসফোলিপিড এবং মেমব্রেন প্রোটিনের এক স্তর বিশিষ্ট। প্রাণী কোষে প্রধান লাইপোফ্যাজিক পথ হল ফ্যাগোফোর, ম্যাক্রোঅটোফ্যাজি দ্বারা এলডি-র আবদ্ধ হওয়ার মাধ্যমে। অন্যদিকে ছত্রাকের কোষগুলিতে মাইক্রোপ্লিপোফ্যাজি প্রধান পথ তৈরি করে এবং বিশেষ করে উদীয়মান খামির স্যাকারোমাইসিস সেরেভিসিয়াতে ভালভাবে অধ্যয়ন করা হয় [৩৯] । Lipophagy প্রথম ইঁদুরের মধ্যে আবিষ্কৃত হয়েছিল এবং 2009 সালে প্রকাশিত হয়েছিল। [৪০]
অটোফ্যাজি জিনাস-নির্দিষ্ট প্রোটিনকে লক্ষ্য করে, তাই অর্থলগাস প্রোটিন যা একে অপরের সাথে সিকোয়েন্স হোমোলজি শেয়ার করে একটি নির্দিষ্ট অটোফ্যাজি টার্গেটিং প্রোটিন দ্বারা সাবস্ট্রেট হিসাবে স্বীকৃত হয়। অটোফ্যাজি টার্গেটিং প্রোটিনের একটি পরিপূরকতা বিদ্যমান যা মিউটেশনের পরে সম্ভাব্য সংক্রমণের ঝুঁকি বাড়ায়। 3টি অটোফ্যাজি প্রোটিনের লক্ষ্যগুলির মধ্যে ওভারল্যাপের অভাব এবং জেনারার পরিপ্রেক্ষিতে বড় ওভারল্যাপ দেখায় যে অটোফ্যাজি একই প্যাথোজেন থেকে ব্যাকটেরিয়া প্রোটিনের বিভিন্ন সেটকে লক্ষ্য করতে পারে। একদিকে, একই জেনারে টার্গেট করার অপ্রয়োজনীয়তা শক্তিশালী প্যাথোজেন স্বীকৃতির জন্য উপকারী। কিন্তু, অন্যদিকে, নির্দিষ্ট ব্যাকটেরিয়া প্রোটিনের পরিপূরকতা হোস্টকে দীর্ঘস্থায়ী ব্যাধি এবং সংক্রমণের জন্য আরও সংবেদনশীল করে তুলতে পারে যদি অটোফ্যাজি টার্গেটিং প্রোটিনগুলির মধ্যে একটির এনকোডিং জিন পরিবর্তিত হয়ে যায়, এবং অটোফ্যাজি সিস্টেমটি ওভারলোড হয় বা অন্যান্য ত্রুটির শিকার হয়। তাছাড়া, অটোফ্যাজি টার্গেট করে ভাইরুলেন্স ফ্যাক্টর এবং ভাইরাসজনিত ফ্যাক্টরগুলি আরও সাধারণ ফাংশনের জন্য দায়ী যেমন পুষ্টি অধিগ্রহণ এবং গতিশীলতা একাধিক অটোফ্যাজি টার্গেটিং প্রোটিন দ্বারা স্বীকৃত হয়। এবং অটোলাইসিন এবং আয়রন সিকোয়েস্টারিং প্রোটিনের মতো বিশেষ ভাইরাসজনিত কারণগুলি একটি একক অটোফ্যাজি টার্গেটিং প্রোটিন দ্বারা সম্ভাব্যভাবে স্বীকৃত হয়। অটোফ্যাজি প্রোটিন CALCOCO2/NDP52 এবং MAP1LC3/LC3 বিশেষভাবে প্যাথোজেন বা প্যাথোজেনিক প্রোটিনকে অটোফ্যাজিক অবক্ষয়ের লক্ষ্যে বিবর্তিত হতে পারে। যদিও SQSTM1/p62 আরও জেনেরিক ব্যাকটেরিয়া প্রোটিনকে লক্ষ্য করে যাতে একটি টার্গেট মোটিফ থাকে কিন্তু ভাইরাসের সাথে সম্পর্কিত নয়। [৪১]
অন্যদিকে, বিভিন্ন প্যাথোজেনিক জেনার থেকে ব্যাকটেরিয়া প্রোটিনগুলিও অটোফ্যাজিকে সংশোধন করতে সক্ষম। অটোফ্যাজির পর্যায়গুলিতে জিনাস-নির্দিষ্ট নিদর্শন রয়েছে যা সম্ভাব্যভাবে একটি প্রদত্ত প্যাথোজেন গ্রুপ দ্বারা নিয়ন্ত্রিত হয়। কিছু অটোফ্যাজি পর্যায়গুলি শুধুমাত্র নির্দিষ্ট প্যাথোজেন দ্বারা সংশোধিত হতে পারে, যখন কিছু পর্যায় একাধিক প্যাথোজেন জেনার দ্বারা সংশোধিত হয়। ইন্টারপ্লে-সম্পর্কিত কিছু ব্যাকটেরিয়া প্রোটিনের প্রোটিওলাইটিক এবং পোস্ট-ট্রান্সলেশনাল ক্রিয়াকলাপ যেমন ফসফোরিলেশন এবং সর্বব্যাপী এবং অটোফ্যাজি প্রোটিনের কার্যকলাপে হস্তক্ষেপ করতে পারে। [৪১]
অটোফ্যাজি অটোফ্যাজি-সম্পর্কিত (এটিজি) জিন দ্বারা কার্যকর করা হয়। 2003 সালের আগে, দশ বা ততোধিক নাম ব্যবহার করা হয়েছিল, কিন্তু এই বিন্দুর পরে ছত্রাক অটোফ্যাজি গবেষকদের দ্বারা একটি একীভূত নামকরণ তৈরি করা হয়েছিল। [৪২] Atg বা ATG মানে অটোফ্যাজি সম্পর্কিত। এটি জিন বা প্রোটিন নির্দিষ্ট করে না। [৪২]
স্যাকারোমাইসিস সেরেভিসিয়াতে পরিচালিত জেনেটিক স্ক্রিন দ্বারা প্রথম অটোফ্যাজি জিনগুলি সনাক্ত করা হয়েছিল। [৬] [৭] [৮] [৯] [১০] তাদের সনাক্তকরণের পরে সেই জিনগুলি কার্যকরীভাবে চিহ্নিত করা হয়েছিল এবং বিভিন্ন ধরণের জীবের মধ্যে তাদের অর্থলগগুলি সনাক্ত করা হয়েছিল এবং অধ্যয়ন করা হয়েছিল। [২] [৪৩] আজ, ছত্রিশটি এটিজি প্রোটিনকে অটোফ্যাজির জন্য বিশেষভাবে গুরুত্বপূর্ণ হিসাবে শ্রেণীবদ্ধ করা হয়েছে, যার মধ্যে 18টি মূল যন্ত্রপাতির অন্তর্গত [৪৪]
স্তন্যপায়ী প্রাণীদের মধ্যে, অ্যামিনো অ্যাসিড সংবেদন এবং অতিরিক্ত সংকেত যেমন বৃদ্ধির কারণ এবং প্রতিক্রিয়াশীল অক্সিজেন প্রজাতি প্রোটিন কাইনেস এমটিওআর এবং এএমপিকে এর কার্যকলাপ নিয়ন্ত্রণ করে। [৪৩] [৪৫] এই দুটি কাইনেস Unc-51-এর মতো কাইনেস ULK1 এবং ULK2 (Atg1-এর স্তন্যপায়ী হোমোলগ) এর ইনহিবিটরি ফসফোরিলেশনের মাধ্যমে অটোফ্যাজি নিয়ন্ত্রণ করে। [৪৬] অটোফ্যাজি আনয়নের ফলে ডিফসফোরিলেশন এবং ইউএলকে কাইনেস সক্রিয় হয়। ULK হল একটি প্রোটিন কমপ্লেক্সের অংশ যেখানে Atg13, Atg101 এবং FIP200 রয়েছে । ULK ফসফরিলেট এবং সক্রিয় করে বেক্লিন -1 (Atg6 এর স্তন্যপায়ী হোমোলগ ), [৪৭] যা একটি প্রোটিন কমপ্লেক্সেরও অংশ। অটোফ্যাজি-ইনডিউসিবল বেক্লিন-1 কমপ্লেক্স [৪৮] প্রোটিন PIK3R4 (p150), Atg14L এবং ক্লাস III ফসফেটিডাইলিনোসিটল 3-ফসফেট কিনেস (PI(3)K) Vps34 ধারণ করে । [৪৯] সক্রিয় ULK এবং Beclin-1 কমপ্লেক্সগুলি অটোফ্যাগোসোম সূচনার স্থান, ফাগোফোরে পুনরায় স্থানীয়করণ করে, যেখানে তারা উভয়ই ডাউনস্ট্রিম অটোফ্যাজি উপাদানগুলির সক্রিয়করণে অবদান রাখে। [৫০] [৫১]
একবার সক্রিয় হলে, VPS34 ফসফরিলেট করে লিপিড ফসফ্যাটিডাইলিনোসিটলকে ফ্যাগোফোরের পৃষ্ঠে ফসফ্যাটিডিলিনোসিটল 3-ফসফেট (PtdIns(3)P) তৈরি করতে। উৎপন্ন PtdIns(3)P একটি PtdIns(3)P বাঁধাই মোটিফকে আশ্রয়কারী প্রোটিনের জন্য ডকিং পয়েন্ট হিসাবে ব্যবহৃত হয়। WIPI2, WIPI (WD-রিপিট প্রোটিন ফসফাইনোসাইটাইডের সাথে ইন্টারঅ্যাক্ট করে) প্রোটিন পরিবারের একটি PtdIns(3)P বাইন্ডিং প্রোটিন, সম্প্রতি Atg16L1 কে শারীরিকভাবে আবদ্ধ দেখানো হয়েছে। [৫২] Atg16L1 হল একটি E3-এর মতো প্রোটিন কমপ্লেক্সের সদস্য যা অটোফ্যাগোসোম গঠনের জন্য প্রয়োজনীয় দুটি ইউবিকুইটিনের মতো কনজুগেশন সিস্টেমের একটিতে জড়িত। FIP200 cis-Golgi- থেকে প্রাপ্ত ঝিল্লি ATG16L1-পজিটিভ এন্ডোসোমাল ঝিল্লির সাথে ফিউজ করে হাইপাস (হাইব্রিড প্রি-অটোফ্যাগোসোমাল স্ট্রাকচার) নামক প্রোফাগোফোর গঠন করে। [৫৩] ATG16L1 WIPI2 [৫৪] এর সাথে আবদ্ধ হওয়া ATG16L1 এর কার্যকলাপের মধ্যস্থতা করে। এটি একটি ইউবিকুইটিন-সদৃশ কনজুগেশন সিস্টেমের মাধ্যমে প্রোফাগোফোরকে ATG8-পজিটিভ ফ্যাগোফোর [৫৩] -এ রূপান্তরিত করে।
অটোফ্যাজিতে জড়িত দুটি ইউবিকুইটিন-সদৃশ সংযোগ ব্যবস্থার মধ্যে প্রথমটি ইউবিকুইটিনের মতো প্রোটিন Atg12 কে Atg5 এর সাথে সংযুক্ত করে। ফলস্বরূপ কনজুগেট প্রোটিনটি তখন Atg16L1 কে একটি E3-এর মতো কমপ্লেক্স তৈরি করতে আবদ্ধ করে যা দ্বিতীয় ইউবিকিটিন-সদৃশ সংযোগ ব্যবস্থার অংশ হিসাবে কাজ করে। [৫৫] এই জটিলটি Atg3 কে আবদ্ধ করে এবং সক্রিয় করে, যা স্তন্যপায়ী হোমোলগগুলিকে ইউবিকুইটিন-সদৃশ ইস্ট প্রোটিন ATG8 ( LC3A-C, GATE16, এবং GABARAPL1-3) সংযুক্ত করে, যা সবচেয়ে বেশি অধ্যয়ন করা হয় LC3 প্রোটিন, পৃষ্ঠের লিপিড ফসফ্যাটিডাইলেথানোলামিনের সাথে। অটোফ্যাগোসোমের। [৫৬] লিপিডেটেড LC3 অটোফাগোসোম বন্ধ করতে অবদান রাখে, [৫৭] এবং নির্দিষ্ট কার্গোস এবং অ্যাডাপ্টার প্রোটিন যেমন Sequestosome-1/ p62 এর ডকিং সক্ষম করে। [৫৮] সম্পূর্ণ অটোফ্যাগোসোম তারপর SNAREs [৫৯] [৬০] এবং UVRAG সহ একাধিক প্রোটিনের ক্রিয়াকলাপের মাধ্যমে একটি লাইসোসোমের সাথে ফিউজ হয়ে যায়। [৬১] ফিউশন অনুসরণ করে LC3 ভেসিকলের ভিতরের দিকে ধরে রাখা হয় এবং কার্গোর সাথে সাথে ক্ষয়প্রাপ্ত হয়, যখন বাইরের দিকে সংযুক্ত LC3 অণুগুলি Atg4 দ্বারা ক্লিভড হয় এবং পুনর্ব্যবহৃত হয়। [৬২] অটোলাইসোসোমের বিষয়বস্তু পরবর্তীকালে ক্ষয়প্রাপ্ত হয় এবং তাদের বিল্ডিং ব্লকগুলি ভেসিকল থেকে পারমিজের ক্রিয়াকলাপের মাধ্যমে মুক্তি পায়। [৬৩]
ফাংশন
বিভিন্ন সেলুলার ফাংশনে অটোফ্যাজির ভূমিকা রয়েছে। একটি বিশেষ উদাহরণ হল খামির, যেখানে পুষ্টির অনাহার উচ্চ স্তরের অটোফ্যাজিকে প্ররোচিত করে। এটি অপ্রয়োজনীয় প্রোটিনগুলিকে অবনমিত করার অনুমতি দেয় এবং বেঁচে থাকার জন্য প্রয়োজনীয় প্রোটিনগুলির সংশ্লেষণের জন্য অ্যামিনো অ্যাসিড পুনর্ব্যবহৃত হয়। [৬৪] [৬৫] [৬৬] উচ্চতর ইউক্যারিওটে, ট্রান্স-প্ল্যাসেন্টাল খাদ্য সরবরাহ বন্ধ করার পরে, সেইসাথে পুষ্টির ক্ষুধার্ত সংস্কৃতিযুক্ত কোষ এবং টিস্যুতে জন্মের সময় প্রাণীদের মধ্যে পুষ্টির হ্রাসের প্রতিক্রিয়া হিসাবে অটোফ্যাজি প্ররোচিত হয়। [৬৭] [৬৮] মিউট্যান্ট ইস্ট কোষ যাদের অটোফ্যাজিক ক্ষমতা হ্রাস পায় সেগুলি পুষ্টির ঘাটতি অবস্থায় দ্রুত ধ্বংস হয়ে যায়। [৬৯] এপিজি মিউট্যান্টদের উপর অধ্যয়নগুলি পরামর্শ দেয় যে অটোফেজিক দেহের মাধ্যমে অটোফ্যাজি ক্ষুধার্ত অবস্থায় শূন্যস্থানে প্রোটিনের অবক্ষয়ের জন্য অপরিহার্য, এবং অন্তত 15টি এপিজি জিন খামিরের অটোফ্যাজিতে জড়িত। [৬৯] ATG7 নামে পরিচিত একটি জিন পুষ্টি-মধ্যস্থিত অটোফ্যাজিতে জড়িত ছিল, কারণ ইঁদুরের গবেষণায় দেখা গেছে যে ক্ষুধা-প্ররোচিত অটোফ্যাজি atg7-অপ্রতুল ইঁদুরে প্রতিবন্ধী ছিল। [৬৮]
ভেসিকুলার স্টোমাটাইটিস ভাইরাস সাইটোসোল থেকে অটোফাগোসোম দ্বারা গ্রহণ করা হয় এবং এন্ডোসোমে স্থানান্তরিত হয় যেখানে টোল-লাইক রিসেপ্টর 7 নামক প্যাটার্ন রিকগনিশন রিসেপ্টর দ্বারা সনাক্ত করা হয়, একক আটকে থাকা আরএনএ সনাক্ত করে। টোল-সদৃশ রিসেপ্টর সক্রিয় হওয়ার পরে, অন্তঃকোষীয় সিগন্যালিং ক্যাসকেডগুলি শুরু হয়, যার ফলে ইন্টারফেরন এবং অন্যান্য অ্যান্টিভাইরাল সাইটোকাইনগুলি অন্তর্ভুক্ত হয়। ভাইরাস এবং ব্যাকটেরিয়ার একটি উপসেট তাদের নিজস্ব প্রতিলিপি প্রচারের জন্য অটোফ্যাজিক পথকে বিকৃত করে। [৭০] গ্যালেক্টিন-8 সম্প্রতি একটি অন্তঃকোষীয় "বিপদ রিসেপ্টর" হিসাবে চিহ্নিত করা হয়েছে, যা অন্তঃকোষীয় রোগজীবাণুগুলির বিরুদ্ধে অটোফ্যাজি শুরু করতে সক্ষম। যখন গ্যালেক্টিন-8 একটি ক্ষতিগ্রস্ত ভ্যাকুওলের সাথে আবদ্ধ হয়, তখন এটি একটি অটোফ্যাজি অ্যাডাপ্টার নিয়োগ করে যেমন NDP52 যা একটি অটোফ্যাগোসোম এবং ব্যাকটেরিয়া অবক্ষয় গঠনের দিকে পরিচালিত করে। [৭১]
মেরামত প্রক্রিয়া
অটোফ্যাজি ক্ষতিগ্রস্থ অর্গানেল, কোষের ঝিল্লি এবং প্রোটিনকে ক্ষয় করে এবং অপর্যাপ্ত অটোফ্যাজি ক্ষতিগ্রস্থ কোষ জমে এবং বার্ধক্যের অন্যতম প্রধান কারণ বলে মনে করা হয়। [৭২] অটোফ্যাজি এবং অটোফ্যাজি নিয়ন্ত্রক লাইসোসোমাল ক্ষতির প্রতিক্রিয়ার সাথে জড়িত, যা প্রায়শই গ্যালেক্টিন যেমন গ্যালেক্টিন-3 এবং গ্যালেক্টিন-8 দ্বারা পরিচালিত হয়।
প্রোগ্রাম করা কোষের মৃত্যু
প্রোগ্রামড সেল ডেথ (পিসিডি) এর একটি প্রক্রিয়া অটোফাগোসোমের উপস্থিতির সাথে যুক্ত এবং অটোফ্যাজি প্রোটিনের উপর নির্ভর করে। কোষের মৃত্যুর এই রূপটি সম্ভবত এমন একটি প্রক্রিয়ার সাথে মিলে যায় যা অটোফ্যাজিক পিসিডি হিসাবে morphologically সংজ্ঞায়িত করা হয়েছে। একটি প্রশ্ন যা ক্রমাগত উত্থাপিত হয়, তবে, মৃত কোষে অটোফাজিক কার্যকলাপ মৃত্যুর কারণ নাকি আসলে এটি প্রতিরোধ করার একটি প্রচেষ্টা। রূপগত এবং হিস্টোকেমিক্যাল অধ্যয়নগুলি এখনও পর্যন্ত অটোফ্যাজিক প্রক্রিয়া এবং কোষের মৃত্যুর মধ্যে একটি কার্যকারক সম্পর্ক প্রমাণ করেনি। প্রকৃতপক্ষে, সম্প্রতি শক্তিশালী যুক্তি রয়েছে যে মৃত কোষে অটোফ্যাজিক কার্যকলাপ আসলে একটি বেঁচে থাকার প্রক্রিয়া হতে পারে। [৭৩] [৭৪] পোকামাকড়ের মেটামরফোসিসের গবেষণায় দেখা গেছে যে কোষগুলি PCD-এর একটি ফর্মের মধ্য দিয়ে যাচ্ছে যা অন্যান্য ফর্ম থেকে আলাদা বলে মনে হয়; এগুলি অটোফ্যাজিক কোষের মৃত্যুর উদাহরণ হিসাবে প্রস্তাবিত হয়েছে। [৭৫] সাম্প্রতিক ফার্মাকোলজিকাল এবং জৈব রাসায়নিক গবেষণায় প্রস্তাব করা হয়েছে যে বেঁচে থাকা এবং প্রাণঘাতী অটোফ্যাজিকে বিশেষ করে ভাইরাল সংক্রমণের পরে চাপের সময় নিয়ন্ত্রক সংকেতের ধরন এবং মাত্রা দ্বারা আলাদা করা যেতে পারে। [৭৬] যদিও প্রতিশ্রুতিশীল, এই ফলাফলগুলি অ-ভাইরাল সিস্টেমে পরীক্ষা করা হয়নি।
ব্যায়াম
বেসাল হোমিওস্টেসিসের জন্য অটোফ্যাজি অপরিহার্য; শারীরিক ব্যায়ামের সময় পেশী হোমিওস্ট্যাসিস বজায় রাখার জন্য এটি অত্যন্ত গুরুত্বপূর্ণ। [৭৭] [৭৮] আণবিক স্তরে অটোফ্যাজি শুধুমাত্র আংশিকভাবে বোঝা যায়। ইঁদুরের একটি সমীক্ষা দেখায় যে অটোফ্যাজি তাদের পুষ্টি এবং শক্তির চাহিদার নিরন্তর পরিবর্তনশীল চাহিদার জন্য গুরুত্বপূর্ণ, বিশেষ করে প্রোটিন ক্যাটাবলিজমের বিপাকীয় পথের মাধ্যমে। ডালাসের ইউনিভার্সিটি অফ টেক্সাস সাউথ ওয়েস্টার্ন মেডিক্যাল সেন্টার দ্বারা পরিচালিত 2012 সালের একটি গবেষণায়, মিউট্যান্ট ইঁদুর ( BCL2 ফসফোরিলেশন সাইটগুলির একটি নক-ইন মিউটেশন সহ বংশধর তৈরি করতে যা বেসাল অটোফ্যাজির স্বাভাবিক মাত্রা দেখায় তবে চাপ-প্ররোচিত অটোফ্যাজিতে ঘাটতি ছিল) পরীক্ষা করা হয়েছিল। এই তত্ত্বকে চ্যালেঞ্জ করতে। ফলাফলগুলি দেখায় যে একটি নিয়ন্ত্রণ গোষ্ঠীর সাথে তুলনা করলে, এই ইঁদুরগুলি তীব্র ব্যায়ামের সময় সহনশীলতা হ্রাস এবং একটি পরিবর্তিত গ্লুকোজ বিপাক চিত্রিত করে। [৭৯]
অন্য একটি গবেষণায় দেখা গেছে যে কোলাজেন VI নকআউট ইঁদুরের কঙ্কালের পেশী ফাইবারগুলি অটোফ্যাজির অপ্রতুলতার কারণে অবক্ষয়ের লক্ষণ দেখায় যা ক্ষতিগ্রস্থ মাইটোকন্ড্রিয়া এবং অতিরিক্ত কোষের মৃত্যুর কারণ হয়ে দাঁড়ায়। [৮০] ব্যায়াম-প্ররোচিত অটোফ্যাজি যদিও ব্যর্থ হয়েছিল; কিন্তু যখন ব্যায়াম-পরবর্তী অটোফ্যাজি কৃত্রিমভাবে প্ররোচিত হয়, তখন কোলাজেন VI- এর ঘাটতিযুক্ত পেশী ফাইবারগুলিতে ক্ষতিগ্রস্ত অর্গানেলগুলি জমা হওয়া প্রতিরোধ করা হয়েছিল এবং সেলুলার হোমিওস্ট্যাসিস বজায় রাখা হয়েছিল। উভয় গবেষণাই দেখায় যে অটোফ্যাজি ইনডাকশন ব্যায়ামের উপকারী বিপাকীয় প্রভাবে অবদান রাখতে পারে এবং ব্যায়ামের সময় পেশী হোমিওস্ট্যাসিস বজায় রাখতে এটি অপরিহার্য, বিশেষ করে কোলাজেন VI ফাইবারগুলিতে। [৭৯] [৭৮] [৮০]
ইনস্টিটিউট ফর সেল বায়োলজি, বন ইউনিভার্সিটির কাজ দেখিয়েছে যে একটি নির্দিষ্ট ধরণের অটোফ্যাজি, অর্থাৎ চ্যাপেরোন-অ্যাসিস্টেড সিলেক্টিভ অটোফ্যাজি (CASA), পেশী সংকোচনের জন্য প্ররোচিত হয় এবং যান্ত্রিক উত্তেজনার মধ্যে পেশী সারকোমের বজায় রাখার জন্য প্রয়োজনীয়। [৮১] CASA চ্যাপেরোন কমপ্লেক্স যান্ত্রিকভাবে ক্ষতিগ্রস্থ সাইটোস্কেলটন উপাদানগুলিকে স্বীকৃতি দেয় এবং নিষ্পত্তির জন্য লাইসোসোমগুলিতে একটি ubiquitin- নির্ভর অটোফ্যাজিক বাছাই পথের মাধ্যমে এই উপাদানগুলিকে নির্দেশ করে। পেশী কার্যকলাপ বজায় রাখার জন্য এটি প্রয়োজনীয়। [৮১] [৮২]
অস্টিওআর্থারাইটিস
যেহেতু বয়সের সাথে সাথে অটোফ্যাজি কমে যায় এবং বয়স অস্টিওআর্থারাইটিসের জন্য একটি প্রধান ঝুঁকির কারণ, এই রোগের বিকাশে অটোফ্যাজির ভূমিকার পরামর্শ দেওয়া হয়। অটোফ্যাজিতে জড়িত প্রোটিনগুলি বয়সের সাথে সাথে মানুষের এবং মাউসের আর্টিকুলার কার্টিলেজে হ্রাস পায়। [৮৩] সংস্কৃতিতে কারটিলেজ এক্সপ্ল্যান্টের যান্ত্রিক আঘাতও অটোফ্যাজি প্রোটিন হ্রাস করে। [৮৪] অটোফ্যাজি ক্রমাগত স্বাভাবিক তরুণাস্থিতে সক্রিয় হয় কিন্তু বয়সের সাথে আপোস করা হয় এবং কারটিলেজ কোষের মৃত্যু এবং কাঠামোগত ক্ষতির আগে। [৮৫] এইভাবে অটোফ্যাজি জয়েন্টে একটি স্বাভাবিক প্রতিরক্ষামূলক প্রক্রিয়া ( কন্ড্রোপ্রোটেকশন ) এর সাথে জড়িত।
ক্যান্সার
ক্যান্সার প্রায়ই ঘটে যখন কোষের পার্থক্য নিয়ন্ত্রিত বিভিন্ন পথ ব্যাহত হয়। অটোফ্যাজি ক্যান্সারে একটি গুরুত্বপূর্ণ ভূমিকা পালন করে - উভয়ই ক্যান্সারের বিরুদ্ধে সুরক্ষার পাশাপাশি ক্যান্সারের বৃদ্ধিতে সম্ভাব্য অবদান রাখে। [৭৩] [৮৬] অটোফ্যাজি ক্ষুধার্ত টিউমার কোষগুলির বেঁচে থাকার প্রচারের মাধ্যমে ক্যান্সারে অবদান রাখতে পারে, বা অটোফ্যাজির মাধ্যমে অ্যাপোপটোটিক মধ্যস্থতাকারীদের অবনমিত করে: এই ধরনের ক্ষেত্রে, অটোফ্যাজির শেষ পর্যায়ের ইনহিবিটর (যেমন ক্লোরোকুইন ) ব্যবহার করে যে কোষগুলি অটোফ্যাজি ব্যবহার করে। বেঁচে থাকা, অ্যান্টিনোপ্লাস্টিক ওষুধের দ্বারা নিহত ক্যান্সার কোষের সংখ্যা বৃদ্ধি করে। [৮৭]
ক্যান্সারে অটোফ্যাজির ভূমিকা এমন একটি যা অত্যন্ত গবেষণা এবং পর্যালোচনা করা হয়েছে। এমন প্রমাণ রয়েছে যা টিউমার দমনকারী এবং টিউমার কোষের বেঁচে থাকার একটি কারণ হিসাবে অটোফ্যাজির ভূমিকাকে জোর দেয়। সাম্প্রতিক গবেষণায় দেখা গেছে যে, অটোফ্যাজিটি বেশ কয়েকটি মডেল অনুসারে টিউমার দমনকারী হিসাবে ব্যবহার করার সম্ভাবনা বেশি। [৮৬]
টিউমার দমনকারী
ইঁদুর এবং বিভিন্ন রকমের বেক্লিন 1 নিয়ে বেশ কিছু পরীক্ষা করা হয়েছে, একটি প্রোটিন যা অটোফ্যাজি নিয়ন্ত্রণ করে। যখন বেক্লিন 1 জিনকে হেটেরোজাইগাস (বেক্লিন 1+/-) হিসাবে পরিবর্তিত করা হয়েছিল, তখন ইঁদুরগুলি টিউমার-প্রবণ বলে প্রমাণিত হয়েছিল। [৮৮] যাইহোক, যখন বেক্লিন 1 অত্যধিক এক্সপ্রেসড ছিল, তখন টিউমারের বিকাশ বাধাগ্রস্ত হয়েছিল। [৮৯] বেক্লিন মিউট্যান্টের ফেনোটাইপগুলি ব্যাখ্যা করার সময় এবং অটোফ্যাজির ত্রুটির জন্য পর্যবেক্ষণগুলিকে দায়ী করার সময় যত্ন নেওয়া উচিত, তবে: বেক্লিন 1 সাধারণত ফসফ্যাটিডাইলিনোসিটল 3- ফসফেট উত্পাদনের জন্য প্রয়োজন এবং যেমন এটি অসংখ্য লাইসোসোমাল এবং এন্ডোসোমাল ফাংশনগুলিকে প্রভাবিত করে, যার মধ্যে এন্ডোকাইটোসিটেশন অফ এন্ডোকাইটোসিটেশন সহ। বৃদ্ধি ফ্যাক্টর রিসেপ্টর। অটোফ্যাজি-স্বাধীন পথের মাধ্যমে বেকলিন1 ক্যান্সারের বিকাশকে প্রভাবিত করে এমন সম্ভাবনার সমর্থনে এই সত্য যে মূল অটোফ্যাজি কারণগুলি যা অন্যান্য সেলুলার প্রক্রিয়াগুলিকে প্রভাবিত করে এবং নিশ্চিতভাবে কোষের বিস্তার এবং কোষের মৃত্যুকে প্রভাবিত করে না, যেমন Atg7 বা Atg5।, একটি ভিন্ন ফিনোটাইপ দেখান যখন সংশ্লিষ্ট জিনটি ছিটকে যায়, যা টিউমার গঠন অন্তর্ভুক্ত করে না। উপরন্তু, Beclin1-এর সম্পূর্ণ নকআউট ভ্রূণজনিত প্রাণঘাতী যেখানে Atg7 বা Atg5-এর নকআউট নয়।
নেক্রোসিস এবং দীর্ঘস্থায়ী প্রদাহও অটোফ্যাজির মাধ্যমে সীমিত দেখানো হয়েছে যা টিউমার কোষ গঠনের বিরুদ্ধে রক্ষা করতে সাহায্য করে। [৯০]
টিউমার কোষ বেঁচে থাকা
বিকল্পভাবে, টিউমার কোষের বেঁচে থাকার ক্ষেত্রে অটোফ্যাজি একটি বড় ভূমিকা পালন করতে দেখা গেছে। ক্যান্সারযুক্ত কোষগুলিতে, অটোফ্যাজি কোষের উপর চাপ মোকাবেলা করার উপায় হিসাবে ব্যবহৃত হয়। [৯১] উদাহরণস্বরূপ, miRNA-4673 দ্বারা অটোফ্যাজি অন্তর্ভুক্ত করা একটি প্রো-সারভাইভাল মেকানিজম যা বিকিরণের বিরুদ্ধে ক্যান্সার কোষের প্রতিরোধ ক্ষমতা উন্নত করে। [৯২] একবার এই অটোফ্যাজি সম্পর্কিত জিনগুলিকে বাধা দেওয়া হলে, কোষের মৃত্যুর সম্ভাবনা ছিল। [৯৩] বিপাকীয় শক্তি বৃদ্ধি অটোফ্যাজি ফাংশন দ্বারা অফসেট হয়. এই বিপাকীয় চাপের মধ্যে রয়েছে হাইপোক্সিয়া, পুষ্টির বঞ্চনা এবং বিস্তার বৃদ্ধি। এই স্ট্রেসগুলি ATP রিসাইকেল করতে এবং ক্যান্সারের কোষগুলির বেঁচে থাকার জন্য অটোফ্যাজি সক্রিয় করে। [৯৪] অটোফ্যাজি সেলুলার শক্তি উৎপাদন বজায় রেখে টিউমার কোষের ক্রমাগত বৃদ্ধিকে সক্ষম করে দেখানো হয়েছে। এই টিউমার কোষগুলিতে অটোফ্যাজি জিনগুলিকে বাধা দেওয়ার মাধ্যমে, টিউমারের রিগ্রেশন এবং টিউমার দ্বারা প্রভাবিত অঙ্গগুলির বর্ধিত বেঁচে থাকা পাওয়া গেছে। তদ্ব্যতীত, অটোফ্যাজির বাধাও ক্যান্সার প্রতিরোধী থেরাপির কার্যকারিতা বাড়াতে দেখানো হয়েছে। [৯৪]
কোষের মৃত্যুর প্রক্রিয়া
যে কোষগুলি অত্যধিক চাপের মধ্য দিয়ে যায় সেগুলি অ্যাপোপটোসিস বা নেক্রোসিসের মাধ্যমে কোষের মৃত্যু অনুভব করে। দীর্ঘায়িত অটোফ্যাজি অ্যাক্টিভেশন প্রোটিন এবং অর্গানেলের উচ্চ টার্নওভার হারের দিকে পরিচালিত করে। বেঁচে থাকার থ্রেশহোল্ডের উপরে একটি উচ্চ হার একটি উচ্চ অ্যাপোপটোটিক থ্রেশহোল্ড সহ ক্যান্সার কোষকে মেরে ফেলতে পারে। [৯৪] [৯৫] এই কৌশলটি একটি থেরাপিউটিক ক্যান্সার চিকিত্সা হিসাবে ব্যবহার করা যেতে পারে। [৭৩]
গবেষণায় নতুন উন্নয়ন পাওয়া গেছে যে লক্ষ্যযুক্ত অটোফ্যাজি ক্যান্সারের বিরুদ্ধে লড়াই করার জন্য একটি কার্যকর থেরাপিউটিক সমাধান হতে পারে। উপরে আলোচনা করা হয়েছে, অটোফ্যাজি টিউমার দমন এবং টিউমার কোষের বেঁচে থাকার উভয় ভূমিকা পালন করে। সুতরাং, অটোফ্যাজির গুণাবলী ক্যান্সার প্রতিরোধের কৌশল হিসাবে ব্যবহার করা যেতে পারে। প্রথম কৌশলটি হল অটোফ্যাজি প্ররোচিত করা এবং এর টিউমার দমন বৈশিষ্ট্যগুলিকে উন্নত করা। দ্বিতীয় কৌশলটি হল অটোফ্যাজিকে বাধা দেওয়া এবং এইভাবে অ্যাপোপটোসিসকে প্ররোচিত করা। [৯৩]
অটোফ্যাজি-প্ররোচিত থেরাপির সময় ডোজ-প্রতিক্রিয়া-বিরোধী টিউমার প্রভাবগুলি দেখে প্রথম কৌশলটি পরীক্ষা করা হয়েছে। এই থেরাপিগুলি দেখিয়েছে যে ডোজ-নির্ভর পদ্ধতিতে অটোফ্যাজি বৃদ্ধি পায়। এটি সরাসরি ডোজ-নির্ভর পদ্ধতিতে ক্যান্সার কোষের বৃদ্ধির সাথে সম্পর্কিত। [৯১] [৯৫] এই ডেটাগুলি থেরাপির বিকাশকে সমর্থন করে যা অটোফ্যাজিকে উত্সাহিত করবে। দ্বিতীয়ত, অটোফ্যাজি প্ররোচিত করার জন্য সরাসরি পরিচিত প্রোটিন পথগুলিকে বাধা দেওয়াও একটি অ্যান্টিক্যান্সার থেরাপি হিসাবে কাজ করতে পারে। [৯৩] [৯৫]
দ্বিতীয় কৌশলটি এই ধারণার উপর ভিত্তি করে যে অটোফ্যাজি হল একটি প্রোটিন অবক্ষয় পদ্ধতি যা হোমিওস্ট্যাসিস বজায় রাখার জন্য ব্যবহৃত হয় এবং যে ফলাফলগুলি অটোফ্যাজিকে বাধা দেয় তা প্রায়শই অ্যাপোপটোসিসের দিকে পরিচালিত করে। অটোফ্যাজি প্রতিরোধ করা ঝুঁকিপূর্ণ কারণ এটি কাঙ্ক্ষিত কোষের মৃত্যুর পরিবর্তে কোষের বেঁচে থাকার দিকে পরিচালিত করতে পারে। [৯১]
অটোফ্যাজির নেতিবাচক নিয়ন্ত্রক
অটোফ্যাজির নেতিবাচক নিয়ন্ত্রক, যেমন mTOR, cFLIP, EGFR, এবং (GAPR-1) অটোফ্যাজি ক্যাসকেডের বিভিন্ন পর্যায়ে কাজ করার জন্য সাজানো হয়। অটোফ্যাজিক হজমের শেষ পণ্যগুলি দীর্ঘায়িত কার্যকলাপ বন্ধ করার জন্য একটি নেতিবাচক-প্রতিক্রিয়া নিয়ন্ত্রক প্রক্রিয়া হিসাবেও কাজ করতে পারে। [৯৬]
প্রদাহ এবং অটোফ্যাজির মধ্যে ইন্টারফেস
প্রদাহ নিয়ন্ত্রণের অটোফ্যাজি নিয়ন্ত্রণকারীর নিয়ন্ত্রক, এবং তদ্বিপরীত। [৯৭] মেরুদণ্ডী প্রাণীর কোষগুলি সাধারণত সংক্রমণ পরিষ্কার করার জন্য প্রতিরোধ ব্যবস্থার ক্ষমতা বাড়াতে এবং টিস্যু গঠন এবং কার্যকারিতা পুনরুদ্ধার করে এমন প্রক্রিয়াগুলি শুরু করতে প্রদাহকে সক্রিয় করে। [৯৮] সুতরাং, প্রদাহ নিয়ন্ত্রণকারী প্রধান কারণগুলির সাথে সেলুলার এবং ব্যাকটেরিয়া ধ্বংসাবশেষ অপসারণের জন্য প্রক্রিয়াগুলির দম্পতি নিয়ন্ত্রণ করা গুরুত্বপূর্ণ: অটোফ্যাজির সময় লাইসোসোম দ্বারা সেলুলার উপাদানগুলির অবক্ষয় গুরুত্বপূর্ণ অণুগুলিকে পুনর্ব্যবহার করতে এবং বিল্ডিং ব্লকগুলির একটি পুল তৈরি করতে সহায়তা করে। কোষ পরিবর্তনশীল মাইক্রোএনভায়রনমেন্টে সাড়া দেয়। [৯৯] প্রোটিনগুলি যেগুলি প্রদাহ এবং অটোফ্যাজি নিয়ন্ত্রণ করে একটি নেটওয়ার্ক গঠন করে যা টিস্যু ফাংশনগুলির জন্য গুরুত্বপূর্ণ, যা ক্যান্সারে অনিয়ন্ত্রিত হয়: ক্যান্সার কোষগুলিতে, বিকৃতভাবে প্রকাশ করা এবং মিউট্যান্ট প্রোটিনগুলি প্রোটিওলাইটিক সিস্টেমের "পুনরায়যুক্ত" নেটওয়ার্কের উপর কোষের বেঁচে থাকার নির্ভরতা বাড়ায় যা ম্যালিগন্যান্ট কোষগুলিকে রক্ষা করে। অ্যাপোপটোটিক প্রোটিন থেকে এবং ইমিউন সিস্টেম দ্বারা স্বীকৃতি থেকে। [১০০] এটি ক্যান্সার কোষকে অটোফ্যাজির নিয়ন্ত্রকদের হস্তক্ষেপের জন্য ঝুঁকিপূর্ণ করে।
পারকিনসন রোগ
পারকিনসন্স ডিজিজ হল একটি নিউরোডিজেনারেটিভ ডিসঅর্ডার যা আংশিকভাবে মস্তিষ্ক এবং মস্তিষ্কের স্টেম সেলের কোষের মৃত্যুর কারণে ঘটে থাকে যেমন সাবস্টানটিয়া নিগ্রা । পারকিনসন্স রোগের বৈশিষ্ট্য হল আলফা-সিনুক্লিয়েন (লেউই বডি) নামক প্রোটিনকে প্রভাবিত নিউরনে অন্তর্ভুক্ত করা যা কোষ ভেঙ্গে যেতে পারে না। অটোফ্যাজি পথের নিয়ন্ত্রণমুক্তকরণ এবং অটোফ্যাজি নিয়ন্ত্রণকারী অ্যালিলের মিউটেশন নিউরোডিজেনারেটিভ রোগের কারণ বলে মনে করা হয়।[তথ্যসূত্র প্রয়োজন] নিউরোনাল বেঁচে থাকার জন্য অটোফ্যাজি অপরিহার্য।[তথ্যসূত্র প্রয়োজন] দক্ষ অটোফ্যাজি ব্যতীত, নিউরনগুলি সর্বব্যাপী প্রোটিন একত্রিত করে এবং হ্রাস পায়।[তথ্যসূত্র প্রয়োজন] Ubiquitinated প্রোটিন হল প্রোটিন যেগুলিকে অবনতি হওয়ার জন্য ubiquitin দিয়ে ট্যাগ করা হয়েছে। সিনুক্লিন অ্যালিলের মিউটেশন লাইসোসোম পিএইচ বৃদ্ধি এবং হাইড্রোলেজ বাধার দিকে পরিচালিত করে। ফলস্বরূপ, লাইসোসোমের অবক্ষয় ক্ষমতা হ্রাস পায়। PINK1 [১০১] এবং পার্কিন ফাংশন হারানো সহ এই রোগের সাথে জড়িত বেশ কয়েকটি জেনেটিক মিউটেশন রয়েছে। [১০২] এই জিনগুলির কার্যকারিতা ক্ষতির ফলে ক্ষতিগ্রস্থ মাইটোকন্ড্রিয়াল সঞ্চয় এবং প্রোটিন একত্রিত হতে পারে যা সেলুলার অবক্ষয়ের দিকে পরিচালিত করতে পারে। মাইটোকন্ড্রিয়া পারকিনসন্স রোগের সাথে জড়িত। ইডিওপ্যাথিক পারকিনসন রোগে, এই রোগটি সাধারণত অকার্যকর মাইটোকন্ড্রিয়া, সেলুলার অক্সিডেটিভ স্ট্রেস, অটোফ্যাজিক পরিবর্তন এবং প্রোটিনের একত্রিতকরণের কারণে ঘটে। এগুলি মাইটোকন্ড্রিয়াল ফুলে যাওয়া এবং ডিপোলারাইজেশন হতে পারে। [১০৩]
টাইপ 2 ডায়াবেটিস
অগ্ন্যাশয়ের ইনসুলিন-উৎপাদনকারী বিটা কোষে অটোফ্যাজি ফর্মের ক্রাইনোফ্যাজির অত্যধিক ক্রিয়াকলাপ ক্ষরণের জন্য উপলব্ধ ইনসুলিনের পরিমাণ হ্রাস করতে পারে, যার ফলে টাইপ 2 ডায়াবেটিস হয়। [১]
ড্রাগ টার্গেট হিসাবে অটোফ্যাজির তাত্পর্য
যেহেতু অটোফ্যাজির dysregulation রোগের বিস্তৃত পরিসরের প্যাথোজেনেসিসের সাথে জড়িত, তাই ছোট সিন্থেটিক বা প্রাকৃতিক অণুগুলিকে চিহ্নিত করতে এবং চিহ্নিত করার জন্য প্রচুর প্রচেষ্টা বিনিয়োগ করা হয় যা এটি নিয়ন্ত্রণ করতে পারে। [১০৪]
আরো দেখুন
তথ্যসূত্র
- ↑ ক খ গ Csizmadia T, Juhász G (২০২০)। "Crinophagy mechanisms and its potential role in human health and disease": 239–255। আইএসবিএন 9780128220214। ডিওআই:10.1016/bs.pmbts.2020.02.002। পিএমআইডি 32620244
|pmid=এর মান পরীক্ষা করুন (সাহায্য)। উদ্ধৃতি ত্রুটি:<ref>ট্যাগ বৈধ নয়; আলাদা বিষয়বস্তুর সঙ্গে "pmid32620244" নামটি একাধিক বার সংজ্ঞায়িত করা হয়েছে - ↑ ক খ গ Mizushima N, Yoshimori T, Ohsumi Y (১০ নভেম্বর ২০১১)। "The role of Atg proteins in autophagosome formation": 107–32। ডিওআই:10.1146/annurev-cellbio-092910-154005। পিএমআইডি 21801009। উদ্ধৃতি ত্রুটি:
<ref>ট্যাগ বৈধ নয়; আলাদা বিষয়বস্তুর সঙ্গে "mizushima 2011 ARCDB review" নামটি একাধিক বার সংজ্ঞায়িত করা হয়েছে - ↑ ক খ Xie Z, Klionsky DJ (অক্টোবর ২০০৭)। "Autophagosome formation: core machinery and adaptations": 1102–9। ডিওআই:10.1038/ncb1007-1102। পিএমআইডি 17909521। উদ্ধৃতি ত্রুটি:
<ref>ট্যাগ বৈধ নয়; আলাদা বিষয়বস্তুর সঙ্গে "klionsky 2007 review" নামটি একাধিক বার সংজ্ঞায়িত করা হয়েছে - ↑ Ktistakis NT (২০১৭)। "In praise of M. Anselmier who first used the term "autophagie" in 1859": 2015–2017। ডিওআই:10.1080/15548627.2017.1367473। পিএমআইডি 28837378। পিএমসি 5788564
 ।
।
- ↑ ক খ Klionsky DJ (আগস্ট ২০০৮)। "Autophagy revisited: a conversation with Christian de Duve": 740–3। ডিওআই:10.4161/auto.6398
 । পিএমআইডি 18567941। উদ্ধৃতি ত্রুটি:
। পিএমআইডি 18567941। উদ্ধৃতি ত্রুটি: <ref>ট্যাগ বৈধ নয়; আলাদা বিষয়বস্তুর সঙ্গে "klionsky" নামটি একাধিক বার সংজ্ঞায়িত করা হয়েছে - ↑ ক খ গ Klionsky DJ, Cueva R, Yaver DS (অক্টোবর ১৯৯২)। "Aminopeptidase I of Saccharomyces cerevisiae is localized to the vacuole independent of the secretory pathway": 287–99। ডিওআই:10.1083/jcb.119.2.287। পিএমআইডি 1400574। পিএমসি 2289658
 ।Klionsky DJ, Cueva R, Yaver DS (October 1992). "Aminopeptidase I of Saccharomyces cerevisiae is localized to the vacuole independent of the secretory pathway". The Journal of Cell Biology. 119 (2): 287–99. doi:10.1083/jcb.119.2.287. PMC 2289658. PMID 1400574. উদ্ধৃতি ত্রুটি:
।Klionsky DJ, Cueva R, Yaver DS (October 1992). "Aminopeptidase I of Saccharomyces cerevisiae is localized to the vacuole independent of the secretory pathway". The Journal of Cell Biology. 119 (2): 287–99. doi:10.1083/jcb.119.2.287. PMC 2289658. PMID 1400574. উদ্ধৃতি ত্রুটি: <ref>ট্যাগ বৈধ নয়; আলাদা বিষয়বস্তুর সঙ্গে "klionsky 1992" নামটি একাধিক বার সংজ্ঞায়িত করা হয়েছে - ↑ ক খ গ Takeshige K, Baba M, Tsuboi S, Noda T, Ohsumi Y (অক্টোবর ১৯৯২)। "Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction": 301–11। ডিওআই:10.1083/jcb.119.2.301। পিএমআইডি 1400575। পিএমসি 2289660
 ।Takeshige K, Baba M, Tsuboi S, Noda T, Ohsumi Y (October 1992). "Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction". The Journal of Cell Biology. 119 (2): 301–11. doi:10.1083/jcb.119.2.301. PMC 2289660. PMID 1400575. উদ্ধৃতি ত্রুটি:
।Takeshige K, Baba M, Tsuboi S, Noda T, Ohsumi Y (October 1992). "Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction". The Journal of Cell Biology. 119 (2): 301–11. doi:10.1083/jcb.119.2.301. PMC 2289660. PMID 1400575. উদ্ধৃতি ত্রুটি: <ref>ট্যাগ বৈধ নয়; আলাদা বিষয়বস্তুর সঙ্গে "ohsumi 1992" নামটি একাধিক বার সংজ্ঞায়িত করা হয়েছে - ↑ ক খ গ Thumm M, Egner R, Koch B, Schlumpberger M, Straub M, Veenhuis M, Wolf DH (আগস্ট ১৯৯৪)। "Isolation of autophagocytosis mutants of Saccharomyces cerevisiae": 275–80। ডিওআই:10.1016/0014-5793(94)00672-5। পিএমআইডি 8050581।Thumm M, Egner R, Koch B, Schlumpberger M, Straub M, Veenhuis M, Wolf DH (August 1994). "Isolation of autophagocytosis mutants of Saccharomyces cerevisiae". FEBS Letters. 349 (2): 275–80. doi:10.1016/0014-5793(94)00672-5. PMID 8050581. S2CID 26072787. উদ্ধৃতি ত্রুটি:
<ref>ট্যাগ বৈধ নয়; আলাদা বিষয়বস্তুর সঙ্গে "thumm 1994" নামটি একাধিক বার সংজ্ঞায়িত করা হয়েছে - ↑ ক খ গ Tsukada M, Ohsumi Y (অক্টোবর ১৯৯৩)। "Isolation and characterization of autophagy-defective mutants of Saccharomyces cerevisiae": 169–74। ডিওআই:10.1016/0014-5793(93)80398-e
 । পিএমআইডি 8224160।Tsukada M, Ohsumi Y (October 1993). "Isolation and characterization of autophagy-defective mutants of Saccharomyces cerevisiae". FEBS Letters. 333 (1–2): 169–74. doi:10.1016/0014-5793(93)80398-e. PMID 8224160. S2CID 46017791. উদ্ধৃতি ত্রুটি:
। পিএমআইডি 8224160।Tsukada M, Ohsumi Y (October 1993). "Isolation and characterization of autophagy-defective mutants of Saccharomyces cerevisiae". FEBS Letters. 333 (1–2): 169–74. doi:10.1016/0014-5793(93)80398-e. PMID 8224160. S2CID 46017791. উদ্ধৃতি ত্রুটি: <ref>ট্যাগ বৈধ নয়; আলাদা বিষয়বস্তুর সঙ্গে "ohsumi 1993" নামটি একাধিক বার সংজ্ঞায়িত করা হয়েছে - ↑ ক খ গ Harding TM, Morano KA, Scott SV, Klionsky DJ (নভেম্বর ১৯৯৫)। "Isolation and characterization of yeast mutants in the cytoplasm to vacuole protein targeting pathway": 591–602। ডিওআই:10.1083/jcb.131.3.591। পিএমআইডি 7593182। পিএমসি 2120622
 ।Harding TM, Morano KA, Scott SV, Klionsky DJ (November 1995). "Isolation and characterization of yeast mutants in the cytoplasm to vacuole protein targeting pathway". The Journal of Cell Biology. 131 (3): 591–602. doi:10.1083/jcb.131.3.591. PMC 2120622. PMID 7593182. উদ্ধৃতি ত্রুটি:
।Harding TM, Morano KA, Scott SV, Klionsky DJ (November 1995). "Isolation and characterization of yeast mutants in the cytoplasm to vacuole protein targeting pathway". The Journal of Cell Biology. 131 (3): 591–602. doi:10.1083/jcb.131.3.591. PMC 2120622. PMID 7593182. উদ্ধৃতি ত্রুটি: <ref>ট্যাগ বৈধ নয়; আলাদা বিষয়বস্তুর সঙ্গে "klionsky 1995" নামটি একাধিক বার সংজ্ঞায়িত করা হয়েছে - ↑ ক খ "The Nobel Prize in Physiology or Medicine 2016"। The Nobel Foundation। ৩ অক্টোবর ২০১৬। সংগ্রহের তারিখ ৩ অক্টোবর ২০১৬।"The Nobel Prize in Physiology or Medicine 2016". The Nobel Foundation. 3 October 2016. Retrieved 3 October 2016. উদ্ধৃতি ত্রুটি:
<ref>ট্যাগ বৈধ নয়; আলাদা বিষয়বস্তুর সঙ্গে "nobelprize" নামটি একাধিক বার সংজ্ঞায়িত করা হয়েছে - ↑ Ashford TP, Porter KR (জানুয়ারি ১৯৬২)। "Cytoplasmic components in hepatic cell lysosomes": 198–202। ডিওআই:10.1083/jcb.12.1.198। পিএমআইডি 13862833। পিএমসি 2106008
 ।
।
- ↑ Hruban Z, Spargo B, Swift H, Wissler RW, Kleinfeld RG (জুন ১৯৬৩)। "Focal cytoplasmic degradation": 657–83। পিএমআইডি 13955261। পিএমসি 1949709
 ।
।
- ↑ Deter RL, Baudhuin P, De Duve C (নভেম্বর ১৯৬৭)। "Participation of lysosomes in cellular autophagy induced in rat liver by glucagon": C11–6। ডিওআই:10.1083/jcb.35.2.c11। পিএমআইডি 6055998। পিএমসি 2107130
 ।
।
- ↑ Deter RL, De Duve C (মে ১৯৬৭)। "Influence of glucagon, an inducer of cellular autophagy, on some physical properties of rat liver lysosomes": 437–49। ডিওআই:10.1083/jcb.33.2.437। পিএমআইডি 4292315। পিএমসি 2108350
 ।
।
- ↑ de Duve C (ডিসেম্বর ১৯৮৩)। "Lysosomes revisited": 391–7। ডিওআই:10.1111/j.1432-1033.1983.tb07841.x
 । পিএমআইডি 6319122।
। পিএমআইডি 6319122।
- ↑ Dunn WA, Schroder LA, Aris JP (২০১৩)। "Historical overview of autophagy"। Wang HG। Autophagy and Cancer। Springer। পৃষ্ঠা 3–4। আইএসবিএন 9781461465614।
- ↑ Harding TM, Hefner-Gravink A, Thumm M, Klionsky DJ (জুলাই ১৯৯৬)। "Genetic and phenotypic overlap between autophagy and the cytoplasm to vacuole protein targeting pathway": 17621–4। ডিওআই:10.1074/jbc.271.30.17621
 । পিএমআইডি 8663607।
। পিএমআইডি 8663607।
- ↑ Scott SV, Hefner-Gravink A, Morano KA, Noda T, Ohsumi Y, Klionsky DJ (অক্টোবর ১৯৯৬)। "Cytoplasm-to-vacuole targeting and autophagy employ the same machinery to deliver proteins to the yeast vacuole": 12304–8। ডিওআই:10.1073/pnas.93.22.12304
 । পিএমআইডি 8901576। পিএমসি 37986
। পিএমআইডি 8901576। পিএমসি 37986  ।
।
- ↑ Klionsky DJ, Cregg JM, Dunn WA, Emr SD, Sakai Y, Sandoval IV, Sibirny A, Subramani S, Thumm M, Veenhuis M, Ohsumi Y (অক্টোবর ২০০৩)। "A unified nomenclature for yeast autophagy-related genes": 539–45। ডিওআই:10.1016/s1534-5807(03)00296-x। পিএমআইডি 14536056।
|hdl-সংগ্রহ=এর|hdl=প্রয়োজন (সাহায্য) - ↑ Van Noorden R, Ledford H (অক্টোবর ২০১৬)। "Medicine Nobel for research on how cells 'eat themselves'": 18–19। ডিওআই:10.1038/nature.2016.20721
 । পিএমআইডি 27708326।
। পিএমআইডি 27708326।
- ↑ BÓZIO, Leonid. Autofagia: livro I Tempos Sombrios. Brasília: Amazon, 2018. আইএসবিএন ৯৭৮-৮৫-৯২৩৮৮২-১-৮
- ↑ ক খ Lee J, Giordano S, Zhang J (জানুয়ারি ২০১২)। "Autophagy, mitochondria and oxidative stress: cross-talk and redox signalling": 523–40। ডিওআই:10.1042/BJ20111451। পিএমআইডি 22187934। পিএমসি 3258656
 । উদ্ধৃতি ত্রুটি:
। উদ্ধৃতি ত্রুটি: <ref>ট্যাগ বৈধ নয়; আলাদা বিষয়বস্তুর সঙ্গে "Lee12" নামটি একাধিক বার সংজ্ঞায়িত করা হয়েছে - ↑ ক খ গ ঘ Mizushima N, Ohsumi Y, Yoshimori T (ডিসেম্বর ২০০২)। "Autophagosome formation in mammalian cells": 421–9। ডিওআই:10.1247/csf.27.421
 । পিএমআইডি 12576635। উদ্ধৃতি ত্রুটি:
। পিএমআইডি 12576635। উদ্ধৃতি ত্রুটি: <ref>ট্যাগ বৈধ নয়; আলাদা বিষয়বস্তুর সঙ্গে "Yoshimori2002" নামটি একাধিক বার সংজ্ঞায়িত করা হয়েছে - ↑ ক খ Youle RJ, Narendra DP (জানুয়ারি ২০১১)। "Mechanisms of mitophagy": 9–14। ডিওআই:10.1038/nrm3028। পিএমআইডি 21179058। পিএমসি 4780047
 । উদ্ধৃতি ত্রুটি:
। উদ্ধৃতি ত্রুটি: <ref>ট্যাগ বৈধ নয়; আলাদা বিষয়বস্তুর সঙ্গে "auto" নামটি একাধিক বার সংজ্ঞায়িত করা হয়েছে - ↑ Ding WX, Yin XM (জুলাই ২০১২)। "Mitophagy: mechanisms, pathophysiological roles, and analysis": 547–64। ডিওআই:10.1515/hsz-2012-0119। পিএমআইডি 22944659। পিএমসি 3630798
 ।
।
- ↑ ক খ Liu K, Czaja MJ (জানুয়ারি ২০১৩)। "Regulation of lipid stores and metabolism by lipophagy": 3–11। ডিওআই:10.1038/cdd.2012.63। পিএমআইডি 22595754। পিএমসি 3524634
 । উদ্ধৃতি ত্রুটি:
। উদ্ধৃতি ত্রুটি: <ref>ট্যাগ বৈধ নয়; আলাদা বিষয়বস্তুর সঙ্গে ":1" নামটি একাধিক বার সংজ্ঞায়িত করা হয়েছে - ↑ Till A, Lakhani R, Burnett SF, Subramani S (২০১২)। "Pexophagy: the selective degradation of peroxisomes": 512721। ডিওআই:10.1155/2012/512721
 । পিএমআইডি 22536249। পিএমসি 3320016
। পিএমআইডি 22536249। পিএমসি 3320016  ।
।
- ↑ Lei L (মার্চ ২০১৭)। "Chlorophagy: Preventing sunburn": 17026। ডিওআই:10.1038/nplants.2017.26
 । পিএমআইডি 28248315।
। পিএমআইডি 28248315।
- ↑ An H, Harper JW (ফেব্রুয়ারি ২০১৮)। "Systematic analysis of ribophagy in human cells reveals bystander flux during selective autophagy": 135–143। ডিওআই:10.1038/s41556-017-0007-x। পিএমআইডি 29230017। পিএমসি 5786475
 ।
।
- ↑ ক খ Levine B, Mizushima N, Virgin HW (জানুয়ারি ২০১১)। "Autophagy in immunity and inflammation": 323–35। ডিওআই:10.1038/nature09782। পিএমআইডি 21248839। পিএমসি 3131688
 । উদ্ধৃতি ত্রুটি:
। উদ্ধৃতি ত্রুটি: <ref>ট্যাগ বৈধ নয়; আলাদা বিষয়বস্তুর সঙ্গে "Levine11" নামটি একাধিক বার সংজ্ঞায়িত করা হয়েছে - ↑ ক খ Česen MH, Pegan K, Spes A, Turk B (জুলাই ২০১২)। "Lysosomal pathways to cell death and their therapeutic applications": 1245–51। ডিওআই:10.1016/j.yexcr.2012.03.005। পিএমআইডি 22465226।[অকার্যকর সংযোগ] উদ্ধৃতি ত্রুটি:
<ref>ট্যাগ বৈধ নয়; আলাদা বিষয়বস্তুর সঙ্গে "Pegan12" নামটি একাধিক বার সংজ্ঞায়িত করা হয়েছে - ↑ Avin-Wittenberg T, Honig A, Galili G (এপ্রিল ২০১২)। "Variations on a theme: plant autophagy in comparison to yeast and mammals": 285–99। ডিওআই:10.1007/s00709-011-0296-z। পিএমআইডি 21660427।
- ↑ ক খ Homma KS (২০১১)। "List of autophagy-related proteins and 3D structures"। ২০১২-০৮-০১ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২০১২-১০-০৮। উদ্ধৃতি ত্রুটি:
<ref>ট্যাগ বৈধ নয়; আলাদা বিষয়বস্তুর সঙ্গে "Homma2011" নামটি একাধিক বার সংজ্ঞায়িত করা হয়েছে - ↑ Castro-Obregon S (২০১০)। "The Discovery of Lysosomes and Autophagy": 49।
- ↑ Bandyopadhyay U, Kaushik S, Varticovski L, Cuervo AM (সেপ্টেম্বর ২০০৮)। "The chaperone-mediated autophagy receptor organizes in dynamic protein complexes at the lysosomal membrane": 5747–63। ডিওআই:10.1128/MCB.02070-07। পিএমআইডি 18644871। পিএমসি 2546938
 ।
।
- ↑ Ward C, Martinez-Lopez N, Otten EG, Carroll B, Maetzel D, Singh R, Sarkar S, Korolchuk VI (এপ্রিল ২০১৬)। "Autophagy, lipophagy and lysosomal lipid storage disorders": 269–84। ডিওআই:10.1016/j.bbalip.2016.01.006
 । পিএমআইডি 26778751।
। পিএমআইডি 26778751।
- ↑ Elander PH, Minina EA, Bozhkov PV (মার্চ ২০১৮)। "Autophagy in turnover of lipid stores: trans-kingdom comparison": 1301–1311। ডিওআই:10.1093/jxb/erx433
 । পিএমআইডি 29309625।
। পিএমআইডি 29309625।
- ↑ van Zutphen T, Todde V, de Boer R, Kreim M, Hofbauer HF, Wolinski H, Veenhuis M, van der Klei IJ, Kohlwein SD (জানুয়ারি ২০১৪)। "Lipid droplet autophagy in the yeast Saccharomyces cerevisiae": 290–301। ডিওআই:10.1091/mbc.E13-08-0448। পিএমআইডি 24258026। পিএমসি 3890349
 ।
।
- ↑ Singh R, Kaushik S, Wang Y, Xiang Y, Novak I, Komatsu M, Tanaka K, Cuervo AM, Czaja MJ (এপ্রিল ২০০৯)। "Autophagy regulates lipid metabolism": 1131–5। ডিওআই:10.1038/nature07976। পিএমআইডি 19339967। পিএমসি 2676208
 ।
।
- ↑ ক খ Sudhakar P, Jacomin AC, Hautefort I, Samavedam S, Fatemian K, Ari E, Gul L, Demeter A, Jones E, Korcsmaros T, Nezis IP (সেপ্টেম্বর ২০১৯)। "Targeted interplay between bacterial pathogens and host autophagy": 1620–1633। ডিওআই:10.1080/15548627.2019.1590519। পিএমআইডি 30909843। পিএমসি 6693458
 ।
। 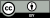 Text was copied from this source, which is available under a Creative Commons Attribution 4.0 International License. উদ্ধৃতি ত্রুটি:
Text was copied from this source, which is available under a Creative Commons Attribution 4.0 International License. উদ্ধৃতি ত্রুটি: <ref>ট্যাগ বৈধ নয়; আলাদা বিষয়বস্তুর সঙ্গে ":5" নামটি একাধিক বার সংজ্ঞায়িত করা হয়েছে - ↑ ক খ Klionsky DJ (সেপ্টেম্বর ২০১২)। "Look people, "Atg" is an abbreviation for "autophagy-related." That's it": 1281–2। ডিওআই:10.4161/auto.21812। পিএমআইডি 22889836। পিএমসি 3442874
 ।
।
- ↑ ক খ Lamb CA, Yoshimori T, Tooze SA (ডিসেম্বর ২০১৩)। "The autophagosome: origins unknown, biogenesis complex": 759–74। ডিওআই:10.1038/nrm3696। পিএমআইডি 24201109। উদ্ধৃতি ত্রুটি:
<ref>ট্যাগ বৈধ নয়; আলাদা বিষয়বস্তুর সঙ্গে "A. Lamb, T. Yoshimori 2013" নামটি একাধিক বার সংজ্ঞায়িত করা হয়েছে - ↑ Suzuki H, Osawa T, Fujioka Y, Noda NN (এপ্রিল ২০১৭)। "Structural biology of the core autophagy machinery": 10–17। ডিওআই:10.1016/j.sbi.2016.09.010
 । পিএমআইডি 27723509।
। পিএমআইডি 27723509।
- ↑ Russell RC, Yuan HX, Guan KL (জানুয়ারি ২০১৪)। "Autophagy regulation by nutrient signaling": 42–57। ডিওআই:10.1038/cr.2013.166। পিএমআইডি 24343578। পিএমসি 3879708
 ।
।
- ↑ Chan EY (সেপ্টেম্বর ২০১২)। "Regulation and function of uncoordinated-51 like kinase proteins": 775–85। ডিওআই:10.1089/ars.2011.4396। পিএমআইডি 22074133।
- ↑ Russell RC, Tian Y, Yuan H, Park HW, Chang YY, Kim J, Kim H, Neufeld TP, Dillin A, Guan KL (জুলাই ২০১৩)। "ULK1 induces autophagy by phosphorylating Beclin-1 and activating VPS34 lipid kinase": 741–50। ডিওআই:10.1038/ncb2757। পিএমআইডি 23685627। পিএমসি 3885611
 ।
।
- ↑ Itakura E, Kishi C, Inoue K, Mizushima N (ডিসেম্বর ২০০৮)। "Beclin 1 forms two distinct phosphatidylinositol 3-kinase complexes with mammalian Atg14 and UVRAG": 5360–72। ডিওআই:10.1091/mbc.E08-01-0080। পিএমআইডি 18843052। পিএমসি 2592660
 ।
।
- ↑ Kang R, Zeh HJ, Lotze MT, Tang D (এপ্রিল ২০১১)। "The Beclin 1 network regulates autophagy and apoptosis": 571–80। ডিওআই:10.1038/cdd.2010.191। পিএমআইডি 21311563। পিএমসি 3131912
 ।
।
- ↑ Di Bartolomeo S, Corazzari M, Nazio F, Oliverio S, Lisi G, Antonioli M, Pagliarini V, Matteoni S, Fuoco C, Giunta L, D'Amelio M, Nardacci R, Romagnoli A, Piacentini M, Cecconi F, Fimia GM (অক্টোবর ২০১০)। "The dynamic interaction of AMBRA1 with the dynein motor complex regulates mammalian autophagy": 155–68। ডিওআই:10.1083/jcb.201002100। পিএমআইডি 20921139। পিএমসি 2953445
 ।
।
- ↑ Hara T, Takamura A, Kishi C, Iemura S, Natsume T, Guan JL, Mizushima N (মে ২০০৮)। "FIP200, a ULK-interacting protein, is required for autophagosome formation in mammalian cells": 497–510। ডিওআই:10.1083/jcb.200712064। পিএমআইডি 18443221। পিএমসি 2364687
 ।
।
- ↑ T. Proikas-Cézanne, Z. Takacs, P. Donnes, and O. Kohlbacher, 'Wipi Proteins: Essential Ptdins3p Effectors at the Nascent Autophagosome', J Cell Sci, 128 (2015), 207-17
- ↑ ক খ Kumar, Suresh; Javed, Ruheena (নভেম্বর ২০২১)। "Mammalian hybrid pre-autophagosomal structure HyPAS generates autophagosomes" (ইংরেজি ভাষায়): 5950–5969.e22। ডিওআই:10.1016/j.cell.2021.10.017। পিএমআইডি 34741801
|pmid=এর মান পরীক্ষা করুন (সাহায্য)। পিএমসি 8616855
|pmc=এর মান পরীক্ষা করুন (সাহায্য)। - ↑ Dooley HC, Razi M, Polson HE, Girardin SE, Wilson MI, Tooze SA (জুলাই ২০১৪)। "WIPI2 links LC3 conjugation with PI3P, autophagosome formation, and pathogen clearance by recruiting Atg12-5-16L1": 238–52। ডিওআই:10.1016/j.molcel.2014.05.021। পিএমআইডি 24954904। পিএমসি 4104028
 ।
।
- ↑ Hanada T, Noda NN, Satomi Y, Ichimura Y, Fujioka Y, Takao T, Inagaki F, Ohsumi Y (ডিসেম্বর ২০০৭)। "The Atg12-Atg5 conjugate has a novel E3-like activity for protein lipidation in autophagy": 37298–302। ডিওআই:10.1074/jbc.C700195200
 । পিএমআইডি 17986448।
। পিএমআইডি 17986448।
- ↑ Kabeya Y, Mizushima N, Yamamoto A, Oshitani-Okamoto S, Ohsumi Y, Yoshimori T (জুন ২০০৪)। "LC3, GABARAP and GATE16 localize to autophagosomal membrane depending on form-II formation": 2805–12। ডিওআই:10.1242/jcs.01131
 । পিএমআইডি 15169837।
। পিএমআইডি 15169837।
- ↑ Fujita N, Hayashi-Nishino M, Fukumoto H, Omori H, Yamamoto A, Noda T, Yoshimori T (নভেম্বর ২০০৮)। "An Atg4B mutant hampers the lipidation of LC3 paralogues and causes defects in autophagosome closure": 4651–9। ডিওআই:10.1091/mbc.e08-03-0312। পিএমআইডি 18768752। পিএমসি 2575160
 ।
।
- ↑ Park S, Choi SG, Yoo SM, Son JH, Jung YK (২০১৪)। "Choline dehydrogenase interacts with SQSTM1/p62 to recruit LC3 and stimulate mitophagy": 1906–20। ডিওআই:10.4161/auto.32177। পিএমআইডি 25483962। পিএমসি 4502719
 ।
।
- ↑ Fader CM, Sánchez DG, Mestre MB, Colombo MI (ডিসেম্বর ২০০৯)। "TI-VAMP/VAMP7 and VAMP3/cellubrevin: two v-SNARE proteins involved in specific steps of the autophagy/multivesicular body pathways": 1901–16। ডিওআই:10.1016/j.bbamcr.2009.09.011
 । পিএমআইডি 19781582।
। পিএমআইডি 19781582।
- ↑ Furuta N, Fujita N, Noda T, Yoshimori T, Amano A (মার্চ ২০১০)। "Combinational soluble N-ethylmaleimide-sensitive factor attachment protein receptor proteins VAMP8 and Vti1b mediate fusion of antimicrobial and canonical autophagosomes with lysosomes": 1001–10। ডিওআই:10.1091/mbc.e09-08-0693। পিএমআইডি 20089838। পিএমসি 2836953
 ।
।
- ↑ Kim YM, Jung CH, Seo M, Kim EK, Park JM, Bae SS, Kim DH (জানুয়ারি ২০১৫)। "mTORC1 phosphorylates UVRAG to negatively regulate autophagosome and endosome maturation": 207–18। ডিওআই:10.1016/j.molcel.2014.11.013। পিএমআইডি 25533187। পিএমসি 4304967
 ।
।
- ↑ Satoo K, Noda NN, Kumeta H, Fujioka Y, Mizushima N, Ohsumi Y, Inagaki F (মে ২০০৯)। "The structure of Atg4B-LC3 complex reveals the mechanism of LC3 processing and delipidation during autophagy": 1341–50। ডিওআই:10.1038/emboj.2009.80। পিএমআইডি 19322194। পিএমসি 2683054
 ।
।
- ↑ Yang Z, Huang J, Geng J, Nair U, Klionsky DJ (ডিসেম্বর ২০০৬)। "Atg22 recycles amino acids to link the degradative and recycling functions of autophagy": 5094–104। ডিওআই:10.1091/mbc.e06-06-0479। পিএমআইডি 17021250। পিএমসি 1679675
 ।
।
- ↑ Reggiori F, Klionsky DJ (ফেব্রুয়ারি ২০০২)। "Autophagy in the eukaryotic cell": 11–21। ডিওআই:10.1128/EC.01.1.11-21.2002। পিএমআইডি 12455967। পিএমসি 118053
 ।
।
- ↑ Klionsky DJ, Emr SD (ডিসেম্বর ২০০০)। "Autophagy as a regulated pathway of cellular degradation": 1717–21। ডিওআই:10.1126/science.290.5497.1717। পিএমআইডি 11099404। পিএমসি 2732363
 ।
।
- ↑ Levine B, Klionsky DJ (এপ্রিল ২০০৪)। "Development by self-digestion: molecular mechanisms and biological functions of autophagy": 463–77। ডিওআই:10.1016/S1534-5807(04)00099-1
 । পিএমআইডি 15068787।
। পিএমআইডি 15068787।
- ↑ Kuma A, Hatano M, Matsui M, Yamamoto A, Nakaya H, Yoshimori T, Ohsumi Y, Tokuhisa T, Mizushima N (ডিসেম্বর ২০০৪)। "The role of autophagy during the early neonatal starvation period": 1032–6। ডিওআই:10.1038/nature03029। পিএমআইডি 15525940।
- ↑ ক খ Mizushima N, Yamamoto A, Matsui M, Yoshimori T, Ohsumi Y (মার্চ ২০০৪)। "In vivo analysis of autophagy in response to nutrient starvation using transgenic mice expressing a fluorescent autophagosome marker": 1101–11। ডিওআই:10.1091/mbc.E03-09-0704। পিএমআইডি 14699058। পিএমসি 363084
 ।
।
- ↑ ক খ Tsukada M, Ohsumi Y (অক্টোবর ১৯৯৩)। "Isolation and characterization of autophagy-defective mutants of Saccharomyces cerevisiae": 169–74। ডিওআই:10.1016/0014-5793(93)80398-E
 । পিএমআইডি 8224160।
। পিএমআইডি 8224160।
- ↑ Jackson WT, Giddings TH, Taylor MP, Mulinyawe S, Rabinovitch M, Kopito RR, Kirkegaard K (মে ২০০৫)। "Subversion of cellular autophagosomal machinery by RNA viruses": e156। ডিওআই:10.1371/journal.pbio.0030156। পিএমআইডি 15884975। পিএমসি 1084330
 ।
। 
- ↑ Thurston TL, Wandel MP, von Muhlinen N, Foeglein A, Randow F (জানুয়ারি ২০১২)। "Galectin 8 targets damaged vesicles for autophagy to defend cells against bacterial invasion": 414–8। ডিওআই:10.1038/nature10744। পিএমআইডি 22246324। পিএমসি 3343631
 ।
।
- ↑ Cuervo AM, Bergamini E, Brunk UT, Dröge W, Ffrench M, Terman A (২০০৫)। "Autophagy and aging: the importance of maintaining "clean" cells": 131–40। ডিওআই:10.4161/auto.1.3.2017
 । পিএমআইডি 16874025।
। পিএমআইডি 16874025।
- ↑ ক খ গ Tavassoly I (২০১৫)। Dynamics of Cell Fate Decision Mediated by the Interplay of Autophagy and Apoptosis in Cancer Cells। Springer Theses। Springer International Publishing। আইএসবিএন 978-3-319-14962-2। ডিওআই:10.1007/978-3-319-14962-2। উদ্ধৃতি ত্রুটি:
<ref>ট্যাগ বৈধ নয়; আলাদা বিষয়বস্তুর সঙ্গে "tavassoly" নামটি একাধিক বার সংজ্ঞায়িত করা হয়েছে - ↑ Tsujimoto Y, Shimizu S (নভেম্বর ২০০৫)। "Another way to die: autophagic programmed cell death": 1528–34। ডিওআই:10.1038/sj.cdd.4401777
 । পিএমআইডি 16247500।
। পিএমআইডি 16247500।
- ↑ Schwartz LM, Smith SW, Jones ME, Osborne BA (ফেব্রুয়ারি ১৯৯৩)। "Do all programmed cell deaths occur via apoptosis?": 980–4। ডিওআই:10.1073/pnas.90.3.980
 । পিএমআইডি 8430112। পিএমসি 45794
। পিএমআইডি 8430112। পিএমসি 45794  ।
।
- ↑ Datan E, Shirazian A, Benjamin S, Matassov D, Tinari A, Malorni W, Lockshin RA, Garcia-Sastre A, Zakeri Z (মার্চ ২০১৪)। "mTOR/p70S6K signaling distinguishes routine, maintenance-level autophagy from autophagic cell death during influenza A infection": 175–190। ডিওআই:10.1016/j.virol.2014.01.008। পিএমআইডি 24606695। পিএমসি 4005847
 ।
।
- ↑ Sanchez AM, Bernardi H, Py G, Candau RB (অক্টোবর ২০১৪)। "Autophagy is essential to support skeletal muscle plasticity in response to endurance exercise": R956–69। ডিওআই:10.1152/ajpregu.00187.2014। পিএমআইডি 25121614।
- ↑ ক খ Nair U, Klionsky DJ (ডিসেম্বর ২০১১)। "Activation of autophagy is required for muscle homeostasis during physical exercise": 1405–6। ডিওআই:10.4161/auto.7.12.18315। পিএমআইডি 22082869। পিএমসি 3288013
 । উদ্ধৃতি ত্রুটি:
। উদ্ধৃতি ত্রুটি: <ref>ট্যাগ বৈধ নয়; আলাদা বিষয়বস্তুর সঙ্গে "Klionsky2011" নামটি একাধিক বার সংজ্ঞায়িত করা হয়েছে - ↑ ক খ He C, Bassik MC, Moresi V, Sun K, Wei Y, Zou Z, An Z, Loh J, Fisher J, Sun Q, Korsmeyer S, Packer M, May HI, Hill JA, Virgin HW, Gilpin C, Xiao G, Bassel-Duby R, Scherer PE, Levine B (জানুয়ারি ২০১২)। "Exercise-induced BCL2-regulated autophagy is required for muscle glucose homeostasis": 511–5। ডিওআই:10.1038/nature10758। পিএমআইডি 22258505। পিএমসি 3518436
 । উদ্ধৃতি ত্রুটি:
। উদ্ধৃতি ত্রুটি: <ref>ট্যাগ বৈধ নয়; আলাদা বিষয়বস্তুর সঙ্গে "He2012" নামটি একাধিক বার সংজ্ঞায়িত করা হয়েছে - ↑ ক খ Grumati P, Coletto L, Schiavinato A, Castagnaro S, Bertaggia E, Sandri M, Bonaldo P (ডিসেম্বর ২০১১)। "Physical exercise stimulates autophagy in normal skeletal muscles but is detrimental for collagen VI-deficient muscles": 1415–23। ডিওআই:10.4161/auto.7.12.17877। পিএমআইডি 22024752। পিএমসি 3288016
 ।
।
- ↑ ক খ Arndt V, Dick N, Tawo R, Dreiseidler M, Wenzel D, Hesse M, Fürst DO, Saftig P, Saint R, Fleischmann BK, Hoch M, Höhfeld J (জানুয়ারি ২০১০)। "Chaperone-assisted selective autophagy is essential for muscle maintenance": 143–8। ডিওআই:10.1016/j.cub.2009.11.022
 । পিএমআইডি 20060297।
। পিএমআইডি 20060297।
- ↑ Ulbricht A, Eppler FJ, Tapia VE, van der Ven PF, Hampe N, Hersch N, Vakeel P, Stadel D, Haas A, Saftig P, Behrends C, Fürst DO, Volkmer R, Hoffmann B, Kolanus W, Höhfeld J (মার্চ ২০১৩)। "Cellular mechanotransduction relies on tension-induced and chaperone-assisted autophagy": 430–5। ডিওআই:10.1016/j.cub.2013.01.064
 । পিএমআইডি 23434281।
। পিএমআইডি 23434281।
- ↑ Caramés B, Taniguchi N, Otsuki S, Blanco FJ, Lotz M (মার্চ ২০১০)। "Autophagy is a protective mechanism in normal cartilage, and its aging-related loss is linked with cell death and osteoarthritis": 791–801। ডিওআই:10.1002/art.27305। পিএমআইডি 20187128। পিএমসি 2838960
 ।
।
- ↑ Caramés B, Taniguchi N, Seino D, Blanco FJ, D'Lima D, Lotz M (এপ্রিল ২০১২)। "Mechanical injury suppresses autophagy regulators and pharmacologic activation of autophagy results in chondroprotection": 1182–92। ডিওআই:10.1002/art.33444। পিএমআইডি 22034068। পিএমসি 3288456
 ।
।
- ↑ Caramés B, Olmer M, Kiosses WB, Lotz MK (জুন ২০১৫)। "The relationship of autophagy defects to cartilage damage during joint aging in a mouse model": 1568–76। ডিওআই:10.1002/art.39073। পিএমআইডি 25708836। পিএমসি 4446178
 ।
।
- ↑ ক খ Furuya, N., Liang, X.H., and Levin, B. 2004. Autophagy and cancer. In Autophagy. D.J. Klionsky editor. Landes Bioscience. Georgetown, Texas, USA. 244-253.
- ↑ Vlahopoulos S, Critselis E, Voutsas IF, Perez SA, Moschovi M, Baxevanis CN, Chrousos GP (২০১৪)। "New use for old drugs? Prospective targets of chloroquines in cancer therapy": 843–51। ডিওআই:10.2174/1389450115666140714121514। পিএমআইডি 25023646।
- ↑ Qu X, Yu J, Bhagat G, Furuya N, Hibshoosh H, Troxel A, Rosen J, Eskelinen EL, Mizushima N, Ohsumi Y, Cattoretti G, Levine B (ডিসেম্বর ২০০৩)। "Promotion of tumorigenesis by heterozygous disruption of the beclin 1 autophagy gene": 1809–20। ডিওআই:10.1172/JCI20039। পিএমআইডি 14638851। পিএমসি 297002
 ।
।
- ↑ Liang XH, Jackson S, Seaman M, Brown K, Kempkes B, Hibshoosh H, Levine B (ডিসেম্বর ১৯৯৯)। "Induction of autophagy and inhibition of tumorigenesis by beclin 1": 672–6। ডিওআই:10.1038/45257। পিএমআইডি 10604474।
- ↑ Duran A, Linares JF, Galvez AS, Wikenheiser K, Flores JM, Diaz-Meco MT, Moscat J (এপ্রিল ২০০৮)। "The signaling adaptor p62 is an important NF-kappaB mediator in tumorigenesis": 343–54। ডিওআই:10.1016/j.ccr.2008.02.001
 । পিএমআইডি 18394557।
। পিএমআইডি 18394557।
- ↑ ক খ গ Paglin S, Hollister T, Delohery T, Hackett N, McMahill M, Sphicas E, Domingo D, Yahalom J (জানুয়ারি ২০০১)। "A novel response of cancer cells to radiation involves autophagy and formation of acidic vesicles": 439–44। পিএমআইডি 11212227। উদ্ধৃতি ত্রুটি:
<ref>ট্যাগ বৈধ নয়; আলাদা বিষয়বস্তুর সঙ্গে "Paglin" নামটি একাধিক বার সংজ্ঞায়িত করা হয়েছে - ↑ Dökümcü K, Simonian M, Farahani RM (অক্টোবর ২০১৮)। "miR4673 improves fitness profile of neoplastic cells by induction of autophagy": 1068। ডিওআই:10.1038/s41419-018-1088-6। পিএমআইডি 30341280। পিএমসি 6195512
 ।
।
- ↑ ক খ গ Jin S, White E (২০০৭)। "Role of autophagy in cancer: management of metabolic stress": 28–31। ডিওআই:10.4161/auto.3269। পিএমআইডি 16969128। পিএমসি 2770734
 । উদ্ধৃতি ত্রুটি:
। উদ্ধৃতি ত্রুটি: <ref>ট্যাগ বৈধ নয়; আলাদা বিষয়বস্তুর সঙ্গে "Jin" নামটি একাধিক বার সংজ্ঞায়িত করা হয়েছে - ↑ ক খ গ Yang ZJ, Chee CE, Huang S, Sinicrope FA (সেপ্টেম্বর ২০১১)। "The role of autophagy in cancer: therapeutic implications": 1533–41। ডিওআই:10.1158/1535-7163.MCT-11-0047। পিএমআইডি 21878654। পিএমসি 3170456
 । উদ্ধৃতি ত্রুটি:
। উদ্ধৃতি ত্রুটি: <ref>ট্যাগ বৈধ নয়; আলাদা বিষয়বস্তুর সঙ্গে "Yang" নামটি একাধিক বার সংজ্ঞায়িত করা হয়েছে - ↑ ক খ গ Tavassoly I, Parmar J, Shajahan-Haq AN, Clarke R, Baumann WT, Tyson JJ (এপ্রিল ২০১৫)। "Dynamic Modeling of the Interaction Between Autophagy and Apoptosis in Mammalian Cells": 263–72। ডিওআই:10.1002/psp4.29। পিএমআইডি 26225250। পিএমসি 4429580
 । উদ্ধৃতি ত্রুটি:
। উদ্ধৃতি ত্রুটি: <ref>ট্যাগ বৈধ নয়; আলাদা বিষয়বস্তুর সঙ্গে ":0" নামটি একাধিক বার সংজ্ঞায়িত করা হয়েছে - ↑ Razaghi A, Heimann K, Schaeffer PM, Gibson SB (ফেব্রুয়ারি ২০১৮)। "Negative regulators of cell death pathways in cancer: perspective on biomarkers and targeted therapies": 93–112। ডিওআই:10.1007/s10495-018-1440-4। পিএমআইডি 29322476।
- ↑ Cadwell K (নভেম্বর ২০১৬)। "Crosstalk between autophagy and inflammatory signalling pathways: balancing defence and homeostasis": 661–675। ডিওআই:10.1038/nri.2016.100। পিএমআইডি 27694913। পিএমসি 5343289
 ।
।
- ↑ Medzhitov R (জুলাই ২০০৮)। "Origin and physiological roles of inflammation": 428–35। ডিওআই:10.1038/nature07201। পিএমআইডি 18650913।
- ↑ Tan P, Ye Y, Mao J, He L (২০১৯)। "Autophagy and Immune-Related Diseases"। Autophagy Regulation of Innate Immunity। Advances in Experimental Medicine and Biology। পৃষ্ঠা 167–179। আইএসবিএন 978-981-15-0605-5। ডিওআই:10.1007/978-981-15-0606-2_10। পিএমআইডি 31728870।
- ↑ Varisli L, Cen O, Vlahopoulos S (মার্চ ২০২০)। "Dissecting pharmacological effects of chloroquine in cancer treatment: interference with inflammatory signaling pathways": 257–278। ডিওআই:10.1111/imm.13160। পিএমআইডি 31782148। পিএমসি 7011648

|pmc=এর মান পরীক্ষা করুন (সাহায্য)। - ↑ Valente EM, Abou-Sleiman PM, Caputo V, Muqit MM, Harvey K, Gispert S, Ali Z, Del Turco D, Bentivoglio AR, Healy DG, Albanese A, Nussbaum R, González-Maldonado R, Deller T, Salvi S, Cortelli P, Gilks WP, Latchman DS, Harvey RJ, Dallapiccola B, Auburger G, Wood NW (মে ২০০৪)। "Hereditary early-onset Parkinson's disease caused by mutations in PINK1": 1158–60। ডিওআই:10.1126/science.1096284। পিএমআইডি 15087508।
- ↑ Kitada T, Asakawa S, Hattori N, Matsumine H, Yamamura Y, Minoshima S, Yokochi M, Mizuno Y, Shimizu N (এপ্রিল ১৯৯৮)। "Mutations in the parkin gene cause autosomal recessive juvenile parkinsonism": 605–8। ডিওআই:10.1038/33416। পিএমআইডি 9560156।
- ↑ Esteves AR, Arduíno DM, Silva DF, Oliveira CR, Cardoso SM (জানুয়ারি ২০১১)। "Mitochondrial Dysfunction: The Road to Alpha-Synuclein Oligomerization in PD": 693761। ডিওআই:10.4061/2011/693761। পিএমআইডি 21318163। পিএমসি 3026982
 ।
।
- ↑ Moosavi MA, Haghi A, Rahmati M, Taniguchi H, Mocan A, Echeverría J, Gupta VK, Tzvetkov NT, Atanasov AG (২০১৮)। "Phytochemicals as potent modulators of autophagy for cancer therapy": 46–69। ডিওআই:10.1016/j.canlet.2018.02.030। পিএমআইডি 29474859।
