আদর্শ পারমাণবিক ভর
একটি মৌলের আদর্শ বা প্রমিত পারমাণবিক ভর (Ar°(E) দ্বারা চিহ্নিত করা হয় ) হলো পৃথিবীতে প্রাপ্ত ওই মৌলের আইসোটোপগুলোর আপেক্ষিক আইসোটোপিক ভরের ভরভিত্তিক গড়। এই গড় নির্ণয়ে মৌলের প্রতিটি আইসোটোপের পৃথিবীতে প্রাপ্ত আধিক্যকে বিবেচনায় নেওয়া হয়।
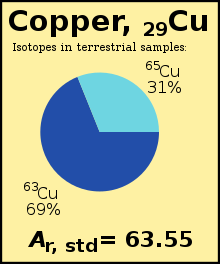
উদাহরণস্বরূপ, আইসোটোপ ৬৩Cu (Ar = ৬২.৯২৯) পৃথিবীর তামার ৬৯% অংশ গঠন করে, বাকিটা হলো ৬৫Cu (Ar = ৬৪.৯২৭), তাই
আপেক্ষিক আইসোটোপিক ভর যেহেতু একটি মাত্রাহীন রাশি, এই ভরভিত্তিক গড়টিও মাত্রাহীন হয়। একে ডালটন বা পারমাণবিক ভর ধ্রুবক দ্বারা গুণ করলে ভরের মাত্রা সম্পন্ন একটি রাশিতে রুপান্তরিত হয়।
বিজ্ঞানীরা মূলত আণবিক ভর (Ar বা আপেক্ষিক আণবিক ভর) নির্ণয়ে বিভিন্ন ধরনের পারমাণবিক ভর ব্যবহার করে থাকেন। এরমধ্যে প্রমিত পারমাণবিক ভর (Ar°) সবচেয়ে প্রচলিত ও কার্যকরী। "International Union of Pure and Applied Chemistry" (IUPAC) এর "Commission on Isotopic Abundances and Atomic Weights" (CIAAW) প্রতিটি মৌলের প্রমিত পারমাণবিক ভর প্রাকৃতিক, স্থিতিশীল এবং ভূ-পৃষ্ঠ থেকে প্রাপ্ত নমুনা পর্যবেক্ষণ করে নির্ণয় ও প্রকাশ করে থাকে। এই সংজ্ঞায় পৃথিবীর বিভিন্ন স্থান থেকে প্রতিনিধিত্বমূলক নমুনা ব্যবহারের কথা বলা হয়। এর ফলে ব্যাপকভাবে এই মানটিকেই "সেই" পারমাণবিক ভর হিসেবে ব্যবহার করা যায়। যেমন, ওষুধ তৈরি এবং বৈজ্ঞানিক গবেষণায় এই মান ব্যবহৃত হয়। কোন মৌলের অ-প্রমিত পারমাণবিক ভর নির্দিষ্ট উৎস বা নমুনার উপর নির্ভরশীল, যেমন কোন পুরাকীর্তি থেকে পাওয়া হাড়ের কার্বনের পারমাণবিক ভর। প্রমিত পারমাণবিক ভর পৃথিবীর নানা জায়গার র্যান্ডম নমুনা থেকে পাওয়া পারমাণবিক ভরগুলোর গড় করে, যাতে একজন রসায়নবিদ এমন মান পান যা পৃথিবীর বিভিন্ন র্যান্ডম নমুনায় পাওয়া যাবে বলে আশা করা যায়। এই গড়ের একটি ব্যাপ্তি থাকে, এবং তা কিছু প্রমিত পারমাণবিক ভরে ব্যবধান স্বরূপ প্রকাশ করা হয়।
মোট ১১৮টি আবিষ্কৃত রাসায়নিক মৌলের মধ্যে ৮০টির স্থিতিশীল আইসোটোপ রয়েছে এবং ৮৪টির পৃথিবী-ভিত্তিক এই নির্ধারিত মান আছে। সাধারণত, এই মানটি যেমন হিলিয়ামের ক্ষেত্রে: Ar°(He) = 4.002602(2)। "(2)" দেখিয়ে শেষ অঙ্কের অনিশ্চয়তাকে বোঝানো হচ্ছে, যা পড়তে হবে ৪.০০২৬০২±০.০০০০০২। IUPAC পাশাপাশি পাঁচটি তাৎপর্যপূর্ণ অঙ্কে পূর্ণ করে সংক্ষিপ্ত মানও প্রকাশ করে। হিলিয়ামের জন্য, Ar, abridged°(He) =4.0026.
চৌদ্দটি মৌলের ক্ষেত্রে এই মানে তারতম্য থাকে, কারণ তাদের নমুনার উৎসের ক্ষয়ের ইতিহাস ভিন্ন। যেমন, পাললিক শিলায় প্রাপ্ত থ্যালিয়াম (Tl) আগ্নেয় শিলা বা আগ্নেয়গিরির গ্যাসে প্রাপ্ত থ্যালিয়ামের চেয়ে ভিন্ন আইসোটোপিক বিন্যাস রাখে। এই মৌলগুলোর ক্ষেত্রে প্রমিত পারমাণবিক ভর একটি ব্যবধান হিসেবে উল্লেখ করা হয়: Ar°(Tl) = [204.38, 204.39]। কম নির্ভুলতার ক্ষেত্রে IUPAC এই ব্যবধানের মৌলগুলোর জন্য একটি প্রচলিত মানও প্রকাশ করে। থ্যালিয়ামের জন্য Ar, conventional°(Tl) = ২০৪.৩৮.
- ↑ মেইজা, জুরিস; ও অন্যান্য (২০১৬)। "Atomic weights of the elements 2013 (IUPAC Technical Report)" [মৌলের পারমাণবিক ওজন ২০১৩ (আইইউপিএসি প্রযুক্তিগত প্রতিবেদন)]। পিওর অ্যান্ড অ্যাপ্লায়েড কেমিস্ট্রি (ইংরেজি ভাষায়)। ৮৮ (৩): ২৬৫–৯১। ডিওআই:10.1515/pac-2015-0305
 ।
।

