খসড়া:ইলেকট্রন পরিবহন শিকল
ইলেকট্রন পরিবহন শিকল (ETC[১]) হলো ধারাবাহিকভাবে সজ্জিত প্রোটিন কমপ্লেক্স ও অন্যান্য অণু যারা জারণ-বিজারণ বিক্রিয়ার মাধ্যমে দাতা থেকে গ্রহীতায় ইলেকট্রন স্থানান্তর করে। এরই সাথে কোনো জৈবিক ঝিল্লির মধ্য দিয়ে প্রোটন (H+ আয়ন) স্থানান্তরিত করে। ইলেকট্রন পরিবহন শিকলে ঝিল্লির সাথে বিভিন্ন এনজাইম উপস্থিত রয়েছে।
ইলেকট্রন পরিবহন শিকলের মধ্য দিয়ে ইলেকট্রনের প্রবাহ একটি শক্তি উৎপাদনকারী প্রক্রিয়া। জারণ-বিজারণ বিক্রিয়া থেকে প্রাপ্ত শক্তি ইলেকট্রোকেমিক্যাল প্রোটন গ্রেডিয়েন্ট তৈরি করে যা থেকে অ্যাডিনোসিন ট্রাইফসফেট উৎপম্ন হয়। সবাত শ্বসনে ইলেকট্রন প্রবাহ আণবিক অক্সিজেনের ইলেকট্রন গ্রহণের মাধ্যমে শেষ হয়। অবাত শ্বসনে অন্যান্য ইলেকট্রন গ্রহীতা ব্যবহৃত হয়, যেমন সালফেট।
ইলেকট্রন পরিবহন শিকলে বিক্রিয়ক ও উৎপাদের গিবস মুক্ত শক্তির পার্থক্য দ্বারা জারণ-বিজারণ বিক্রিয়া চালিত হয়। মুক্ত শক্তি পাওয়া যায় যখন উচ্চ-শক্তির ইলেকট্রন দাতা ও গ্রহীতা নিম্নশক্তির উৎপাদে পরিণত হয়, যেখানে ইলেকট্রন নিম্ন থেকে উচ্চ জারণ-বিজারণ পটেনশিয়ালে স্থানান্তরিত হয়, এবং আয়নের ইলেকট্রোকেমিক্যাল গ্রেডিয়েন্ট সৃষ্টিতে ইলেকট্রন পরিবহন শিকলের কমপ্লেক্স দ্বারা ব্যবহৃত হয়। এই ইলেকট্রোকেমিক্যাল গ্রেডিয়েন্ট অক্সিডেটিভ ফসফোরাইলেশনের সাথে যুগপৎভাবে ATP সংশ্লেষণ প্রক্রিয়া চালিত করে।[২]
সুকেন্দ্রিক জীবে, ইলেকট্রন পরিবহন শিকল ও অক্সিডেটিভ ফসফোরাইলেশনের স্থান মাইটোকন্ড্রিয়নের অন্তস্থ ঝিল্লিতে পাওয়া যায়। অক্সিজেন এবং সাইটোক্রোম ও (পরোক্ষভাবে) NADH and FADH2 এর মতো বিজারিত যৌগের বিক্রিয়ায় মুক্ত শক্তি প্রোটনকে আন্তঃঝিল্লি ফাঁকে পাম্প করে অন্তস্থ ঝিল্লি জুড়ে ইলেকট্রোকেমিক্যাল গ্রেডিয়েন্ট তৈরির জন্য জন্য ইলেকট্রন পরিবহন শিকল ব্যবহার করে। সালোকসংশ্লেষী প্রকৃতকোষী জীবে ইলেকট্রন পরিবহন শিকল থাইলাকয়েড ঝিল্লিতে পাওয়া যায়। এখানে আলোক শক্তি প্রোটন পাম্পের মাধ্যমে ইলেকট্রন পরিবহন চালিত করে এবং প্রাপ্ত প্রোটন গ্রেডিয়েন্টের ফলে ATP উৎপাদিত হয়। ব্যাকটেরিয়ায় ইলেকট্রন পরিবহন শিকল প্রজাতিভেদে ভিন্ন হতে পারে কিন্তু সবসময়ই জারণ-বিজারণ বিক্রিয়া সংঘটিত হয় যা ATP সিন্থেজের মাধ্যমে ইলেকট্রোকেমিক্যাল গ্রেডিয়েন্ট ও অক্সিডেটিভ ফসফোরাইলেশনের সাথে যুক্ত হয়ে ATP উৎপাদন করে।[৩]
মাইটোকন্ড্রীয় ইলেকট্রন পরিবহন শিকল[সম্পাদনা]

অধিকাংশ সুকেন্দ্রিক কোষে মাইটোকন্ড্রিয়া আছে, যা অক্সিজেন এবং সাইট্রিক অ্যাসিড চক্র, ফ্যাটি অ্যাসিড বিপাক ও অ্যামিনো অ্যাসিড বিপাকের উৎপাদসমূহের সাথে বিক্রিয়ায় ATP from উৎপাদন করে। মাইটোকন্ড্রিয়ার ভেতরের ঝিল্লিতে NADH ও FADH2 এর ইলেকট্রন ইলেকট্রন পরিবহন শিকলের মাধ্যমে অক্সিজেনে প্রবাহিত হয় এবং শক্তি সরবরাহ করে পানিতে রূপান্তরিত হয়।[৪] ইলেকট্রন পরিবহন শিকলে ইলেকট্রন দাতা ও গ্রহীতার উৎসেচকীয় ধারা রয়েছে। প্রতি ইলেকট্রন দাতা উচ্চ জারণ-বিজারণ পটেনশিয়ালযুক্ত গ্রহীতাকে ইলেকট্রন দান করবে, যা পরে অন্য গ্রহীতাকে ইলেকট্রন দেবে। এই প্রক্রিয়া ততক্ষণ চলে যতক্ষণ না ইলেকট্রন সর্বশেষ গ্রহীতা অক্সিজ৩ন৩ পৌঁছায়। প্রতি বিক্রিয়ায় শক্তি উৎপাদিত হয় কারণ উচ্চশক্তির দাতা ও গ্রহীতা নিম্নশক্তির উৎপাদে পরিণত হয়। এই স্থানান্তরিত ইলেকট্রনের মাধ্যমে প্রাপ্ত শক্তি মাইটোকন্ড্রীয় ঝিল্লি জুড়ে আন্তঃঝিল্লি ফাঁকে প্রোটন পাম্পের দ্বারা প্রোটন গ্রেডিয়েন্ট তৈরিতে ব্যবহৃত হয়। এতে অধিক পরিমাণে শক্তি উৎপাদিত হয় যার কাজ করার যোগ্যতা রয়েছে। সম্পূর্ণ প্রক্রিয়াটিকে অক্সিডেটিভ ফসফোরাইলেশন বলে কেননা প্রাপ্ত ইলেকট্রোকেমিক্যাল গ্রেডিয়েন্ট ব্যবহার করে ADP-র ফসফোরাইলেশন ঘটে ও ATP তে পরিণত হয়।
মাইটোকন্ড্রীয় জারণ-বিজারণ বাহক[সম্পাদনা]
ইলেকট্রনের স্থানান্তরে প্রাপ্ত শক্তি মাইটোকন্ড্রীয় মাতৃকা থেকে আন্তঃঝিল্লি ফাঁকে প্রোটন পাম্প করতে ব্যবহৃত হয় এবং আন্তঃঝিল্লি ফাঁক জুড়ে ইলেকট্রোকেমিক্যাল প্রোটন গ্রেডিয়েন্ট (ΔpH) তৈরি হয়। এই প্রোটন গ্রেডিয়েন্ট মাইটোকন্ড্রীয় ঝিল্লি পোটেনশিয়ালের (ΔΨM) জন্য এককভাবে না হলেও বড় অংশে দায়ী।[৫] এর মাধ্যমে ATP সিন্থেজ H+ প্রবাহ ব্যবহার করে অ্যাডিনোসিন ডাইফসফেট ও অজৈব ফসফেট থেকে ATP প্রস্তুত করে। কমপ্লেক্স I (NADH কোএনজাইম কিউ রেডাকটেজ; I দ্বারা চিহ্নিত) ক্রেবস চক্রের ইলেকট্রন বাহক নিকোটিনামাইড অ্যাডেনিন ডাইনিউক্লিয়োটাইড (NADH) থেকে ইলেকট্রন গ্রহণ করে কোএনজাইম কিউ (ইউবিকুইনোন; কিউ দ্বারা চিহ্নিত) এ সরবরাহ করে, যা কমপ্লেক্স II (সাকসিনেট ডিহাইড্রোজিনেজ; II দ্বারা চিহ্নিত) থেকেও ইলেকট্রন গ্রহণ করে। কিউ কমপ্লেক্স III (সাইটোক্রোম bc1 কমপ্লেক্স; III দ্বারা চিহ্নিত) তে ইলেকট্রন পাঠিয়ে দেয়, যা ইলেকট্রন সাইটোক্রোম সি (cyt c) তে সরবরাহ করে। Cyt c কমপ্লেক্স IV এ (সাইটোক্রোম সি অক্সিডেজ; IV দ্বারা চিহ্নিত) সরবরাহ করে।
চআরটি ঝিল্লিবদ্ধ কমপ্লেক্স মাইটোকন্ড্রিয়ায় চিহ্নিত করা গেছে। প্রতিটি অনেক জটিল ট্রান্স-ঝিল্লি গঠন যা অন্তস্থ ঝিল্লির সাথে যুক্ত। এগুলোর তিনটি প্রোটন পাম্প। গঠনসমূহ লিপিডে ও পানিতে দ্রবণীয় ইলেকট্রন বাহক দ্বারা বৈদ্যুতিকভাবে যুক্ত। সমগ্র ইলেকট্রন পরিবহন শিকলকে নিম্নোক্তভাবে লেখা যায়:
NADH, H+ → কমপ্লেক্স I → কিউ → কমপ্লেক্স III → সাইটোক্রোম সি → কমপ্লেক্স IV → H2O
↑
কমপ্লেক্স II
↑
সাকসিনেট
কমপ্লেক্স I[সম্পাদনা]
এখানে (NADH ইউবিকুইনোন অক্সিডোরেডাকটেজ, টাইও I NADH ডিহাইড্রোজিনেজ, বা মাইটোকন্ড্রীয় কমপ্লেক্স I; ইসি 1.6.5.3), দুটি ইলেকট্রন NADH সরে গিয়ে লিপিডে দ্রবণীয় বাহক ইউবিকুইনোনে স্থানান্তরিত হয়। বিজারিত উৎপাদ ইউবিকুইনোল (QH2), ঝিল্লির মধ্য দিয়ে মুক্তভাবে ব্যাপিত হয় এবং কমপ্লেক্স I ঝিল্লি জুড়ে চারটি প্রোটন (H+) স্থানান্তরিত করে এবং প্রোটন গ্রেডিয়েন্ট তৈরি করে। কমপ্লেক্স I একটি অন্যতম প্রধান স্থান যেটিতে অক্সিজেনে অকালীন ইলেকট্রন লিকেজ ঘটে। এভাবে এ স্থানটি সুপারঅক্সাইড তৈরির একটি প্রধান স্থান হয়ে ওঠে।[৬]
ইলেকট্রনের গতিপথ নিম্নরূপ:
NADH NAD+ তে জারিত হয়, ফ্ল্যাভিন মনোনিউক্লিয়োটাইডকে FMNH2 এ একটি দুই-ইলেকট্রন ধাপের মাধ্যমে বিজারিত করার মাধ্যমে। তারপর FMNH2 দুটি এক-ইলেকট্রন ধাপে সেমিকুইনোন নামের মধ্যবর্তী উৎপাদের মাধ্যমে জারিত হয়। প্রতিটি ইলেকট্রন এভাবে FMNH2 থেকে Fe–S ক্লাস্টারে স্থানান্তরিত হয়, এবং সেখান থেকে ইউবিকুইনোনে (Q)। প্রথম ইলেকট্রন স্থানান্তর সেমিকুইনোন মুক্ত মূলক তৈরি করে এবং দ্বিতীয় ইলেকট্রনের স্থানান্তর সেমিকুইনোনকে ইউবিকুইনোল QH2 এ বিজারিত করে। এই প্রক্রিয়ায় চারটি প্রোটন মাইটোকন্ড্রীয় মাতৃকা থেকে আন্তঃঝিল্লি ফাঁকে স্থানান্তরিত হয়।[৭] ইলেকট্রন কমপ্লেক্সের মধ্য দিয়ে যাওয়ার সময় কমপ্লেক্সের ১৮০ অ্যাংস্ট্রম প্রস্থের স্থান জুড়ে ঝিল্লির মধ্যে ইলেকট্রন প্রবাহ তৈরি হয়। এই প্রবাহ আন্তঃঝিল্লি ফাঁকে প্রতি NADH এর দুটি ইলেকট্রনের জন্য চারটি প্রোটনের সক্রিয় স্থানান্তরে শক্তি যোগায়।[৮]
কমপ্লেক্স II[সম্পাদনা]
কমপ্লেক্স II এ (সাকসিনেট ডিহাইড্রোজিনেজ অথবা সাকসিনেট-কোকিউ রেডাকটেজ; ইসি 1.3.5.1) অতিরিক্ত ইলেকট্রন কুইনোন পুল (Q) এ দেওয়া হয় যার উৎপত্তি সাকসিনেটে এবং FAD এর মাধ্যমে Q এ স্থানান্তরিত করা হয়। কমপ্লেক্স II এ চারটি প্রোটিন উপ-একক আছে: সাকসিনেট ডিহাইড্রোজিনেজ (SDHA), সাকসিনেট ডিহাইড্রোজিনেজ [ইউবিকুইনোন] আয়রন-সালফার মাইটোকন্ড্রীয় উপ-একক (SDHB), সাকসিনেট ডিহাইড্রোজিনেজ কমপ্লেক্স উপ-একক C (SDHC) এবং সাকসিনেট ডিহাইড্রোজিনেজ কমপ্লেক্স উপ-একক D (SDHD). অন্যান্য ইলেকট্রন দাতাও (যেমন, ফ্যাটি অ্যাসিড ও গ্লিসারল ৩-ফসফেট) Q এ ইলেকট্রন দান করে (FAD এর মাধ্যমে)। কমপ্লেক্স II ইলেকট্রন স্থানান্তরে কমপ্লেক্স I এর সমান্তরাল গতিপথ, কিন্তু কমপ্লেক্স I এর মতো কোনো প্রোটন আন্তঃঝিল্লি ফাঁকে যায় না। একারণে এ গতিপথে কম শক্তি উৎপন্ন হয়।
কমপ্লেক্স III[সম্পাদনা]
কমপ্লেক্স III এ সাইটোক্রোম বিসি1 কমপ্লেক্স বা CoQH2-সাইটোক্রোম সি রেডাকটেজ; ইসি 1.10.2.2), কিউ চক্র অপ্রতিসম প্রোটন শোষণ বা ত্যাগের মাধ্যমে প্রোটন গ্রেডিয়েন্টে ভূমিকা রাখে। QO স্থানে দুটি ইলেকট্রন QH2 থেকে সরিয়ে ফেলা হয় যা সাইটোক্রোম সি এর দুটি অণুতে স্থানান্তর করা হয়। একটি পানিতে দ্রবণীয় ইলেকট্রন বাহক আন্তঃঝিল্লি ফাঁকে লক্ষ করা যায়। অন্য দুটি ইলেকট্রন ক্রমান্বয়ে প্রোটিন পেরিয়ে Qi স্থানে পৌঁছায় যেখানে ইউবিকুইনোনের কুইনোন অংশটি কুইনোলে পরিণত হয়। একটি প্রোটন গ্রেডিয়েন্ট তৈরি হয় এক অণু কুইনোলের () Qo স্থানে জারণের দ্বারা, এক অণু কুইনোন () Qi স্থানে তৈরি করার জন্য। (সর্বমোট চারটি প্রোটন স্থানান্তরিত হয়: দুটি প্রোটন কুইনোনকে বিজারিত করে কুইনোলে পরিণত করে এবং ইউবিকুইনোল অণু থেকে দুটি প্রোটন মুক্ত হয়।)
যখন ইলেকট্রন স্থানান্তর কমে যায় (হাই মেমব্রেন পটেনশিয়াল বা শ্বসনিক বাধাদানকারী যেমন অ্যান্টিমাইসিন এ এর দ্বারা), কমপ্লেক্স III আণবিক অক্সিজেনে ইলেকট্রন লিক করতে পারে, যা সুপারঅক্সাইড গঠন করে।
এই কমপ্লেক্স ডাইমারকার্পল (British Antilewisite, BAL), ন্যাপথোকুইনোন ও অ্যান্টিমাইসিন দ্বারা বাধাগ্রস্ত হয়।
Complex IV[সম্পাদনা]
In Complex IV (cytochrome c oxidase; ইসি 1.9.3.1), sometimes called cytochrome AA3, four electrons are removed from four molecules of cytochrome c and transferred to molecular oxygen (O2) and four protons, producing two molecules of water. The complex contains coordinated copper ions and several heme groups. At the same time, eight protons are removed from the mitochondrial matrix (although only four are translocated across the membrane), contributing to the proton gradient. The exact details of proton pumping in Complex IV are still under study.[৯] Cyanide is an inhibitor of Complex IV.
Coupling with oxidative phosphorylation[সম্পাদনা]

According to the chemiosmotic coupling hypothesis, proposed by Nobel Prize in Chemistry winner Peter D. Mitchell, the electron transport chain and oxidative phosphorylation are coupled by a proton gradient across the inner mitochondrial membrane. The efflux of protons from the mitochondrial matrix creates an electrochemical gradient (proton gradient). This gradient is used by the FOF1 ATP synthase complex to make ATP via oxidative phosphorylation. ATP synthase is sometimes described as Complex V of the electron transport chain.[১০] The FO component of ATP synthase acts as an ion channel that provides for a proton flux back into the mitochondrial matrix. It is composed of a, b and c subunits. Protons in the inter-membrane space of mitochondria first enter the ATP synthase complex through an a subunit channel. Then protons move to the c subunits.[১১] The number of c subunits determines how many protons are required to make the FO turn one full revolution. For example, in humans, there are 8 c subunits, thus 8 protons are required.[১২] After c subunits, protons finally enter the matrix through an a subunit channel that opens into the mitochondrial matrix.[১১] This reflux releases free energy produced during the generation of the oxidized forms of the electron carriers (NAD+ and Q) with energy provided by O2. The free energy is used to drive ATP synthesis, catalyzed by the F1 component of the complex.[১৩]
Coupling with oxidative phosphorylation is a key step for ATP production. However, in specific cases, uncoupling the two processes may be biologically useful. The uncoupling protein, thermogenin—present in the inner mitochondrial membrane of brown adipose tissue—provides for an alternative flow of protons back to the inner mitochondrial matrix. Thyroxine is also a natural uncoupler. This alternative flow results in thermogenesis rather than ATP production.[১৪]
Reverse electron flow[সম্পাদনা]
Reverse electron flow is the transfer of electrons through the electron transport chain through the reverse redox reactions. Usually requiring a significant amount of energy to be used, this can reduce the oxidized forms of electron donors. For example, NAD+ can be reduced to NADH by Complex I.[১৫] There are several factors that have been shown to induce reverse electron flow. However, more work needs to be done to confirm this. One example is blockage of ATP synthase, resulting in a build-up of protons and therefore a higher proton-motive force, inducing reverse electron flow.[১৬]
Prokaryotic electron transport chains[সম্পাদনা]
টেমপ্লেট:Citations needed In eukaryotes, NADH is the most important electron donor. The associated electron transport chain is NADH → Complex I → Q → Complex III → cytochrome c → Complex IV → O2 where Complexes I, III and IV are proton pumps, while Q and cytochrome c are mobile electron carriers. The electron acceptor for this process is molecular oxygen.
In prokaryotes (bacteria and archaea) the situation is more complicated, because there are several different electron donors and several different electron acceptors. The generalized electron transport chain in bacteria is:
Donor Donor Donor
↓ ↓ ↓
dehydrogenase → quinone → bc1 → cytochrome
↓ ↓
oxidase(reductase) oxidase(reductase)
↓ ↓
Acceptor Acceptor
Electrons can enter the chain at three levels: at the level of a dehydrogenase, at the level of the quinone pool, or at the level of a mobile cytochrome electron carrier. These levels correspond to successively more positive redox potentials, or to successively decreased potential differences relative to the terminal electron acceptor. In other words, they correspond to successively smaller Gibbs free energy changes for the overall redox reaction.
Individual bacteria use multiple electron transport chains, often simultaneously. Bacteria can use a number of different electron donors, a number of different dehydrogenases, a number of different oxidases and reductases, and a number of different electron acceptors. For example, E. coli (when growing aerobically using glucose and oxygen as an energy source) uses two different NADH dehydrogenases and two different quinol oxidases, for a total of four different electron transport chains operating simultaneously.
A common feature of all electron transport chains is the presence of a proton pump to create an electrochemical gradient over a membrane. Bacterial electron transport chains may contain as many as three proton pumps, like mitochondria, or they may contain two or at least one.
Electron donors[সম্পাদনা]
In the current biosphere, the most common electron donors are organic molecules. Organisms that use organic molecules as an electron source are called organotrophs. Chemoorganotrophs (animals, fungi, protists) and photolithotrophs (plants and algae) constitute the vast majority of all familiar life forms.
Some prokaryotes can use inorganic matter as an electron source. Such an organism is called a (chemo)lithotroph ("rock-eater"). Inorganic electron donors include hydrogen, carbon monoxide, ammonia, nitrite, sulfur, sulfide, manganese oxide, and ferrous iron. Lithotrophs have been found growing in rock formations thousands of meters below the surface of Earth. Because of their volume of distribution, lithotrophs may actually outnumber organotrophs and phototrophs in our biosphere.
The use of inorganic electron donors such as hydrogen as an energy source is of particular interest in the study of evolution. This type of metabolism must logically have preceded the use of organic molecules and oxygen as an energy source.
Dehydrogenases: equivalants to complexes I and II[সম্পাদনা]
Bacteria can use several different electron donors. When organic matter is the electron source, the donor may be NADH or succinate, in which case electrons enter the electron transport chain via NADH dehydrogenase (similar to Complex I in mitochondria) or succinate dehydrogenase (similar to Complex II). Other dehydrogenases may be used to process different energy sources: formate dehydrogenase, lactate dehydrogenase, glyceraldehyde-3-phosphate dehydrogenase, H2 dehydrogenase (hydrogenase), electron transport chain. Some dehydrogenases are also proton pumps, while others funnel electrons into the quinone pool. Most dehydrogenases show induced expression in the bacterial cell in response to metabolic needs triggered by the environment in which the cells grow. In the case of lactate dehydrogenase in E. coli, the enzyme is used aerobically and in combination with other dehydrogenases. It is inducible and is expressed when the concentration of DL-lactate in the cell is high.[তথ্যসূত্র প্রয়োজন]
Quinone carriers[সম্পাদনা]
Quinones are mobile, lipid-soluble carriers that shuttle electrons (and protons) between large, relatively immobile macromolecular complexes embedded in the membrane. Bacteria use ubiquinone (Coenzyme Q, the same quinone that mitochondria use) and related quinones such as menaquinone (Vitamin K2). Archaea in the genus Sulfolobus use caldariellaquinone.[১৭] The use of different quinones is due to slight changes in redox potentials caused by changes in structure. The change in redox potentials of these quinones may be suited to changes in the electron acceptors or variations of redox potentials in bacterial complexes.[১৮]
Proton pumps[সম্পাদনা]
A proton pump is any process that creates a proton gradient across a membrane. Protons can be physically moved across a membrane, as seen in mitochondrial Complexes I and IV. The same effect can be produced by moving electrons in the opposite direction. The result is the disappearance of a proton from the cytoplasm and the appearance of a proton in the periplasm. Mitochondrial Complex III is this second type of proton pump, which is mediated by a quinone (the Q cycle).
Some dehydrogenases are proton pumps, while others are not. Most oxidases and reductases are proton pumps, but some are not. Cytochrome bc1 is a proton pump found in many, but not all, bacteria (not in E. coli). As the name implies, bacterial bc1 is similar to mitochondrial bc1 (Complex III).
Cytochrome electron carriers[সম্পাদনা]
Cytochromes are proteins that contain iron. They are found in two very different environments.
Some cytochromes are water-soluble carriers that shuttle electrons to and from large, immobile macromolecular structures imbedded in the membrane. The mobile cytochrome electron carrier in mitochondria is cytochrome c. Bacteria use a number of different mobile cytochrome electron carriers.
Other cytochromes are found within macromolecules such as Complex III and Complex IV. They also function as electron carriers, but in a very different, intramolecular, solid-state environment.
Electrons may enter an electron transport chain at the level of a mobile cytochrome or quinone carrier. For example, electrons from inorganic electron donors (nitrite, ferrous iron, electron transport chain) enter the electron transport chain at the cytochrome level. When electrons enter at a redox level greater than NADH, the electron transport chain must operate in reverse to produce this necessary, higher-energy molecule.
Electron acceptors and terminal oxidase/reductase[সম্পাদনা]
| এই অনুচ্ছেদটিটি উইকিপিডিয়ার জন্য মানসম্পন্ন অবস্থায় আনতে পরিচ্ছন্ন করা প্রয়োজন। মূল সমস্যা হল: We talk as if oxidases are not also reductases, and as if reductases are not also oxidizing something. That's messed up.. অনুগ্রহ করে অনুচ্ছেদটি এর মান উন্নয়ন করতে সাহায্য করুন; এই সংক্রান্ত বিস্তারিত বর্ণনা আলাপ পাতায় থাকতে পারে। |
As there are a number of different electron donors (organic matter in organotrophs, inorganic matter in lithotrophs), there are a number of different electron acceptors, both organic and inorganic. As with other steps of the ETC, an enzyme is required to help with the process.
If oxygen is available, it is most often used as the terminal electron acceptor in aerobic bacteria and facultative anaerobes. An oxidase reduces the O2 to water while oxidizing something else. In mitochondria, the terminal membrane complex (Complex IV) is cytochrome oxidase, which oxidizes the cytochrome. Aerobic bacteria use a number of differet terminal oxidases. For example, E. coli (a facultative anaerobe) does not have a cytochrome oxidase or a bc1 complex. Under aerobic conditions, it uses two different terminal quinol oxidases (both proton pumps) to reduce oxygen to water.
Bacterial terminal oxidases can be split into classes according to the molecules act as terminal electron acceptors. Class I oxidases are cytochrome oxidases and use oxygen as the terminal electron acceptor. Class II oxidases are quinol oxidases and can use a variety of terminal electron acceptors. Both of these classes can be subdivided into categories based on what redox-active components they contain. E.g. Heme aa3 Class 1 terminal oxidases are much more efficient than Class 2 terminal oxidases.[২]
Mostly in anaerobic environments different electron acceptors are used, including nitrate, nitrite, ferric iron, sulfate, carbon dioxide, and small organic molecules such as fumarate. When bacteria grow in anaerobic environments, the terminal electron acceptor is reduced by an enzyme called a reductase. E. coli can use fumarate reductase, nitrate reductase, nitrite reductase, DMSO reductase, or trimethylamine-N-oxide reductase, depending on the availability of these acceptors in the environment.
Most terminal oxidases and reductases are inducible. They are synthesized by the organism as needed, in response to specific environmental conditions.
Photosynthetic[সম্পাদনা]
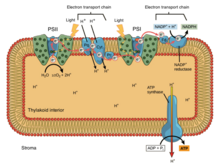
In oxidative phosphorylation, electrons are transferred from an electron donor such as NADH to an acceptor such as O2 through an electron transport chain, releasing energy. In photophosphorylation, the energy of sunlight is used to create a high-energy electron donor which can subsequently reduce oxidized components and couple to ATP synthesis via proton translocation by the electron transport chain.[৯]
Photosynthetic electron transport chains, like the mitochondrial chain, can be considered as a special case of the bacterial systems. They use mobile, lipid-soluble quinone carriers (phylloquinone and plastoquinone) and mobile, water-soluble carriers (cytochromes). They also contain a proton pump. The proton pump in all photosynthetic chains resembles mitochondrial Complex III. The commonly-held theory of symbiogenesis proposes that both organelles descended from bacteria.
তথ্যসুত্র[সম্পাদনা]
- ↑ Lyall, Fiona (২০১০)। "Biochemistry"। Basic Science in Obstetrics and Gynaecology। পৃষ্ঠা 143–171। আইএসবিএন 978-0-443-10281-3। ডিওআই:10.1016/B978-0-443-10281-3.00013-0।
- ↑ ক খ Anraku Y (জুন ১৯৮৮)। "Bacterial electron transport chains"। Annual Review of Biochemistry। 57 (1): 101–32। ডিওআই:10.1146/annurev.bi.57.070188.000533। পিএমআইডি 3052268।
- ↑ Kracke F, Vassilev I, Krömer JO (২০১৫)। "Microbial electron transport and energy conservation - the foundation for optimizing bioelectrochemical systems"। Frontiers in Microbiology (ইংরেজি ভাষায়)। 6: 575। ডিওআই:10.3389/fmicb.2015.00575
 । পিএমআইডি 26124754। পিএমসি 4463002
। পিএমআইডি 26124754। পিএমসি 4463002  । – This source shows four ETCs (Geobacter, Shewanella, Moorella , Acetobacterium) in figures 1 and 2.
। – This source shows four ETCs (Geobacter, Shewanella, Moorella , Acetobacterium) in figures 1 and 2.
- ↑ Waldenström JG (২০০৯-০৪-২৪)। "Biochemistry. By Lubert Stryer"। Acta Medica Scandinavica। 198 (1–6): 436। আইএসএসএন 0001-6101। ডিওআই:10.1111/j.0954-6820.1975.tb19571.x।
- ↑ Zorova LD, Popkov VA, Plotnikov EY, Silachev DN, Pevzner IB, Jankauskas SS, ও অন্যান্য (জুলাই ২০১৮)। "Mitochondrial membrane potential"। Analytical Biochemistry। 552: 50–59। ডিওআই:10.1016/j.ab.2017.07.009। পিএমআইডি 28711444। পিএমসি 5792320
 ।
।
- ↑ Lauren, Biochemistry, Johnson/Cole, 2010, pp 598-611
- ↑ Garrett & Grisham, Biochemistry, Brooks/Cole, 2010, pp 598-611
- ↑ Garrett R, Grisham CM (২০১৬)। biochemistry। Boston: Cengage। পৃষ্ঠা 687। আইএসবিএন 978-1-305-57720-6।
- ↑ ক খ Stryer.। Biochemistry। toppan। ওসিএলসি 785100491।
- ↑ Jonckheere AI, Smeitink JA, Rodenburg RJ (মার্চ ২০১২)। "Mitochondrial ATP synthase: architecture, function and pathology"। Journal of Inherited Metabolic Disease। 35 (2): 211–25। ডিওআই:10.1007/s10545-011-9382-9। পিএমআইডি 21874297। পিএমসি 3278611
 ।
।
- ↑ ক খ Garrett RH, Grisham CM (২০১২)। Biochemistry (5th সংস্করণ)। Cengage learning। পৃষ্ঠা 664। আইএসবিএন 978-1-133-10629-6।
- ↑ Fillingame RH, Angevine CM, Dmitriev OY (নভেম্বর ২০০৩)। "Mechanics of coupling proton movements to c-ring rotation in ATP synthase"। FEBS Letters। 555 (1): 29–34। এসটুসিআইডি 38896804। ডিওআই:10.1016/S0014-5793(03)01101-3
 । পিএমআইডি 14630314।
। পিএমআইডি 14630314।
- ↑ Berg, Jeremy M.; Tymoczko, John L.; Stryer, Lubert (২০০২-০১-০১)। "A Proton Gradient Powers the Synthesis of ATP" (ইংরেজি ভাষায়)। অজানা প্যারামিটার
|name-list-style=উপেক্ষা করা হয়েছে (সাহায্য) - ↑ Cannon B, Nedergaard J (জানুয়ারি ২০০৪)। "Brown adipose tissue: function and physiological significance"। Physiological Reviews। 84 (1): 277–359। ডিওআই:10.1152/physrev.00015.2003। পিএমআইডি 14715917।
- ↑ Kim, Byung Hong; Gadd, Geoffrey Michael (২০০৮)। "Introduction to bacterial physiology and metabolism"। Bacterial Physiology and Metabolism। Cambridge University Press। পৃষ্ঠা 1–6। আইএসবিএন 978-0-511-79046-1। ডিওআই:10.1017/cbo9780511790461.002। অজানা প্যারামিটার
|name-list-style=উপেক্ষা করা হয়েছে (সাহায্য) - ↑ Mills EL, Kelly B, Logan A, Costa AS, Varma M, Bryant CE, ও অন্যান্য (অক্টোবর ২০১৬)। "Succinate Dehydrogenase Supports Metabolic Repurposing of Mitochondria to Drive Inflammatory Macrophages"। Cell। 167 (2): 457–470.e13। ডিওআই:10.1016/j.cell.2016.08.064
 । পিএমআইডি 27667687। পিএমসি 5863951
। পিএমআইডি 27667687। পিএমসি 5863951  ।
।
- ↑ ইসি 1.3.5.1
- ↑ Ingledew WJ, Poole RK (সেপ্টেম্বর ১৯৮৪)। "The respiratory chains of Escherichia coli"। Microbiological Reviews। 48 (3): 222–71। ডিওআই:10.1128/mmbr.48.3.222-271.1984
 । পিএমআইডি 6387427। পিএমসি 373010
। পিএমআইডি 6387427। পিএমসি 373010  ।
।
পড়ুন[সম্পাদনা]
- Fenchel T, King GM, Blackburn TH (সেপ্টেম্বর ২০০৬)। Bacterial Biogeochemistry: The Ecophysiology of Mineral Cycling (2nd সংস্করণ)। Elsevier। আইএসবিএন 978-0-12-103455-9।
- Lengeler JW (জানুয়ারি ১৯৯৯)। Drews G; Schlegel HG, সম্পাদকগণ। Biology of the Prokaryotes। Blackwell Science। আইএসবিএন 978-0-632-05357-5।
- Nelson DL, Cox MM (এপ্রিল ২০০৫)। Lehninger Principles of Biochemistry (4th সংস্করণ)। W. H. Freeman। আইএসবিএন 978-0-7167-4339-2।
- Nicholls DG, Ferguson SJ (জুলাই ২০০২)। Bioenergetics 3। Academic Press। আইএসবিএন 978-0-12-518121-1।
- Stumm W; Morgan JJ (১৯৯৬)। Aquatic Chemistry (3rd সংস্করণ)। John Wiley & Sons। আইএসবিএন 978-0-471-51185-4।
- Thauer RK, Jungermann K, Decker K (মার্চ ১৯৭৭)। "Energy conservation in chemotrophic anaerobic bacteria"। Bacteriological Reviews। 41 (1): 100–80। ডিওআই:10.1128/MMBR.41.1.100-180.1977। পিএমআইডি 860983। পিএমসি 413997
 ।
। - White D (সেপ্টেম্বর ১৯৯৯)। The Physiology and Biochemistry of Prokaryotes (2nd সংস্করণ)। Oxford University Press। আইএসবিএন 978-0-19-512579-5।
- Voet D, Voet JG (মার্চ ২০০৪)। Biochemistry। Biochemical Education। 28 (3rd সংস্করণ)। John Wiley & Sons। পৃষ্ঠা 124। আইএসবিএন 978-0-471-58651-7। ডিওআই:10.1016/s0307-4412(00)00032-7। পিএমআইডি 10878303।
- Kim HS, Patel K, Muldoon-Jacobs K, Bisht KS, Aykin-Burns N, Pennington JD, ও অন্যান্য (জানুয়ারি ২০১০)। "SIRT3 is a mitochondria-localized tumor suppressor required for maintenance of mitochondrial integrity and metabolism during stress"। Cancer Cell। 17 (1): 41–52। ডিওআই:10.1016/j.ccr.2009.11.023। পিএমআইডি 20129246। পিএমসি 3711519
 ।
। - Raimondi V, Ciccarese F, Ciminale V (জানুয়ারি ২০২০)। "Oncogenic pathways and the electron transport chain: a dangeROS liaison"। Br J Cancer। 122 (2): 168–181। ডিওআই:10.1038/s41416-019-0651-y। পিএমআইডি 31819197। পিএমসি 7052168

|pmc=এর মান পরীক্ষা করুন (সাহায্য)। - Reguera, Gemma (২৯ মে ২০১৮)। "Biological electron transport goes the extra mile"। Proceedings of the National Academy of Sciences। 115 (22): 5632–5634। ডিওআই:10.1073/pnas.1806580115
 । পিএমআইডি 29769327। পিএমসি 5984551
। পিএমআইডি 29769327। পিএমসি 5984551  । বিবকোড:2018PNAS..115.5632R। – Editorial commentary mentioning two unusual ETCs: that of Geobacter sulfurreducens and that of cable bacteria. Also has schematic of E. coli ETC.
। বিবকোড:2018PNAS..115.5632R। – Editorial commentary mentioning two unusual ETCs: that of Geobacter sulfurreducens and that of cable bacteria. Also has schematic of E. coli ETC.
বহিঃসংযোগ[সম্পাদনা]
- Electron Transport Chain Complex Proteins যুক্তরাষ্ট্রের জাতীয় চিকিৎসা গ্রন্থাগারে চিকিৎসা বিষয়ক শিরোনাম (MeSH)
- খান অ্যাকাডেমি, ভিডিয়ো লেকচার
- KEGG গতিপথ: অক্সিডেটিভ ফসফোরাইলেশন, সুডোনোমাস প্রতিপ্রভে প্রাপ্ত জিন দ্বারা আচ্ছাদিত Pf0-1. Click "help" for a how-to.








