সিমন্স–স্মিথ বিক্রিয়া

| সিমন্স–স্মিথ বিক্রিয়া | |
|---|---|
| যার নামে নামকরণ হয় | হাওয়ার্ড এন্সাইন সিমন্স, জুনিওর রোনাল্ড ডি. স্মিথ |
| বিক্রিয়ার ধরন | রিং তৈরির বিক্রিয়া |
| শনাক্তকারী | |
| অর্গানিককেমিস্ট্রি প্রবেশদ্বার | simmons-smith-reaction (ইংরেজি) |
| আরএসসি অন্টোলজি আইডি | RXNO:0000258 (ইংরেজি) |
সিমন্স–স্মিথ বিক্রিয়া একটি জৈব কেলেট্রপিক বিক্রিয়া যেখানে একটি অর্গানোজিঙ্ক কার্বেনয়েড অ্যালকিন (বা অ্যালকাইন) এর সাথে বিক্রিয়া করে সাইক্লোপ্রোপেন উৎপন্ন করে।[১][২][৩] বিজ্ঞানী হাওয়ার্ড এন্সাইন সিমন্স, জুনিওর ও রোনাল্ড ডি. স্মিথ এর নামানুসারে এর নামকরণ করা হয়েছে। এই বিক্রিয়ায় মিথাইলিন ফ্রি র্যাডিক্যাল অন্তর্বর্তী মাধ্যম হিসেবে কাজ করে যা একইসঙ্গে অ্যালকিন এর দ্বিবন্ধনের সাথে যুক্ত হয়, যার ফলে উৎপাদে দ্বিবন্ধনের আকৃতি বজায় থাকে এবং বিক্রিয়াটি স্টেরিওস্পেসিফিক হয়।[৪]
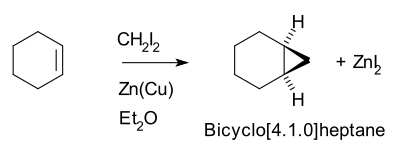
অতএব, সাইক্লোহেক্সিন, ডাইআয়োডোমিথেন এবং একটি জিঙ্ক-কপার কাপল (আয়োডোমিথাইলজিঙ্ক আয়োডাইড ICH2ZnI) একত্রে বিক্রিয়া করে নোরকারেন (বাইসাইক্লো[4.1.0]হেপ্টেন) উৎপন্ন করে। [৫][৬]
সাইক্লোপ্রোপেন তৈরির বিভিন্ন পদ্ধতির মধ্যে সিমন্স–স্মিথ বিক্রিয়া অধিক জনপ্রিয়,[৭] তবে ডাইআয়োডোমিথেনের উচ্চ মূল্যের কারণে এতে খরচ বেশি হয়। এর পরিবর্তে অন্যান্য সাশ্রয়ী বিকল্প রয়েছে যেমন, ডাইব্রোমোমিথেন[৮] বা ডায়াজোমিথেন এবং জিঙ্ক আয়োডাইড।[৯] ফুরুকাওয়া মডিফিকেশন অনুসারে জিঙ্ক-কপার কাপল এর স্থলে ডাইইথাইলজিঙ্ক ব্যবহার করলে বিক্রিয়ার হার বৃদ্ধি পায়।[১০]
সাধারণত সিমন্স–স্মিথ বিক্রিয়ায় স্টেরিক প্রভাব রয়েছে, অর্থাৎ সাধারণত কম বাধাপ্রাপ্ত পাশে সাইক্লোপ্রপেনিকরন ঘটে।[১১][১২] তবে, দ্বিবন্ধনের কাছাকাছি স্তরে হাইড্রক্সি প্রতিস্থাপকের উপস্থিতি থাকলে, জিঙ্ক, হাইড্রক্সি প্রতিস্থাপকের সাথে যুক্ত হয়ে হাইড্রক্সিল মূলকের দিকে সিস সাইক্লোপ্রপেনিকরন ঘটে (দ্বিবন্ধনে স্টেরিকভাবে সবথেকে সুগম পাশে সাইক্লোপ্রপেনিকরনের জন্য এটি নাও ঘটতে পারে)।[১৩] এই বিক্রিয়ার একটি ত্রিমাত্রিক মডেল এখানে পাওয়া যাবে। (জাভা প্রয়োজন)
অপ্রতিসম সিমন্স–স্মিথ বিক্রিয়া[সম্পাদনা]
ডায়াজো যৌগের উপর নির্ভরশীল অপ্রতিসম সাইক্লোপ্রপেনিকরন পদ্ধতি, ১৯৬৬ সাল থেকে প্রচলিত হলেও,(দেখুন বাইসোক্সাজোলিন লিগ্যান্ড) অপ্রতিসম সিমন্স–স্মিথ বিক্রিয়া ১৯৯২ সালে প্রবর্তিত হয়। [১৪] এখানে, ডাইক্লোরোমিথেন এর মধ্যে সিন্যামাইল অ্যালকোহল এর সাথে ডাইইথাইলজিঙ্ক, ডাইআয়োডোমিথেন এবং কাইরাল ডাইসালফোনামাইডএর বিক্রিয়া ঘটে:
হাইড্রক্সিল মূলক, জিঙ্ক এর বাহক হিসেবে অপরিহার্য ভূমিকা পালন করে। অনুরূপ একটি বিক্রিয়ার [১৫] একটি ত্রিমাত্রিক মডেল এখানে দেখা যাবে। (জাভা প্রয়োজন) এই বিক্রিয়ার আরেকটি সংস্করণে লিগ্যান্ডটি সালেন জাতীয় এবং এতে লুইস এসিড ও DIBAL যোগ করা হয়। [১৬]
সুযোগ এবং সীমাবদ্ধতা[সম্পাদনা]
অকাইরাল অ্যালকিন[সম্পাদনা]
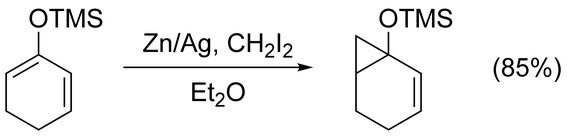
সিমন্স–স্মিথ বিক্রিয়া সরল অ্যালকিনের সাইক্লোপ্রপেনিকরণ করতে ব্যবহার করা যায়। ফুরুকাওয়া মডিফিকেশনের দ্বারা 1,2-ডাইক্লোরোইথেনে ডাইইথাইলজিঙ্ক (Et2Zn) ও ডাইআয়োডোমিথেন (CH2I2) ব্যবহার করে অকার্যকর অ্যাকাইরাল অ্যালকিনের সর্বোত্তম সাইক্লোপ্রপেনিকরণ করা যায় (নিচে দেখুন)। [১৭] ইলেকট্রন দাতা মূলকের দ্বারা সক্রিয়করণ করা হলে অ্যালকিনের সাইক্লোপ্রপেনিকরণ দ্রুত এবং সহজে ঘটে। উদাহরণস্বরূপ, ট্রাইমিথাইলসিলাইলক্সি-প্রতিস্থাপিত অলেফিনের মত ইনল ইথার প্রায়ই উচ্চ উৎপাদ লাভের জন্য ব্যবহার করা হয়। [১৮]

হ্যালাইডের ইলেকট্রন আকর্ষণ করার প্রবণতা থাকলেও, অনেক ভিনাইল হ্যালাইড থেকে সহজেই সাইক্লোপ্রপেন তৈরি হয় যা, ফ্লোরো-, ব্রোমো- এবং আয়োডো- মূলক প্রতিস্থাপিত সাইক্লোপ্রপেন উৎপন্ন হয়। [১৯][২০]

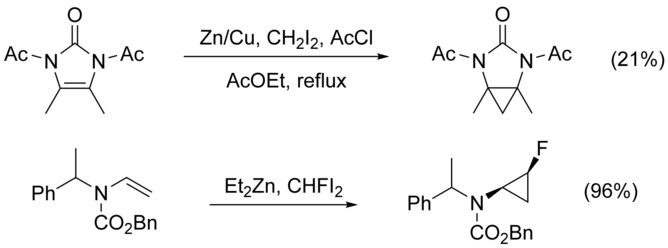
নাইট্রোজেন-প্রতিস্থাপিত অ্যালকিনের সাইক্লোপ্রপেনিকরণ, নাইট্রোজেন-অ্যালকাইলেশনের প্রতিদ্বন্দ্বিতার ফলে জটিল হয়ে ওঠে। এটিকে নাইট্রোজেনের সাথে একটি প্রতিরক্ষক মূলক যুক্ত করে সমাধান করা যায়। তবে, ইলেকট্রন-গ্রহীতা মূলক অ্যালকিনের নিউক্লিওফিলিসিটি হ্রাস করে, যার ফলে উৎপাদ কমে যায়। এসব ক্ষেত্রে ডাইআয়োডোমিথেন (CH2I2) এর স্থলে উচ্চ ইলেক্ট্রোফিলিক বিকারক যেমন, CHFI2 ব্যবহার করলে উৎপাদের পরিমাণ বৃদ্ধি পেতে দেখা যায়। [২১]
পলিন[সম্পাদনা]
অলেফিনে কোন নির্দেশক মূলকের উপস্থিতি না থাকলে, খুব সামান্য কেমোসিলেক্টিভিটি দেখা যায়। [২২] তবে, অ্যালকিনের মত উল্লেখযোগ্য নিউক্লিওফিলিক যৌগ অন্যান্য যৌগের তুলনায় প্রাধান্য পায়। উদাহরণস্বরূপ, ইনল ইথারের সাইক্লোপ্রপেনেশন অত্যন্ত নির্বাচিতভাবে ঘটে থাকে। [২৩]
কার্যকরী মূলকের সামঞ্জস্যতা[সম্পাদনা]
সিমন্স–স্মিথ বিক্রিয়ার একটি গুরুত্বপূর্ণ বৈশিষ্ট্য হচ্ছে এটিকে বহু কার্যকরী মূলকের উপস্থিতিতে ব্যবহার করা যায় যা এর ব্যাপক ব্যবহারের পেছনে ভূমিকা রেখেছে। অন্যান্য বিক্রিয়াসমূহের মধ্যে হ্যালোঅ্যালকাইলজিঙ্ক-মধ্যস্থ বিক্রিয়া অ্যালকাইন, অ্যালকোহল, ইথার, অ্যালডিহাইড, কিটোন, কার্বক্সিলিক অ্যাসিড ও এর উৎপাদ, কার্বনেট, সালফোন, সালফোনেট, সিলেন, ও স্ট্যানেড এর সাথে বেশি সামঞ্জ্যস্যপূর্ণ। যদিও, কিছু পার্শ্বীয় বিক্রিয়াও সাধারণত পরিলক্ষিত হয়।
বেশিরভাগ পার্শ্বীয় বিক্রিয়া ZnI2 উপজাতের লুইস-অম্লত্বের কারণে ঘটে থাকে। যেসব বিক্রিয়ায় অম্ল-সংবেদনশীল উৎপাদ তৈরি হয়, সেখানে উৎপন্ন ZnI2 কে পরিষ্কার করতে Et2Zn জয় করা যেতে পারে, যার ফলে তুলনামুলক কম অম্লীয় EtZnI উৎপন্ন হয়। এই বিক্রিয়াটি পাইরিডিন এর সাথেও ব্যবহার করা যায়, যা ZnI2 ও অন্যান্য বিকারককে শোষণ করে। [২৪]
জিঙ্ক কার্বনয়েড এর ইলেকট্রন আসক্তির কারণে সিমন্স–স্মিথ বিক্রিয়ায় বিষম-অণুর মিথাইলিকরণ দেখা যায়। উদাহরণস্বরূপ, দীর্ঘ সময় ধরে অতিরিক্ত বিকারকের উপস্থিতিতে প্রায় সবসময়ই অ্যালকোহলের মিথাইলিকরণ ঘটে। [২৫] অধিকন্তু, Et2Zn ও CH2I2 অ্যালকাইলিক থিওইথারের সাথে বিক্রিয়া করে সালফার উৎপাদ তৈরি করে, যা পরবর্তীতে 2,3-সিগমাট্রপিক পুনর্বিন্যাস এর মধ্য দিয়ে যায়, এবং এতে অতিরিক্ত সিমন্স–স্মিথ বিকারকের উপস্থিতি ছাড়া একই অণুর অ্যালকিনের সাইক্লোপ্রপেনেশন ঘটে না। [২৬]

পরিবর্তিত অবস্থা[সম্পাদনা]
সিমন্স–স্মিথ বিক্রিয়াটি সাধারণত এর মূল গঠনে আলোচিত হলেও, এর জিঙ্ক প্রভাবক ও সংযোজিত কার্বনের কয়েকটি পরিবর্তিত অবস্থা প্রস্তাব করা হয়েছে।
ফুরুকাওয়া মডিফিকেশন[সম্পাদনা]
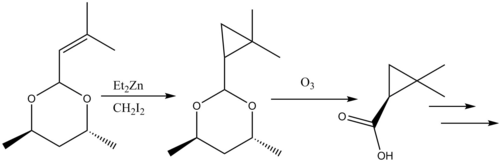
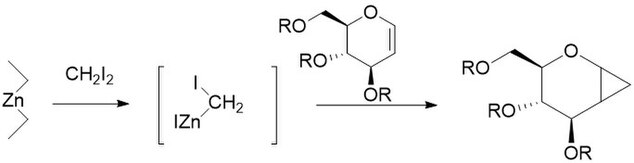
ফুরুকাওয়া মডিফিকেশনে জিঙ্ক-কপার কাপলের স্থলে ডাইঅ্যালকাইল জিঙ্ক ব্যবহার করা হয়, যা Et2Zn এর মধ্যে সবথেকে বেশি সক্রিয়। এই পরিবর্তনটি ১৯৬৮ সালে ক্যাটায়নিকভাবে পলিমারকরণযোগ্য অলেফিন যেমন, ভিনাইল ইথারকে এদের সংশ্লিষ্ট সাইক্লোপ্রপেনে রূপান্তরিত করার একটি উপায় হিসেবে প্রস্তাব করা হয়েছিল। [২৭] কার্বোহাইড্রেটের সাইক্লোপ্রপেনিকরণে এটি অন্যান্য পদ্ধতির তুলনায় বেশি উৎপাদ তৈরি করায় এর ব্যবহার অত্যন্ত উপযোগী। [২৮] মূল বিক্রিয়াটির মতই, ফুরুকাওয়া মডিফিকেশনের বিক্রিয়াটি স্টেরিওস্পেসিফিক এবং মূল বিক্রিয়াটির থেকে দ্রুততর। তবে, Et2Zn বিকারকটি পাইরোফোরিক (বাতাশের সংস্পর্শে দাহ্য) হওয়ায় সাবধানে ব্যবহার করা উচিত। [২৯]
শার্লেট মডিফিকেশন[সম্পাদনা]
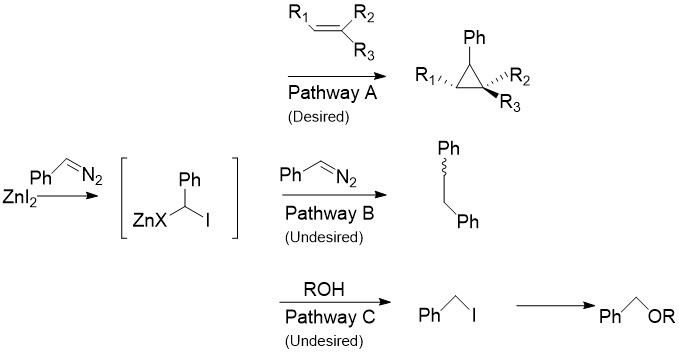
শার্লেট মডিফিকেশনে সিমন্স–স্মিথ বিক্রিয়ায় ব্যবহৃত CH2I2 কে অ্যারাইলডায়াজো যৌগ, যেমন, ফিনাইলডায়াজোমিথেন দ্বারা প্রতিস্থাপিত করা হয়, যা নিচের চিত্রে পাথওয়ে A তে দেখানো হয়েছে। [৩০] স্টকিওমেট্রিক পরিমাণ জিঙ্ক হ্যালাইডের উপস্থিতিতে, উপরে বর্ণিত কার্বেনয়েডের ন্যায় একটি অরগ্যানোজিঙ্ক যৌগ গঠিত হয়। এই বিক্রিয়া স্টাইরিন ও অ্যালকোহল সহ প্রায় সকল অ্যালকিন ও অ্যালকাইনের সাথে ঘটতে পারে। তবে দুর্ভাগ্যবশত, পাথওয়ে B এর মত মধ্যবর্তী উৎপাদও ডায়াজো যৌগের সাথে বিক্রিয়া করে, সিস- অথবা ট্রান্স- 1,2-ডাইফিনাইলইথিন উৎপন্ন করে। এছাড়াও মধ্যবর্তী উৎপাদটি অ্যালকোহলের সাথে বিক্রিয়া করে আয়ডোফিনাইলমিথেন উৎপন্ন করে, যা পরে পাথওয়ে C এর মত SN2 বিক্রিয়ার মাধ্যমে ROCHPh তৈরি হয়।
নন-জিঙ্ক বিকারক[সম্পাদনা]
প্রচলিতভাবে ব্যবহৃত না হলেও, জিঙ্কের ন্যায় বিক্রিয়ার বৈশিষ্ট্য প্রদর্শনকারী সিমন্স–স্মিথ বিকারক পূর্বে CH2IX এর উপস্থিতিতে অ্যালুমিনিয়াম ও সামারিয়াম যৌগ থেকে উৎপাদন করা হত। [৩১] এই বিকারকগুলোর ব্যবহারে, অ্যালাইলিক অ্যালকোহল এবং বিচ্ছিন্ন অলেফিন একে অপরের উপস্থিতিতে নির্বাচিতভাবে সাইক্লোপ্রপেনিত হতে পারে। টেট্রাহাইড্রোফুরানে আয়ডো- বা ক্লোরো মিথাইলসামারিয়াম অ্যালাইলিক অ্যালকোহলকে সাইক্লোপ্রপেনিত করতে একটি উত্তম বিকারক হিসেবে কাজ করে, যা সম্ভবত হাইড্রক্সিল মূলকের চিলেটেশন দ্বারা নির্দেশিত হয়। [৩২] অপরদিকে, ডাইঅ্যালকাইল(আয়ডোমিথাইল)অ্যালুমিনিয়াম বিকারকের ব্যবহারে, CH2Cl2 বিচ্ছিন্ন অলেফিনকে নির্বাচিতভাবে সাইক্লোপ্রপেনিত করে। [৩৩] এই বিকারকগুলোর নির্দিষ্টতার ফলে, সাইক্লোপ্রপেনসমূহকে পলি-অসম্পৃক্ত ব্যবস্থায় স্থাপিত করে, যেখানে জিঙ্ক-ভিত্তিক বিকারক সম্পূর্ণ ও অনির্বাচিতভাবে সাইক্লোপ্রপেনিত করে। উদাহরণস্বরূপ, i-Bu3Al জেরানিওলকে ৬ নং অবস্থানে সাইক্লোপ্রপেনিত করে, যেখানে সামারিয়াম/পারদ ২নং অবস্থানে সাইক্লোপ্রপেনিত করে। এটি নিচে দেখানো হল-

তবে, উভয় বিক্রিয়ার শুরুতে ধাতব যৌগের কাছাকাছি স্টকিওমেট্রিক পরিমাণের প্রয়োজন, এবং সামারিয়াম/পারদকে অত্যন্ত বিষাক্ত HgCl2 দ্বারা সক্রিয় করতে হয়।
সংশ্লেষণে ব্যবহার[সম্পাদনা]
আধুনিককালে সিমন্স–স্মিথ বিক্রিয়ার অধিকাংশ প্রয়োগে ফুরুকাওয়া মডিফিকেশন ব্যবহৃত হয়। এর মধ্যে উল্লেখযোগ্যভাবে সংশ্লিষ্ট এবং নির্ভরযোগ্য ব্যবহারগুলো নিচে তালিকাভুক্ত করা হল-
γ-কিটো এস্টার গঠনে সন্নিবেশন[সম্পাদনা]
β-কিটো এস্টার থেকে γ-কিটো এস্টার সংশ্লেষণে ফুরুকাওয়া মডিফাইড সিমন্স–স্মিথ বিক্রিয়া উদ্ভূত মধ্য়বর্তী সাইক্লোপ্রপেন উৎপন্ন হয়। সিমন্স–স্মিথ বিকারক প্রথমে কার্বনাইল মূলকের সাথে, এবং ক্রমান্বয়ে প্রথম বিক্রিয়া থেকে উৎপন্ন ছদ্ম-ইনল α-কার্বন এর সাথে যুক্ত হয়। এই দ্বিতীয় বিকারকটি মধ্যবর্তী সাইক্লোপ্রপেন উৎপন্ন করে, যা দ্রুত উৎপাদে খন্ডায়িত হয়। [৩৪][৩৫]

অ্যালিনামাইড থেকে অ্যামাইডো-স্পাইরো [2.2] পেন্টেন গঠন[সম্পাদনা]
একটি ফুরুকাওয়া মডিফাইড সিমন্স–স্মিথ বিক্রিয়া অ্যালিন্যামাইডের দ্বিবন্ধনকে সাইক্লোপ্রপেনিত করে অ্যামাইডো-স্পাইরো [2.2] পেন্টেন উৎপন্ন করে, যেখানে দুটি সাইক্লোপ্রপাইল রিং একটি কার্বন পরমাণুর সাথে যুক্ত থাকে। এতে মনোসাইক্লোপ্রপেনিকরণের উৎপাদও তৈরি হয়। [৩৬][৩৭]

প্রাকৃতিক উৎপাদ সংশ্লেষণ[সম্পাদনা]
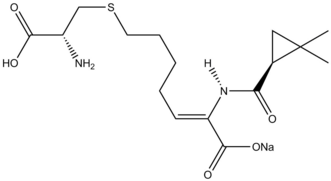
প্রাকৃতিক উৎপাদ সংশ্লেষণে সাইক্লোপ্রপেনিকরণ বিক্রিয়াসমূহ পর্যালোচনা করা হয়েছে। [৩৮] প্রাকৃতিক উৎপাদ সংশ্লেষণে সিমন্স–স্মিথ বিক্রিয়ার একটি উদাহরণ হল β-ল্যাক্টামেস ইনহিবিটর সিলাস্টিন। বিক্রিয়ার শুরুর উপাদানে একটি অ্যালাইল প্রতিস্থাপক সিমন্স–স্মিথ সাইক্লোপ্রপেনিত হয়, এবং পূর্ববর্তী উপাদান থেকে ওজোনোলাইসিসের দ্বারা কার্বক্সিলিক অ্যাসিড পর্যায়ক্রমে অরক্ষিত হয়।
তথ্যসূত্র[সম্পাদনা]
- ↑ Howard Ensign Simmons, Jr.; Smith, R.D. (১৯৫৮)। "A New Synthesis of Cyclopropanes from Olefins"। J. Am. Chem. Soc.। 80 (19): 5323–5324। ডিওআই:10.1021/ja01552a080।
- ↑ Simmons, H.E.; Smith, R.D. (১৯৫৯)। "A New Synthesis of Cyclopropanes"। J. Am. Chem. Soc.। 81 (16): 4256–4264। ডিওআই:10.1021/ja01525a036।
- ↑ Denis, J.M.; Girard, J.M.; Conia, J.M (১৯৭২)। "Improved Simmons–Smith Reactions"। Synthesis। 1972 (10): 549–551। ডিওআই:10.1055/s-1972-21919।
- ↑ Charette, A. B.; Beauchemin, A. (২০০১)। Simmons-Smith Cyclopropanation Reaction। Org. React.। 58। পৃষ্ঠা 1। আইএসবিএন 978-0471264187। ডিওআই:10.1002/0471264180.or058.01।
- ↑ Smith, R. D.; Simmons, H. E.। "Norcarane"। অর্গানিক সিন্থেসিস।; Collective Volume, 5, পৃষ্ঠা 855
- ↑ Ito, Y.; Fujii, S.; Nakatuska, M.; Kawamoto, F.; Saegusa, T. (১৯৮৮)। "One-Carbon Ring Expansion Of Cycloalkanones To Conjugated Cycloalkenones: 2-Cyclohepten-1-one"। অর্গানিক সিন্থেসিস।; Collective Volume, 6, পৃষ্ঠা 327
- ↑ টেমপ্লেট:ClaydenPage 1067
- ↑ Fabisch, Bodo; Mitchell, Terence N. (১৯৮৪)। "An inexpensive modification of the Simmons-Smith reaction: The formation of bromomethylzinc bromide as studied by NMR spectroscopy"। Journal of Organometallic Chemistry। 269 (3): 219–221। ডিওআই:10.1016/0022-328X(84)80305-8।
- ↑ Wittig, Georg; Wingler, Frank (১ আগস্ট ১৯৬৪)। "Über methylenierte Metallhalogenide, IV. Cyclopropan-Bildung aus Olefinen mit Bis-halogenmethyl-zink"। Chemische Berichte। 97 (8): 2146–2164। ডিওআই:10.1002/cber.19640970808।
- ↑ Furukawa, J.; Kawabata, N.; Nishimura, J. (১৯৬৮)। "Synthesis of cyclopropanes by the reaction of olefins with dialkylzinc and methylene iodide"। Tetrahedron। 24 (1): 53–58। ডিওআই:10.1016/0040-4020(68)89007-6।
- ↑ Simmons, H. E.; ও অন্যান্য (১৯৭৩)। Org. React. (Review)। 20: 1।
|শিরোনাম=অনুপস্থিত বা খালি (সাহায্য) - ↑ Girard, C.; Conia, J. M. (১৯৭৮)। J. Chem. Res. (S) (Review): 182।
|শিরোনাম=অনুপস্থিত বা খালি (সাহায্য) - ↑ Paul A. Grieco; Tomei Oguri; Chia-Lin J. Wang & Eric Williams (১৯৭৭)। "Stereochemistry and total synthesis of (±)-ivangulin"। J. Org. Chem.। 42 (25): 4113–4118। ডিওআই:10.1021/jo00445a027।
- ↑ Hideyo Takahashi, Masato Yoshioka, Masaji Ohno and Susumu Kobayashi (১৯৯২)। "A catalytic enantioselective reaction using a C2-symmetric disulfonamide as a chiral ligand: cyclopropanation of allylic alcohols by the Et2Zn-CH2I2-disulfonamide system"। Tetrahedron Letters। 33 (18): 2575–2578। ডিওআই:10.1016/S0040-4039(00)92246-9।
- ↑ Wang, Tao; Liang, Yong; Yu, Zhi-Xiang (২০১১)। "Density Functional Theory Study of the Mechanism and Origins of Stereoselectivity in the Asymmetric Simmons–Smith Cyclopropanation with Charette Chiral Dioxaborolane Ligand"। Journal of the American Chemical Society। 133 (24): 9343–9353। ডিওআই:10.1021/ja111330z। পিএমআইডি 21627114।
- ↑ Hiroaki Shitama & Tsutomu Katsuki (২০০৮)। "Asymmetric Simmons–Smith Reaction of Allylic Alcohols with Al Lewis Acid/N Lewis Base Bifunctional Al(Salalen) Catalyst"। Angew. Chem. Int. Ed.। 47 (13): 2450–2453। ডিওআই:10.1002/anie.200705641। পিএমআইডি 18288666।
- ↑ Denmark, S. E.; Edwards, J. P. (১৯৯১)। "A Comparison of (Chloromethyl)- and (Iodomethyl)zinc Cyclopropanation Reagents"। J. Org. Chem.। 56 (25): 6974–6981। ডিওআই:10.1021/jo00025a007।
- ↑ Rubottom, G. M.; Lopez, M. I. (১৯৭৩)। "Reaction of Trimethysilyl Enol Ethers with Simmons-Smith Reagent. Facile Synthesis of Trimethylsilyl Cyclopropyl Ethers and Cyclopropanols"। J. Org. Chem.। 38 (11): 2097–2099। ডিওআই:10.1021/jo00951a032।
- ↑ Morikawa, T.; Sasaki, H.; Mori, K.; Shiro, M.; Taguchi, T.; Morikawa, T.; Sasaki, H.; Mori, K.; Shiro, M.; Taguchi, T. Simmons-Smith Reactions of Fluoroallyl Alcohol Derivatives. Chem. Pharm. Bull. (Tokyo) 1992, 40 (12), 3189.
- ↑ Piers, E.; Coish, P. D. Preparation and Cyclopropanation of 2- and 3-Iodoalk-2-En-1-Ols: Synthesis of Functionalized, Stereodefined Iodocyclopropanes. Synthesis 1995, 1995 (1), 47–55.
- ↑ Gagnon, J. L.; Jr, W. W. Z. Synthesis of Cis-1,5-Dimethyl-2,4-Dinitro-2,4-diazabicyclo[3.1.0]hexan-3-One and Cis-1,5-Dimethyl-2,4-Dinitro-2,4-diazabicyclo[3.2.0]heptan-3-One. Synth. Commun. 1996, 26 (4), 837–845.
- ↑ Friedrich, E. C.; Niyati-Shirkhodaee, F. (১৯৯১)। "Regioselectivity and Solvent Effects in Cyclopropanation of Alkadienes"। J. Org. Chem.। 56 (6): 2202–2205। ডিওআই:10.1021/jo00006a044।
- ↑ Lee, J.; Kim, H.; Cha, J. K. (১৯৯৫)। "Diastereoselective Synthesis of Cis-1,2-Dialkenylcyclopropanols and Subsequent Oxy-Cope Rearrangement"। J. Am. Chem. Soc.। 117 (39): 9919–9920। ডিওআই:10.1021/ja00144a022।
- ↑ Denis, J. M.; Girard, C.; Conia, J. M. Improved Simmons-Smith Reactions. Synthesis 1972, 1972 (10), 549–551.
- ↑ Takakis, I. M.; Rhodes, Y. E. (১৯৭৮)। "Cyclopropanation of Some Simple Olefinic Compounds. By-Product Formation in Excess Simmons-Smith Reagent"। J. Org. Chem.। 43 (18): 3496–3500। ডিওআই:10.1021/jo00412a017।
- ↑ Cohen, T.; Kosarych, Z. (১৯৮২)। "Complete regio- and stereospecificity in the Lewis acid catalyzed Diels-Alder reactions of (Z)-2-methoxy-1-(phenylthio)-1,3-butadienes. Conversion of the CS configuration of an adduct to the CC configuration at the allylic position by a [2,3] sigmatropic rearrangement"। J. Org. Chem.। 47 (20): 4005–4008। ডিওআই:10.1021/jo00141a047।
- ↑ Furukawa, J; Kawabata, N; Nishimura, J (১৯৬৮)। "Synthesis of cyclopropanes by the reaction of olefins with dialkylzinc and methylene iodide"। Tetrahedron। 24 (1): 53–58। ডিওআই:10.1016/0040-4020(68)89007-6।
- ↑ Halton, B (২০০০)। Advances in Strained and Interesting Organic Molecules, Volume 8। Stamford, Ct: Press Inc। পৃষ্ঠা 115। আইএসবিএন 978-0-7623-0631-2।
- ↑ "Diethyl Zinc MSDS" (পিডিএফ)। সংগ্রহের তারিখ ১০ মে ২০১৭।[স্থায়ীভাবে অকার্যকর সংযোগ]
- ↑ Lévesque, Éric; Goudreau, Sébastien R.; B. Charette, André B. (২০১৪)। "Improved Zinc-Catalyzed Simmons–Smith Reaction: Access to Various 1,2,3-Trisubstituted Cyclopropanes"। Organic Letters। 16 (5): 1490–1493। ডিওআই:10.1021/ol500267w। পিএমআইডি 24555697।
- ↑ Roger, Adams (২০০১)। Organic Reactions Vol 58। New York: Wiley, J। পৃষ্ঠা 9–10। আইএসবিএন 978-0-471-10590-9।
- ↑ Molander, G. A.; Harring, L. S. (১৯৮৯)। "Samarium-Promoted Cyclopropanation of Allylic Alcohols"। J. Org. Chem.। 54 (15): 3525–3532। ডিওআই:10.1021/jo00276a008।
- ↑ Maruoka, K.; Fukutani, Y.; Yamamoto, H. (১৯৮৫)। "Trialkylaluminum-Alkylidene Iodide. A Powerful Cyclopropanation Agent with Unique Selectivity"। J. Org. Chem.। 50 (22): 4412–4414। ডিওআই:10.1021/jo00222a051।
- ↑ Bhogadhi, Yashoda; Zercher, Charles (২০১৪)। "Discussion Addendum for: Formation of γ-Keto Esters from β-Keto Esters: Methyl 5,5-dimethyl-4-oxohexanoate"। Organic Syntheses। 91: 248–259। ডিওআই:10.15227/orgsyn.091.0248।
- ↑ Ronsheim, Matthew; Hilgenkamp, Ramona; Zercher, Charles (২০০২)। Formation of γ-Keto Esters from β-Keto Esters: Methyl 5,5-dimethyl-4-oxohexanoate। Organic Syntheses। 79। পৃষ্ঠা 146। আইএসবিএন 978-0471264224। ডিওআই:10.1002/0471264180.os079.18।
- ↑ Teo, Yong-Chua; Hsung, Richard (২০১৪)। "Discussion Addendum for: Practical Synthesis of Novel Chiral Allenamides: (R)-4- Phenyl-3-(1,2-propadienyl)oxazolidin-2-one"। Organic Syntheses। 91: 12–26। ডিওআই:10.15227/orgsyn.091.0012।
- ↑ Xiong, H; Tracey, M; Grebe, T; Mulder, J; Hsung, R (২০০৫)। "PRACTICAL SYNTHESIS OF NOVEL CHIRAL ALLENAMIDES: (R)-4-PHENYL-3-(1,2-PROPADIENYL)OXAZOLIDIN-2-ONE (2-Oxazolidinone, 4-phenyl-3-(1,2-propadienyl)–, (4R)–)"। Organic Syntheses। 81: 147–156। ডিওআই:10.15227/orgsyn.081.0147।
- ↑ Donaldson, William (অক্টোবর ৮, ২০০১)। "Synthesis of cyclopropane containing natural products"। Tetrahedron। 57 (41): 8589। ডিওআই:10.1016/s0040-4020(01)00777-3।