আন্তঃআণবিক বল: সংশোধিত সংস্করণের মধ্যে পার্থক্য
সম্পাদনা সারাংশ নেই ট্যাগ: দৃশ্যমান সম্পাদনা মোবাইল সম্পাদনা মোবাইল ওয়েব সম্পাদনা |
সম্পাদনা সারাংশ নেই ট্যাগ: দৃশ্যমান সম্পাদনা মোবাইল সম্পাদনা মোবাইল ওয়েব সম্পাদনা |
||
| ৫৪ নং লাইন: | ৫৪ নং লাইন: | ||
যেখানে m = ডাইপোল মোমেন্ট, <math>\varepsilon_0</math> = ফাকা জায়গার অনুমতি, <math>\varepsilon_r</math> = ডাইলেকট্রিক ধ্রুবক, ''T'' = তাপমাত্রা, <math>k_\text{B}</math> = বোলসম্যান ধ্রুবক, and ''r'' = অণুসমূহের মধ্যকার দূরত্ব। |
যেখানে m = ডাইপোল মোমেন্ট, <math>\varepsilon_0</math> = ফাকা জায়গার অনুমতি, <math>\varepsilon_r</math> = ডাইলেকট্রিক ধ্রুবক, ''T'' = তাপমাত্রা, <math>k_\text{B}</math> = বোলসম্যান ধ্রুবক, and ''r'' = অণুসমূহের মধ্যকার দূরত্ব। |
||
'''ডিবাই (স্থায়ী-আবেশ ডাইপোল) বল''' |
|||
ভ্যানডার ওয়ালস বলের দ্বিতীয় অবদান। স্থায়ী ডাইপোলসমূহের ঘূর্ণন এবং পরমাণু ও অণুসমূহের (আবেশ ডাইপোল) মধ্যকার সম্পর্ক থেকে ডিবাই বল এসেছে। যখন একটি অণুর স্থায়ী ডাইপোল অপর অণুর ইলেকট্রনগুলোকে সরিয়ে দেয় তখন আবেশ ডাইপোলের সৃষ্টি হয়। স্থায়ী ডাইপোলধারী অণু নিজ ধর্মের অন্য অণুকে আবেশিত করে এবং পারস্পরিক আকর্ষণ ঘটায়। এই বল কেসম বলের মত তাপমাত্রার উপর নির্ভর করে না কারণ আবেশ ডাইপোলের স্থানান্তর ঘটতে পারে এবং পোলার অণুর চারপাশ ঘুরতে পারে। ডিবাই আবেশ প্রভাব এবং কেসম কাঠামো প্রভাবকে পোলার ক্রিয়া বলা হয়। |
|||
১৩:৪৭, ৯ অক্টোবর ২০২০ তারিখে সংশোধিত সংস্করণ
এই নিবন্ধ বা অনুচ্ছেদটি পরিবর্ধন বা বড় কোনো পুনর্গঠনের মধ্যে রয়েছে। এটির উন্নয়নের জন্য আপনার যে কোনো প্রকার সহায়তাকে স্বাগত জানানো হচ্ছে। যদি এই নিবন্ধ বা অনুচ্ছেদটি কয়েকদিনের জন্য সম্পাদনা করা না হয়, তাহলে অনুগ্রহপূর্বক এই টেমপ্লেটটি সরিয়ে ফেলুন। ৩ বছর আগে Khalid Hasan Shohag (আলাপ | অবদান) এই নিবন্ধটি সর্বশেষ সম্পাদনা করেছেন। (হালনাগাদ) |
অবদানকারীর মন্তব্য: নতুন নিবন্ধ |
আন্তঃআণবিক বল হচ্ছে দুটি পরমাণুর মধকার আকর্ষণ বা বিকর্ষণ বল, যা পরমাণুর মত অন্য কণার(আয়ন) মধ্যেও বিরাজ করে। আন্তঃআণবিক বল, অন্তঃআণবিক বল(যে বল মৌলের পরমাণুগুলোকে একত্রে ধরে রাখে) অপেক্ষা দুর্বল প্রকৃতির। যেমনঃ সমযোজী বন্ধন, যেখানে দুটি পরমাণু ইলেকট্রন যুগল শেয়ার করে তা আন্তঃআণবিক বল অপেক্ষা বেশি শক্তিশালী। উভয় প্রকার বলই বল ক্ষেত্রের প্রয়োজনীয় অংশ যা আণবিক গতিবিদ্যায় প্রায়ই ব্যবহৃত হয়।
আন্তঃআণবিক বলের অনুসন্ধান শুরু হয় সূক্ষ্ম পর্যবেক্ষণের ফলে যখন আণবিক পর্যায়ে বলের উপস্থিতি এবং ক্রিয়া সম্পর্কে ধারণা পাওয়া যায়। এসব পর্যবেক্ষণের মধ্যে বাস্তব গ্যাসের তাপগতিবিজ্ঞান এর আচরণ যেমন- ভাইরাল সহগ(Virial coefficient), বাষ্প চাপ, সান্দ্রতা, পৃষ্ঠটান, শোষণ উল্লেখযোগ্য।
আণবিক বল সম্পর্কে প্রথম ধারণা পাওয়া যায় আলেক্সিস ক্লেইরটের কাজ Theorie de la Figure de la Terre[১] এ। অন্যান্য বিজ্ঞানী যারা একাজে অবদান রেখেছেন তারা হলেন: পিয়ের সিমোঁ লাপ্লাস, কার্ল ফ্রিডরিশ গাউস, জেমস ক্লার্ক ম্যাক্সওয়েল, এবং লুডভিগ বোলৎসমান।
আন্তঃআণবিক আকর্ষন বলকে নিমোক্তভাগে ভাগ করা যায়:
•হাইড্রোজেন বন্ধন /H-বন্ধন
•আয়ন-সংঘটিত/আবেশিত ডাইপোল বল
•আয়ন-ডাইপোল বল
হাইড্রোজেন বন্ধন
হাইড্রোজেন বন্ধন হচ্ছে নিঃসঙ্গ ইলেকট্রন যুগলধারী তড়িৎ ঋণাত্বক পরমাণুর সাথে হাইড্রোজেন পরমানুর মধ্যকার আকর্ষন বল। সাধারণত হাইড্রোজেন-র সাথে নাইট্রোজেন, অক্সিজেন, ফ্লোরিন যুক্ত হয়ে এই বন্ধন গঠিত হয়[২]। হাইড্রোজেন বন্ধনকে প্রায়ই শক্তিশালী তড়িৎ(ইলেকট্রিক) মেরু-মেরু(ডাইপোল-ডাইপোল) পারস্পরিক ক্রিয়া হিশেবে বর্ণনা করা হয়। সমযোজী বন্ধনের মত এতেও কিছু বৈশিষ্ট্য আছে: এটা দিকমুখী, ভ্যান ডার ওয়াল বল থেকে শক্তিশালী, আন্তঃআণবিক দূরত্ব ভ্যানডার ওয়ালস বলে মৌলদ্বয়ের ব্যাসার্ধের যোগফল অপেক্ষা কম এবং যোজ্যতানুসারে সীমিত-সংখ্যক মৌলের সাথেও যুক্ত হয়। মৌলদ্বয় দ্বারা গঠিত হাইড্রোজেন বন্ধনের সংখ্যা তাদের সক্রিয় ইলেকট্রন যুগলের সমান। যে মৌল ইলেকট্রন দান করে(হাইড্রোজেন) তাকে দাতা, আর ইলেকট্রন গ্রহণকারী নিঃসঙ্গ ইলেকট্রন যুগলধারী তড়িৎ ঋণাত্বক পরমাণুকে গ্রহীতা বলে। সক্রিয় যুগলের মান বন্ধনে হাইড্রোজেন পরমাণুর ইলেকট্রন দান এবং তড়িৎ ঋণাত্বক পরমাণুর ইলেকট্রন গ্রহণ সংখ্যার সমান।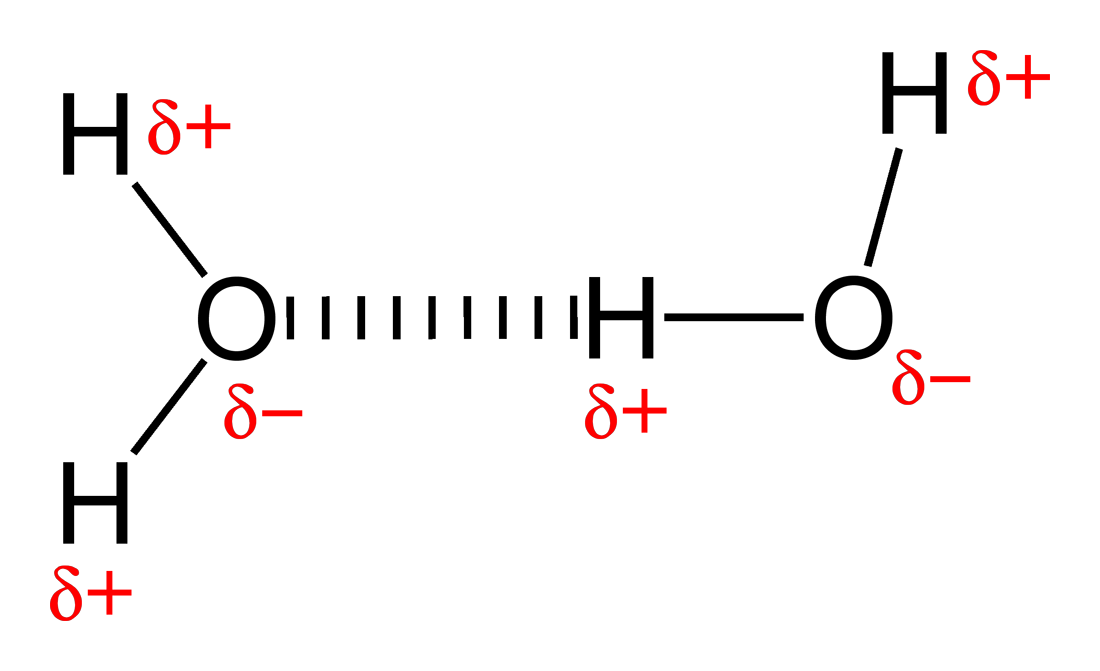
যদিও চিত্রে ঠিকভাবে বর্নণা করা যাচ্ছে না, পানির অণুতে ২টি সক্রিয় যুগল থাকে, অক্সিজেন পরমাণু ২টি হাইড্রোজেন পরমাণুর এর সাথে ২টি হাইড্রোজেন বন্ধন গঠন করে। আন্তঃআণবিক হাইড্রোজেন বন্ধনই পানির উচ্চ গলনাঙ্কের(১০০ °C) জন্য দায়ী। অন্তঃআণবিক হাইড্রোজেন বন্ধন প্রোটিন এবং নিউক্লিক এসিডসমূহের সেকেন্ডারি(২), টার্শিয়ারি(৩) এবং কোয়াটার্নারি(৪) গঠনের জন্য দায়ী। এছাড়াও পলিমারের প্রাকৃতিক এবং কৃত্রিম উভয় গঠনেই অন্তঃআণবিক হাইড্রোজেন বন্ধন গুরুত্বপূর্ণ ভূমিকা রাখে।[৩]
আয়নিক বন্ধন
প্রধান নিবন্ধ: আয়নিক বন্ধন
আয়নিক বন্ধন হচ্ছে ক্যাটায়ন এবং অ্যানায়ন এর মধ্যকার আকর্ষণ বল যেখানে কোনো ইলেকট্রনের শেয়ার হয় না, অথবা আন্তঃআণবিক ক্রিয়া যাকে আয়ন একীভূত(ক্যাটায়ন এবং অ্যানায়ন) বা লবণ সেতু বলা হয়[৪]। এর জন্য তড়িৎ বল প্রয়োজনীয়, যদিও প্রায়ই তাপহারী প্রক্রিয়া ও এনট্রপির মাধ্যমে চালিত হয়। কেলাসের বেশিরভাগ লবণের আয়নেরই আলাদা বৈশিষ্ট্য থাকে। অন্য অনেক তড়িতচুম্বক ক্রিয়ার মত লবণ সেতুসমূহ দিকবিহীন এবং কঠিন অবস্থায় তারা ভ্যানডার ওয়ালস বলের মাধ্যমে যুক্ত থাকে। একই লবণ সেতুতে জৈব আয়নের সাথে সাথে অজৈব আয়ন পানিতে আয়নিক শক্তি l প্রদর্শন করে, যেখানে ΔG এর মান ৫-৬ kJ/mol এর কাছাকাছি, (১ঃ১=ক্যাটায়নঃঅ্যানায়ন, স্বাধীন অবস্থায়)[৫] । ΔG এর মান সংযোজিত এবং বলা যায় চার্জের লিনিয়ার ফাংশন, দুই আধান বিশিষ্ট ফসফেট অ্যানায়ন একক আধান বিশিষ্ট অ্যামোনিয়াম ক্যাটায়ন যুক্ত হলে তাদের ΔG= ২x৫= ১০ kJ/mol। হাকেলের নীতি অনুসারে ΔG এর মান দ্রবণের আয়নিক শক্তির উপর নির্ভর করে, শূন্য আয়নিক শক্তিতে ΔG এর মান ৮ kJ/mol।
ডাইপোল-ডাইপোল এবং সমধর্মী মিথস্ক্রিয়া
নিয়মিত ডাইপোল
ডাইপোল-ডাইপোল বল হছে অণুসমূহের মধ্যকার তড়িৎ(স্থির) ক্রিয়া যাদের স্থায়ী ডাইপোল বিদ্যমান। এটা লন্ডন বল অপেক্ষা শক্তিশালী কিন্তু আয়নিক বন্ধন অপেক্ষা দুর্বল প্রকৃতির; কারণ এতে আংশিক আধান(ক্যাটায়ন বা অ্যানায়ন) বিদ্যমান। এটা অণুসমূহের নিজেদের মধ্যকার আকর্ষণ বৃদ্ধিতে ভূমিকা রাখে (বিভব শক্তি হ্রাস পায়)।হাইড্রোজেন বন্ধন একপ্রকার ডাইপোল-ডাইপোল আকর্ষণ বল। যেহেতু পরমাণুর মধ্যে ডাইপোলের ব্যপারটা লক্ষ্য করা যায় না, তাই দুটি ভিন্ন পরমাণুর মধ্যকার ডাইপোল-ডাইপোল আকর্ষণ বল সাধারণত শুন্য।
আয়ন-ডাইপোল এবং আয়ন-আবেশ ডাইপোল বল
আয়ন-ডাইপোল এবং আয়ন-আবেশ ডাইপোল বল, ডাইপোল-ডাইপোল এবং ডাইপোল-আবেশ ডাইপোল এর মতই কিন্তু এখানে শুধু পোলার এবং অপোলার অণুর পরিবর্তে আয়ন থাকে। আয়ন-ডাইপোল এবং আয়ন-আবেশ ডাইপোল বল, ডাইপোল-ডাইপোল বল থেকে শক্তিশালী, কারণ যেকোন আয়নের আধান ডাইপোল মোমেন্টের আধান থেকে অনেক বেশি। আয়ন-ডাইপোল বন্ধন হাইড্রোজেন বন্ধন থেকে শক্তিশালী।[৬]
একটি আয়ন এবং একটি পোলার অণু আয়ন-ডাইপোল বলের মাধ্যমে যুক্ত হয়।তারা সর্বোচ্চ আকর্ষণে এমনভাবে থাকে যাতে ধনাত্বক এবং ঋনাত্বক অংশ একে অপরের পর পর থাকে। উদাহরণ হিশেবে পানিতে আয়নের হাইড্রেশন, যা হাইড্রেশন এনথালপির মান বৃদ্ধি করে। পানির পোলার অণুসমূহ নিজেদের পানিতে আয়নের(বহিরাগত) চারপাশ ঘিরে ধরে এবং সেই সময়ে যে পরিমাণ শক্তি নির্গত করে তাকে হাইড্রেশন এনথালপি বলে। পানিতে বিভিন্ন আয়নের স্থায়িত্ব নির্ণয়ে এ প্রক্রিয়া গুরুত্বপূর্ণ।
একটি আয়ন এবং একটি অপোলার অণু আয়ন-আবেশ ডাইপোল বলের মাধ্যমে যুক্ত হয়।এক্ষেত্রে ডাইপোল-আবেশ ডাইপোল বলের মতই, আয়নের আধানের কারণে অপোলার অণুর ইলেকট্রন মেঘ বিকৃত(স্থানান্তর) হয়।[৭]
ভ্যানডার ওয়ালস বল
আধানবিহীন পরমাণু বা অণুসমূহ এর মধ্যকার মিথস্ক্রিয়া থেকে ভ্যানডার ওয়ালস বল এসেছে। এছাড়াও বিভিন্ন ঘনীভূত পর্যায়, গ্যাসের শোষণ এবং জগতের ক্ষুদ্র দেহগুলোর আকর্ষণ থেকেও এসেছে।[৮]
কেসম (স্থায়ী-স্থায়ী ডাইপোল) বল
আধানসমূহের মধ্যে স্থির তড়িৎ ক্রিয়া(অণুর আয়নে), ডাইপোলসমূহ(অপোলার অণু), কোয়াড্রপোল(সকল অণু যা কিউবিকের চেয়ে কম প্রতিসাম্য) এবং স্থায়ী মাল্টিপোল এর জন্য দায়ী কেসম বল(উইলিয়াম হেন্ড্রিক কেসমের নামে) যা ভ্যানডার ওয়ালস বলের প্রথম অবদান।[৯] স্থায়ী ডাইপোলসমূহের মধ্যকার আকর্ষণ থেকে এ বলের উৎপত্তি এবং তাপমাত্রার উপর নির্ভরশীল।[৮]
এটা ডাইপোলসমূহের মধ্যকার আকর্ষণ বল যা বিভিন্ন ঘূর্ণন কাঠামো ডাইপোলের জড়ো গড় নিয়ে গঠিত। এটা ধারণা করা হয় যে অণুসমূহ প্রতিনিয়ত ঘুরতে থাকে এবং কখনোই এক জায়গায় স্থির থাকে না। এটা যদিও ভালো ধারণা, কিন্তু কোন কোন বিন্দুতে অণুসমূহ স্থির থাকে। কেসম বলের শক্তি দূরত্বের(অণুসমূহের) ষষ্ঠ ঘাতের বিপরীত মানের উপর নির্ভর করে। কেসম বল কেবল সেইসব অণুর মধ্যে ঘটতে পারে যাদের স্থায়ী ডাইপোল বিদ্যমান। কেসম খুবই দুর্বল প্রকৃতির ভ্যানডার ওয়ালস বল এবং জলীয় দ্রবণে ঘটে না। কৌণিক গড়ের সমীকরণ:
যেখানে m = ডাইপোল মোমেন্ট, = ফাকা জায়গার অনুমতি, = ডাইলেকট্রিক ধ্রুবক, T = তাপমাত্রা, = বোলসম্যান ধ্রুবক, and r = অণুসমূহের মধ্যকার দূরত্ব।
ডিবাই (স্থায়ী-আবেশ ডাইপোল) বল
ভ্যানডার ওয়ালস বলের দ্বিতীয় অবদান। স্থায়ী ডাইপোলসমূহের ঘূর্ণন এবং পরমাণু ও অণুসমূহের (আবেশ ডাইপোল) মধ্যকার সম্পর্ক থেকে ডিবাই বল এসেছে। যখন একটি অণুর স্থায়ী ডাইপোল অপর অণুর ইলেকট্রনগুলোকে সরিয়ে দেয় তখন আবেশ ডাইপোলের সৃষ্টি হয়। স্থায়ী ডাইপোলধারী অণু নিজ ধর্মের অন্য অণুকে আবেশিত করে এবং পারস্পরিক আকর্ষণ ঘটায়। এই বল কেসম বলের মত তাপমাত্রার উপর নির্ভর করে না কারণ আবেশ ডাইপোলের স্থানান্তর ঘটতে পারে এবং পোলার অণুর চারপাশ ঘুরতে পারে। ডিবাই আবেশ প্রভাব এবং কেসম কাঠামো প্রভাবকে পোলার ক্রিয়া বলা হয়।
- ↑ "Margenau, H. and Kestner, N. (1969) Theory of inter-molecular forces, International Series of Monographs in Natural Philosophy, Pergamon Press, ISBN 1483119289"। Wikipedia (ইংরেজি ভাষায়)। ২০২০-০৯-২৩।
- ↑ "IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997)"। Wikipedia (ইংরেজি ভাষায়)। ২০২০-০৯-২৩।
- ↑ "Lindh, Ulf (2013), "Biological functions of the elements", in Selinus, Olle (ed.), Essentials of Medical Geology (Revised ed.), Dordrecht: Springer, pp. 129–177, doi:10.1007/978-94-007-4375-5_7, ISBN 978-94-007-4374-8"। Wikipedia (ইংরেজি ভাষায়)। ২০২০-০৯-২৩।
- ↑ Ionic interactions in natural and synthetic macromolecules। Ciferri, A., Perico, Angelo.। Hoboken, NJ: Wiley। ২০১২। আইএসবিএন 978-1-118-16586-7। ওসিএলসি 778434029।
- ↑ Biedermann, Frank; Schneider, Hans-Jörg (২০১৬-০৫-১১)। "Experimental Binding Energies in Supramolecular Complexes"। Chemical Reviews (ইংরেজি ভাষায়)। 116 (9): 5216–5300। আইএসএসএন 0009-2665। ডিওআই:10.1021/acs.chemrev.5b00583।
- ↑ Tro, Nivaldo J.। Chemistry : a molecular approach (Second edition সংস্করণ)। Upper Saddle River, NJ। আইএসবিএন 978-0-321-65178-5। ওসিএলসি 324783713।
- ↑ Zeegers-Huyskens, Th.; Huyskens, P. (১৯৯১)। Intermolecular Forces। Berlin, Heidelberg: Springer Berlin Heidelberg। পৃষ্ঠা 1–30। আইএসবিএন 978-3-642-76262-8।
- ↑ ক খ Leite, Fabio L.; Bueno, Carolina C.; Da Róz, Alessandra L.; Ziemath, Ervino C.; Oliveira, Osvaldo N. (২০১২-১০-০৮)। "Theoretical Models for Surface Forces and Adhesion and Their Measurement Using Atomic Force Microscopy"। International Journal of Molecular Sciences। 13 (12): 12773–12856। আইএসএসএন 1422-0067। ডিওআই:10.3390/ijms131012773।
- ↑ Saksena, M.P.; Saxena, S.C. (1965-08)। "Second virial coefficient of non-polar non-spherical molecules"। Physics Letters। 18 (2): 120–122। আইএসএসএন 0031-9163। ডিওআই:10.1016/0031-9163(65)90679-7। এখানে তারিখের মান পরীক্ষা করুন:
|তারিখ=(সাহায্য)




