তাপগতিবিদ্যার সূত্র
| তাপগতিবিজ্ঞান |
|---|
 |
| পুস্তক:তাপগতিবিদ্যা |
তাপগতিবিদ্যার মৌলিক সূত্র চারটি, মূলত পরীক্ষামূলক সত্য প্রকাশ করে এবং তাপীয় সাম্যাবস্থায় তাপগতীয় প্রক্রিয়া ও তাপগতীয় সিস্টেমকে বৈশিষ্ট্য প্রদানকারী তাপমাত্রা, তাপ, তাপগতীয় কাজ ও বিশৃঙ্খলা-মাত্রা (এনট্রপি) এসব ভৌত পরিমাণসমূহ সংজ্ঞায়িত করে। তাপগতিবিদ্যার পাশাপাশি পদার্থবিজ্ঞান ও রসায়নেও সূত্রগুলোর প্রয়োগ লক্ষ্য করা যায়।
ঐতিহ্যগতভাবে, তাপগতিবিদ্যার তিনটি সূত্র রয়েছে: প্রথম সূত্র, দ্বিতীয় সূত্র ও তৃতীয় সূত্র।[১][২][৩] আরো মৌলিক একটি বক্তব্যকে পরবর্তীতে 'শূন্যতম সূত্র' তকমা দেওয়া হয়।
তাপগতিবিদ্যার শূন্যতম সূত্র তাপীয় সাম্যাবস্থাকে সংজ্ঞায়িত করে এবং তাপমাত্রাকে সংজ্ঞায়িত করার ভিত্তি তৈরী করে। এটি বলে, যদি দুটি সিস্টেমের উভয়েই তৃতীয় আরেকটি সিস্টেমের সাথে তাপীয় সাম্যাবস্থায় থাকে, তবে তারা প্রত্যেকেই পরস্পরের সাথে তাপীয় সাম্যাবস্থায় থাকবে।
তাপগতিবিদ্যার প্রথম সূত্র বলে, যখন কোনো সিস্টেমের ভেতর দিয়ে শক্তি (তাপ, কাজ বা পদার্থ) প্রবাহিত হয় তখন সিস্টেমের অভ্যন্তরীণ শক্তি, শক্তির নিত্যতা সূত্র অনুযায়ী পরিবর্তিত হয়।
তাপগতিবিদ্যার দ্বিতীয় সূত্র মূলত দুইভাবে বিবৃত করা যায়। সম্ভাব্য প্রক্রিয়ার ক্ষেত্রে, রুডলফ ক্লাউজিউস বলেছেন, স্বয়ংক্রিয়ভাবে নিম্ন তাপমাত্রা থেকে উচ্চ তাপমাত্রার স্থানে তাপের স্থানান্তর সম্ভব নয়। বিশৃঙ্খলা-মাত্রার হিসাবে, একটি স্বাভাবিক তাপগতীয় প্রক্রিয়ায় সিস্টেমগুলোর বিশৃঙ্খলা-মাত্রার যোগফল সর্বদাই বৃদ্ধি পায়।
তাপগতিবিদ্যার তৃতীয় সূত্র বলে, কোনো সিস্টেমের তাপমাত্রা পরম শূন্যের দিকে ধাবিত হলে বিশৃঙ্খলা-মাত্রাও একটি ধ্রুব মানের দিকে ধাবিত হয়। অ-স্ফটিক পদার্থ (কাঁচ) ব্যতীত সকল সিস্টেমের বিশৃঙ্খলা-মাত্রা পরম শূন্য তাপমাত্রায় সাধারণত শূন্যের কাছাকাছি হয়।[২]
শূন্যতম সূত্র[সম্পাদনা]
তাপগতিবিদ্যার শূন্যতম সূত্র তাপগতীয় সিস্টেমে তাপমাত্রাকে একটি প্রায়োগিক পরামিতি হিসেবে স্থাপণের ভিত্তিমূল তৈরী করে। সূত্রটি নিম্নরূপ:
- যদি দুটি সিস্টেমের উভয়েই তৃতীয় আরেকটি সিস্টেমের সাথে তাপীয় সাম্যাবস্থায় থাকে, তবে তারা প্রত্যেকেই পরস্পরের সাথে তাপীয় সাম্যাবস্থায় থাকবে।[৪]
যদিও সূত্রের এই সংস্করণটি শূন্যতম সূত্র হিসেবে সর্বাধিক বর্ণিত, তবুও এটি শূন্যতম সূত্র তকমা পাওয়া অনেকগুলো বিবৃতির অন্যতম। কিছু বিবৃতি আরও এগিয়ে গিয়ে এই গুরুত্বপূর্ণ ভৌত তথ্য সরবরাহ করে যে, তাপমাত্রা এক-মাত্রিক এবং কেউ ধারণাগতভাবে, বাস্তব সংখ্যার ক্রমানুসারে শীতল থেকে উষ্ণ বস্তুসমূহ সজ্জিত করতে পারে।[৫][৬][৭]
তাপমাত্রা এবং তাপীয় সাম্যাবস্থা সম্পর্কে এইসব ধারণা মৌলিক এবং উনিশ শতকেই এগুলো পরিষ্কারভাবে বর্ণিত হয়েছিলো। 'শূন্যতম সূত্র' নামটি প্রথম, দ্বিতীয় ও তৃতীয় সূত্র ব্যাপকভাবে পরিচিত হওয়ার অনেক পরে ১৯৩০ এর দশকে রালফ এইচ ফাওলার কর্তৃক প্রদানকৃত। এই সূত্রের মাধ্যমে তাপমাত্রার অনুবন্ধী চলক বিশৃঙ্খলা-মাত্রার উল্লেখ ব্যতীতই তাপমাত্রার সংজ্ঞায়ন সম্ভব। তাপমাত্রার এধরণের সংজ্ঞায়নকে বলা হয় গবেষণালব্ধ বা এম্পিরিকাল।[৮][৯][১০][১১][১২][১৩]
প্রথম সূত্র[সম্পাদনা]
তাপগতিবিদ্যার প্রথম সূত্র তাপগতীয় সিস্টেমের ক্ষেত্রে শক্তির নিত্যতা সূত্রেরই একটি সংস্করণ। সহজ কথায়, এই সূত্র বলে যে বিচ্ছিন্ন সিস্টেমের ক্ষেত্রে শক্তির পরিমাণ ধ্রুব থাকে; শক্তি একরূপ থেকে অন্যরূপে রূপান্তরিত করা গেলেও তা সৃষ্টি বা ধ্বংস করা যায়না।
- বিচ্ছিন্ন সিস্টেমে ( অর্থাৎ পরিবেশের সাথে ভরের কোনো বিনিময় নেই), প্রথম সূত্র অনুযায়ী সিস্টেমের অভ্যন্তরীণ শক্তির পরিবর্তন (ΔUsystem), সিস্টেম দ্বারা গৃহীত তাপ (Q) ও পারিপার্শ্বিকের ওপর সিস্টেম দ্বারা কৃতকাজ (W) এর পার্থক্যের সমান।
ভরের বিনিময় অন্তর্ভুক্ত প্রক্রিয়াগুলির জন্য, আরও বিবৃতি প্রয়োজন।
- যখন প্রাথমিকভাবে বিচ্ছিন্ন দুটি সিস্টেম একত্রিত করে একটি নতুন সিস্টেম গঠিত হয়, তখন নতুন সিস্টেমের মোট অভ্যন্তরীণ শক্তি ,Usystem, প্রাথমিক সিস্টেম দুইটির অভ্যন্তরীণ শক্তি, U1 ও U2 এর যোগফলের সমান হবে:
দ্বিতীয় সূত্র[সম্পাদনা]
তাপগতিবিদ্যার দ্বিতীয় সূত্র প্রাকৃতিক প্রক্রিয়াসমূহের অপ্রত্যাবর্তীতা এবং অনেক ক্ষেত্রে প্রাকৃতিক প্রক্রিয়াসমূহের ভর, শক্তি ও বিশেষত তাপমাত্রার স্থানিক এককতায় পৌছানোর প্রবণতাকে নির্দেশ করে। এটি বেশ কয়েকটি আকর্ষণীয় উপায়ে প্রকাশ করা যায়। সহজতম একটি হলো ক্লাউজিউসের বিবৃতি, যা বলে, স্বয়ংক্রিয়ভাবে নিম্ন তাপমাত্রা থেকে উচ্চ তাপমাত্রার স্থানে তাপের স্থানান্তর সম্ভব নয়।
এটি তাপগতীয় ব্যাবস্থার ক্ষেত্রে বিশৃঙ্খলা-মাত্রার উপস্থিতি নির্দেশ করে। এই পরিমাপের ভিত্তিতে:
- যখন প্রাথমিকভাবে তাপীয় সাম্যাবস্থায় থাকা দুটি সিস্টেম আলাদা কিন্তু কাছাকাছি স্থানে এসে মিথষ্ক্রিয়া ঘটায়, শেষ পর্যন্ত তারা পারস্পরিক তাপীয় সাম্যাবস্থায় পৌছাবে। প্রাথমিক সিস্টেম দুটির বিশৃঙ্খলা-মাত্রার যোগফল চূড়ান্ত মিশ্রণের বিশৃঙ্খলা-মাত্রার সমান অথবা কম হবে। সমতা তখনই তৈরী হবে যখন মূল সিস্টেম দুটির নিজ নিজ চলকগুলোর (তাপমাত্রা, চাপ) মান সমান হবে; তখন চূড়ান্ত সিস্টেমটির মানগুলোও একই হবে।
দ্বিতীয় সূত্রটি প্রত্যাবর্তী ও অপ্রত্যাবর্তী উভয় প্রক্রিয়ার ক্ষেত্রে প্রযোজ্য। দ্বিতীয় সূত্র অনুযায়ী, প্রত্যাবর্তী তাপ বিনিময়ে, স্থানান্তরিত তাপের একটি উপাদান, δQ, হলো তাপমাত্রা (T) ও সিস্টেমের অনুবন্ধী চলক বিশৃঙ্খলা-মাত্রার (S) বৃদ্ধি dS এর গুণফলের সমান:
তৃতীয় সূত্র[সম্পাদনা]
তাপগতিবিদ্যার তৃতীয় সূত্রটি হলো:[২]
- কোনো সিস্টেমের তাপমাত্রা পরম শূন্যের দিকে ধাবিত হলে বিশৃঙ্খলা-মাত্রাও একটি ধ্রুব মানের দিকে ধাবিত হয়।
শূন্য তাপমাত্রায়, সিস্টেমকে সর্বনিম্ন তাপীয় শক্তিসম্পন্ন দশায় থাকতে হয় (গ্রাউন্ড স্টেট)। এই অবস্থায় বিশৃঙ্খলা-মাত্রার ধ্রুব মানটিকে উদ্বৃত্ত বিশৃঙ্খলা-মাত্রা ( রেসিডুয়াল এনট্রপি) বলা হয়। উল্লেখ্য যে, অ-স্ফটিক পদার্থের (কাঁচ) ব্যাতিক্রম ছাড়া অন্য সবার ক্ষেত্রে রেসিডুয়াল এনট্রপির মান সাধারণত শূন্যের কাছাকাছি হয়।[২] তবে এটি কেবল শূন্যে পৌছাবে যখন সিস্টেমটি একটি অনন্য গ্রাউন্ড স্টেট থাকবে (সর্বনিম্ন তাপীয় শক্তিসম্পন্ন দশার একটিমাত্র মাইক্রোদশা রয়েছে)। মাইক্রোদশা এখানে একটি সিস্টেমের নির্দিষ্ট অবস্থায় থাকার সম্ভাব্যতা বর্ণনা করতে ব্যবহৃত হচ্ছে, যেহেতু প্রতিটি মাইক্রোদশা থাকার সমান সম্ভাবনা রয়েছে বলে ধরে নেওয়া হয়, তাই কম মাইক্রোদশাসম্পন্ন ম্যাক্রোস্কোপিক দশা থাকার সম্ভাবনাও কম হয়ে থাকে। সাধারণভাবে, বোল্টজম্যান নীতি অনুযায়ী, বিশৃঙ্খলা মাত্রা সম্ভাব্য মাইক্রোদশার সংখ্যার সাথে সম্পর্কিত:
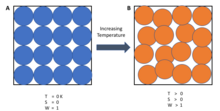
যেখানে S হলো সিস্টেমের বিশৃঙ্খলা মাত্রা, kB বোলট্জম্যান ধ্রুবক এবং Ω হলো মাইক্রোদশার সংখ্যা। পরম শূন্য তাপমাত্রায় কেবলমাত্র একটি মাইক্রোদশা সম্ভব (Ω = ১ যেহেতু একটি খাঁটি পদার্থের জন্য সকল অণু অভিন্ন এবং ফলস্বরূপ কেবলমাত্র একটি সংমিশ্রণ সম্ভব বলে সকল বিন্যাস অভিন্ন হয়) এবং ln(১) = ০।
আরও দেখুন[সম্পাদনা]
তথ্যসূত্র[সম্পাদনা]
- ↑ ক খ Guggenheim, E.A. (1985). Thermodynamics. An Advanced Treatment for Chemists and Physicists, seventh edition, North Holland, Amsterdam, আইএসবিএন ০-৪৪৪-৮৬৯৫১-৪.
- ↑ ক খ গ ঘ Kittel, C. Kroemer, H. (1980). Thermal Physics, second edition, W.H. Freeman, San Francisco, আইএসবিএন ০-৭১৬৭-১০৮৮-৯.
- ↑ Adkins, C.J. (1968). Equilibrium Thermodynamics, McGraw-Hill, London, আইএসবিএন ০-০৭-০৮৪০৫৭-১.
- ↑ Guggenheim (1985), p. 8.
- ↑ Sommerfeld, A. (1951/1955). Thermodynamics and Statistical Mechanics, vol. 5 of Lectures on Theoretical Physics, edited by F. Bopp, J. Meixner, translated by J. Kestin, Academic Press, New York, p. 1.
- ↑ Serrin, J. (1978). The concepts of thermodynamics, in Contemporary Developments in Continuum Mechanics and Partial Differential Equations. Proceedings of the International Symposium on Continuum Mechanics and Partial Differential Equations, Rio de Janeiro, August 1977, edited by G.M. de La Penha, L.A.J. Medeiros, North-Holland, Amsterdam, আইএসবিএন ০-৪৪৪-৮৫১৬৬-৬, pp. 411–51.
- ↑ Serrin, J. (1986). Chapter 1, 'An Outline of Thermodynamical Structure', pp. 3–32, in New Perspectives in Thermodynamics, edited by J. Serrin, Springer, Berlin, আইএসবিএন ৩-৫৪০-১৫৯৩১-২.
- ↑ Adkins, C.J. (1968/1983). Equilibrium Thermodynamics, (first edition 1968), third edition 1983, Cambridge University Press, আইএসবিএন ০-৫২১-২৫৪৪৫-০, pp. 18–20.
- ↑ Bailyn, M. (1994). A Survey of Thermodynamics, American Institute of Physics Press, New York, আইএসবিএন ০-৮৮৩১৮-৭৯৭-৩, p. 26.
- ↑ Buchdahl, H.A. (1966), The Concepts of Classical Thermodynamics, Cambridge University Press, London, pp. 30, 34ff, 46f, 83.
- ↑ *Münster, A. (1970), Classical Thermodynamics, translated by E.S. Halberstadt, Wiley–Interscience, London, আইএসবিএন ০-৪৭১-৬২৪৩০-৬, p. 22.
- ↑ Pippard, A.B. (1957/1966). Elements of Classical Thermodynamics for Advanced Students of Physics, original publication 1957, reprint 1966, Cambridge University Press, Cambridge, p. 10.
- ↑ Wilson, H.A. (1966). Thermodynamics and Statistical Mechanics, Cambridge University Press, London, pp. 4, 8, 68, 86, 97, 311.
বিস্তারিত পঠন[সম্পাদনা]
পরিচায়ক[সম্পাদনা]
- Atkins, Peter (2007). Four Laws That Drive the Universe. OUP Oxford. আইএসবিএন ৯৭৮-০১৯৯২৩২৩৬৯
- Goldstein, Martin & Inge F. (1993). The Refrigerator and the Universe. Harvard Univ. Press. আইএসবিএন ৯৭৮-০৬৭৪৭৫৩২৫৯
অগ্রবর্তী[সম্পাদনা]
- Guggenheim, E.A. (1985). Thermodynamics. An Advanced Treatment for Chemists and Physicists, seventh edition. আইএসবিএন ০-৪৪৪-৮৬৯৫১-৪
- Adkins, C. J., (1968) Equilibrium Thermodynamics. McGraw-Hill আইএসবিএন ০-০৭-০৮৪০৫৭-১








